Az inhaláló szereket világszerte sok ember használja visszaélésként. Ezeket az anyagokat számos olcsó és legálisan hozzáférhető kereskedelmi forgalomban találják (hígítók, benzin és ragasztók stb.), Amelyek széles körben elérhetők a szupermarketekben, a munkahelyeken és az interneten (Ridenour et al., 2007). Az Amerikai Egyesült Államokban a tinédzserek körülbelül 5,2% -a számolt be életének legalább egyszer inhalációs használatáról (Johnston et al., 2014). Az illékony vegyületeket különféle módszerekkel lehet belélegezni, amelyeket “szippantásnak”, “horkolásnak”, “dühöngésnek” és “zsákolásnak” neveznek. Az inhaláció időtartama általában néhány perc (10–15 perc). Ebben az időszakban azonban nagy koncentrációjú (6000 ppm feletti) oldószert lehet belélegezni, és ez a rutin naponta többször elvégezhető (Bowen és mtsai., 2006).
Az oldószerek belégzése káros hatása az agyra, súlyos szisztémás károsodásokat okoz, és növeli az öngyilkosság és a halál kockázatát (Ridenour et al., 2007). Az oldószerrel való visszaélés neurológiai rendellenességeket, köztük pszichiátriai betegségeket, például depressziót, szorongást, bipoláris hangulati rendellenességet és függőséget eredményezhet (Ridenour et al., 2007). A szerves oldószerek hosszú távú expozíciója krónikus encephalopathiát is okozhat, amelyet az agyi struktúrák rendellenességei és a kognitív diszfunkció jellemez (Ramcharan et al., 2014).
Általában a kereskedelmi forgalomban lévő oldószerekkel való visszaélés a számos illékony anyag, például toluol, n-hexán, xilol és benzol. Ez megnehezíti az egyes alkotórészek neurotoxikus hatásainak tanulmányozását (Ramcharan et al., 2014). Ezért a kutatóknak meg kell vizsgálniuk az egyes oldószerek hatásait, hogy tisztázzák szerepüket az agy degenerációjában és a neurológiai károsodásban.
A ciklohexán egy illékony anyag, amely szerepet játszik a kognitív állapot romlásában (Bespalov et al., 2003; Lammers és mtsai., 2009). Kezdetben a ciklohexánt a benzol és a toluol biztonságos helyettesítőjének tekintették, mivel hiányzik a rákkeltő hatása és alacsony toxicitása van (Sikkema et al., 1995; Yuasa et al., 1996). A ciklohexán azonban erősen lipofil molekula, amely könnyen diffundálhat az idegszöveten keresztül, és számos agyi régiót megcélozhat (1. ábra). A ciklohexán inhaláció idegrendszerre gyakorolt hatását először a cipőknél értékelték. Az oldószer alacsony szintjének 6 órás expozíciója után az alanyok homályos látást (Yasugi et al., 1994), álmosságot, szédülést, végtaggyengeséget, érzékszervi zavarokat (hypoesthesia és paresthesia), valamint a medián, ulnar és peroneális idegek (Mutti et al., 1982; Yuasa et al., 1996). A mérsékelt ciklohexán-koncentrációnak (250 ppm) kitett önkéntesek magasabb fejfájás, torokszárazság és verbális memóriazavar előfordulási gyakoriságáról számoltak be, mint azok a személyek, akiknek a vegyület nagyon alacsony koncentrációja volt kitéve (25 ppm; Lammers et al., 2009). Ebben a tanulmányban Lammers et al. (2009) szerint a ciklohexán-koncentrációk megfeleltek a tipikus foglalkozási expozíciós szinteknek. A ciklohexán rekreációs dózisainak (gyakran 6000 ppm felett) hatása azonban továbbra sem ismert. Az idegi degenerációt kiváltó ciklohexán minimális koncentrációjának meghatározása segítene a szabályozóknak korlátokat szabni az oldószer koncentrációjára a kereskedelemben kapható termékekben.
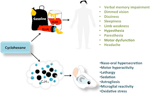
1. ábra A ciklohexán inhalációja után megfigyelt viselkedési és szövettani változások embereknél és rágcsálóknál.
Az oldószerrel visszaélők klinikai jellemzői közé tartozik a motoros károsodás, az eufória, az ingerlékenység, az ataxia és a depresszió. Az olyan oldószerek, mint a toluol és a triklór-etilén (TCE), kétfázisú dózis-válasz görbéket mutatnak, amelyeket motoros gerjesztés jellemez alacsony expozíciós szint mellett, valamint motoros károsodás, szedáció és érzéstelenítés magas expozíciós szint mellett (Bowen et al., 2006). Érdekes módon hasonló kétfázisú dózis-válaszhatást írtak le a ciklohexánnak kitett egereknél, és neurohisztológiai változásokkal társul (Campos-Ordonez et al., 2015). Ezen túlmenően ezek az illékony oldószerek drámai szerkezeti változásokat okoznak az agyban, beleértve az agykéreg, a fehérállomány, a corpus callosum, a hippocampus, az agytörzs, a kisagy, a bazális ganglionok, a vörös magok és a substantia nigra atrófiáját (Fan és mtsai, 2014; Ramcharan és mtsai., 2014). A toluol, az 1-bróm-propán, a TCE és a diklór-metán expozíciójának kísérleti modelljei rámutattak az asztrocita-reaktivitás és a mikroglia válasz jelenlétére a hippocampusban, a kisagyban és az agykéregben. Az agyi sértésekre adott asztrogliális választ a megnövekedett sejtproliferáció, hipertrófia és a glia fibrilláris savas fehérje fokozott expressziója jellemzi (GFAP; Gonzalez-Perez et al., 2015).Összehasonlításképpen, a mikroglia reakcióját drámai morfológiai változások jellemzik, amelyek magukban foglalják az amoeboid morfológiára való áttérést és a sejtes folyamatok csökkenését (Gonzalez-Perez et al., 2012).
Ciklohexán ezekre jellemző koncentrációkban a rekreációs drogfogyasztók által használt (9000 ppm) gliasejt-választ is kivált a hippocampusban (Campos-Ordonez et al., 2015). Az asztrocita és a mikroglia válaszoknak kettős és ellentétes hatása lehet a központi idegrendszerre. Ezek a sejtek neuroprotektívek lehetnek, mert számos neurotróf tényezőt választanak ki és eltávolítják a toxinokat (Gonzalez-Perez et al., 2015). Ezek a sejtek azonban neurotoxikus hatást is fejthetnek ki, mert gyulladásos citokineket választanak ki, és nitrogén-oxidot és más reaktív oxigénfajokat (ROS) termelnek, amelyek idegsejtkárosodáshoz és sejthalálhoz vezetnek (Gonzalez-Perez et al., 2012).
A molekuláris mechanizmusok, amelyek az oldószerhasználók agyában található citoarchitekturális változások alapját képezik, nem tisztázottak. Egy nemrégiben készült tanulmány azonban azt találta, hogy a ciklohexán elősegíti az AP endonukleáz 1 (APE1) túlzott expresszióját a hippokampuszban. Ez a fehérje aktiválja a sejtek reakcióját az oxidatív stresszre, és szabályozza az idegsejtek túlélésében és a DNS-helyreállításban részt vevő gének transzkripcióját (Campos-Ordonez et al., 2015). Ez arra utal, hogy a ciklohexán megzavarja a sejtek redox egyensúlyát, és befolyásolja a szövet ROS méregtelenítő képességét. A ROS felhalmozódása a sejtek diszfunkcióját okozza a membránok, lipidek, fehérjék, mitokondriumok és DNS károsodásával. További vizsgálatokra van azonban szükség a ROS szerepének tisztázásához a ciklohexán által kiváltott neurodegenerációban.
A ciklohexán növekvő használata a benzol vagy toluol viszonylag biztonságos helyettesítőjeként számtalan kereskedelmi termékben, beleértve az elektronikus cigarettákat is. az oldószer biológiai hatásainak jobb megértését teszi szükségessé. A ciklohexán által kiváltott idegi degeneráció sejtes és molekuláris mechanizmusainak betekintése segít minimalizálni az illékony vegyület szándékos vagy véletlen belélegzésével járó potenciális kockázatot.
Szerzői közreműködések
TC: Munka koncepció és kéziratírás. OG: Munkafelfogás, kéziratok írása és finanszírozása.
Összeférhetetlenségi nyilatkozat
A szerzők kijelentik, hogy a kutatást bármilyen kereskedelmi vagy pénzügyi kapcsolat hiányában végezték, amely úgy értelmezhető, hogy potenciális összeférhetetlenség.
Köszönetnyilvánítás
Szeretnénk megköszönni a Red Tematica Neuro-Biopsicologia Básica y Aplicada (CONACYT 251132) támogatását.