Malignus intravascularis gyulladás
A szepszist rosszindulatú intravascularis gyulladás folyamatának nevezték . Normál esetben egy erős, komplex, immunológiai kaszkád biztosítja az emberekben a mikroorganizmusok inváziójára adott gyors védelmi választ. A hiányos immunológiai védekezés lehetővé teheti a fertőzés létrejöttét; a túlzott vagy rosszul szabályozott válasz azonban károsíthatja a gazdaszervezetet az őshonos eredetű gyulladásos vegyületek maladaptív felszabadulásával (lásd az alábbi képet).
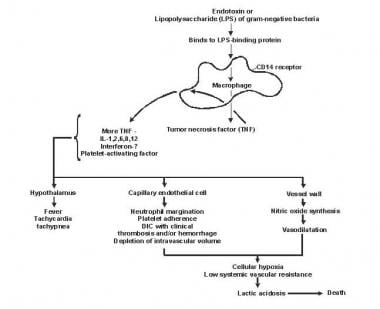 A szepszis és a multiorganikus kudarc patogenezise.
A szepszis és a multiorganikus kudarc patogenezise. A Lipid A és más baktériumtermékek citokint és más immunmodulátort szabadítanak fel, amelyek közvetítik a szepszis klinikai megnyilvánulásait. Az interleukinek, a tumor nekrózisfaktor (TNF) -α, az interferon gamma (IFN-γ) és más kolóniastimuláló faktorok gyorsan termelődnek perceken vagy órákon belül a monociták és makrofágok lipiddel való interakciója után.
A gyulladásos mediátor felszabadulása önstimuláló folyamattá válik, és más ilyen mediátorok, köztük az interleukin (IL) -1, a vérlemezke-aktiváló faktor, az IL-2, az IL-6, az IL-8, az IL-10 felszabadulása és a nitrogén-oxid (NO) tovább növeli a citokin szintjét. Ez a polimorfonukleáris leukociták (PMN), a makrofágok és a limfociták folyamatos aktiválódásához vezet; a gyulladásos mediátorok több ilyen sejtet toboroznak. Mindezek a folyamatok destruktív immunológiai disszonancia állapotot hoznak létre.
A szepszist autodestruktív folyamatnak nevezik, amely lehetővé teszi a fertőzésre adott normális patofiziológiai válasz kiterjesztését, amellyel egyébként normális szövetek és eredmények is szerepet kapnak. a MODS-ban. Szervműködési zavar vagy szervelégtelenség lehet a szepszis első klinikai jele, és egyetlen szervrendszer sem védett a szepszis gyulladásos túlzásainak következményeitől. A mortalitás növekszik a szervi elégtelenség növekedésével.
Bár kontrollálatlan, miután a MODS kifejlesztette a szisztémás bizonyítékokat mind a proinflammatorikus, mind a gyulladáscsökkentő up-regulációra, arra utal, hogy a host defence homeostasis kudarca az utolsó út a szepszistől a MODS-ig, nem pedig az egyszerű hipotenzió által kiváltott végszervi sérülés, mint ami vérzéses sokk esetén előfordulhat. A súlyos szepszis és a MODS túlélése általában a gyulladásos és gyulladáscsökkentő válasz általános csökkenésével jár.
Nemrégiben megjelent egy új hipotézis, miszerint a súlyos szepszisben való túléléshez a szervezet immunválaszának, energetikai funkcióinak és a kapcsolódó szervek teljesítményének általános szabályozása. Így a MODS a gazdaszervezet adaptív reakciója révén képes a mindent elsöprő gyulladásra, lehetővé téve a gyulladás kitisztulását anélkül, hogy végleges szervi károsodást okozna. Amint az alábbiakban tárgyaltuk, minden szerv olyan általános generalizáltságot mutat, amely egészségi állapotában egyértelműen rendellenes, de súlyos szepszisben túlélési stratégiát jelenthet.
A szervrendszer működési zavarai
Keringési zavarok
A vérkeringés autoregulációjának jelentős eltérése jellemző a szepszisre. A vazoaktív mediátorok értágulatot okoznak, és növelik a mikrovaszkuláris permeabilitást a fertőzés helyén. Az NO központi szerepet játszik a szeptikus sokk értágulatában. A vazopresszin károsodott szekréciója is előfordulhat, ami lehetővé teszi a vazodilatáció fennmaradását.
A szepszisben változások következnek be mind a szisztolés, mind a diasztolés kamrai teljesítményben. A Frank-Starling mechanizmus alkalmazásával a szívteljesítmény gyakran megnő a vérnyomás fenntartása érdekében szisztémás értágulat jelenlétében. A már meglévő szívbetegségben szenvedő betegek nem képesek megfelelően növelni a szívteljesítményüket.
Regionálisan a szepszis zavarja a szervrendszerek szisztémás véráramlásának normális eloszlását. Következésképpen előfordulhat, hogy a központi szervek nem jutnak megfelelő oxigénszállításhoz, és ennek az eredménye az úgynevezett regionális hipoperfúzió.
A mikrocirkuláció a szepszis sérülésének fő célszerve, mivel a vaszkuláris endothelium általánosan érintett a keringő gyulladásos mediátorok által. Bár nem világos, hogy a mikrocirkulációs rendellenességek okozzák-e vagy ártatlanul szemlélik a végszerv sérülését, egyértelmű mikrovaszkuláris diszfunkció látható. A perfundált kapillárisok számának csökkenése látható, bár az értágító terápiák alkalmazásával teljes mikrovaszkuláris toborzás következik be. A mitokondriális diszfunkció szintén előfordul, és gyakran társul csökkent mitokondriális transzmembrán potenciálgradiensekkel, amelyek szükségesek az oxidatív foszforiláció hajtásához. A végeredmény a végszervek nyilvánvaló képtelensége az oxigén maximális kinyerésére.
Folytatódik a vita arról, hogy az energia-anyagcsere kudarca a hibernációhoz hasonló adaptív citoprotektív mechanizmus-e, vagy tükrözi-e az elsődleges mitokondriális patológiát. Ezek az aktív kutatások területei, de jelenleg nem jelentik egyértelmű klinikai gyakorlati irányelveket. A fokozott kapilláris endoteliális permeabilitás széles körű fehérjében gazdag szöveti ödéma kialakulásához vezet.
A szeptikus sokkot és a SIRS-t reverzibilis miokardiális depresszió jellemzi, amely ellenállónak bizonyulhat a katekolamin és a folyadék beadása ellen. A keringő “miokardiális depresszív faktor” – amely valószínűleg a TNF-α, IL-1β, más citokinek és NO szinergetikus hatásait reprezentálja – szerepet játszik a patogenezisben. Ennek az akut stressznek a miokardiális depressziója két jellemzője: károsodott adrenerg válaszkészség és diasztolés diszfunkció, amely relatív katekolamin-rezisztencia és kicsi, nem tágult szív. A makrovaszkuláris szívizom ischaemia és a hipoperfúzió valószínűleg nem járul hozzá.
Súlyos szepszisben és szeptikus sokkban a mikrocirkulációs diszfunkció és a mitokondriális depresszió regionális szöveti distresszt okoz, és a regionális dysoxia ezért továbbra is fennáll. Ezt az állapotot mikrocirkulációs és mitokondriális distressz szindrómának (MMDS) nevezik. A szepszis által kiváltott gyulladásos autoregulációs diszfunkció továbbra is fennáll, és az oxigénigény nem felel meg az ellátásnak, ami MODS-hez vezet.
Az intravaszkuláris folyadék térfogatának újraeloszlása a csökkent artériás vaszkuláris tónus, a vénás visszatérés csökkenésének eredményeként a szívizom depresszánsainak felszabadulása és felszabadulása hipotenziót okoz.
Tüdőműködési zavar
A pulmonalis érrendszer endotheliális károsodása zavart eredményez kapilláris véráramlás és fokozott mikrovaszkuláris permeabilitás, ami interstitialis és alveoláris ödémát eredményez. A pulmonalis mikrocirkulációban a neutrofilek befogása elindítja és felerősíti az alveoláris kapilláris membránok sérülését. Az akut tüdőkárosodás és az akut légzési distressz szindróma (ARDS) gyakran ezeknek a hatásoknak a megnyilvánulása. Valójában a szepszis és a tüdőgyulladás az ARDS leggyakoribb oka.
Gasztrointesztinális diszfunkció
A gyomor-bél traktus (GI) elősegíti a szepszis sérülésének terjedését. A felső emésztőrendszerben lévő baktériumok túlszaporodása szívható be a tüdőbe, nosocomiális vagy aspirációs tüdőgyulladást okozva. Ez befolyásolhatja a bél normál gátfunkcióját, lehetővé téve a baktériumok, az endotoxinok és a normál emésztőrendszeri proteázok szisztémás keringésbe történő áthelyezését és kiterjesztve a szeptikus választ.
A szeptikus sokk paralitikus ileus, amely késleltethet az enterális táplálás intézményében. Úgy gondolják, hogy a felesleges NO-termelés okozza a szepszis által kiváltott ileust. A tápanyag-bevitel optimális szintjét zavarják a magas fehérje- és kalóriaigény esetén. A kábítószerek és az izomrelaxánsok tovább ronthatják a gyomor-bél traktus motilitását.
Májműködési zavar
A máj szerepének következményeként a gazdaszervezet védekezésében a májműködési zavarok által okozott kóros szintetikus funkciók hozzájárulhatnak mind a szepszis megindulásához, mind a progressziójához. A máj retikuloendoteliális rendszere a baktériumok és termékeik megtisztításának első védelmi vonalaként működik; a májműködési zavar ezen termékek szisztémás keringésbe való átterjedéséhez vezet.
A májelégtelenség (“sokkolt máj”) a májenzimek és a bilirubin szintjének emelkedésével, koagulációs rendellenességekkel és a toxinok, például az ammónia kiválasztásának elmulasztása, amelyek súlyosbodó encephalopathiához vezetnek.
Veseműködési zavar
Akut vesekárosodás (AKI) gyakran kísérik a szepszist. Az AKI különböző etiológiájáról számoltak be, és az okot általában többtényezősnek tartják. Az AKI mechanizmusa összetett, de valószínűleg a szisztémás hipotenzió, a közvetlen vese érszűkület, a citokinek felszabadulása következtében csökken a hatékony intravaszkuláris térfogat, valamint a neutrofilek endotoxinok és más peptidek általi aktiválása, amelyek hozzájárulnak a vesekárosodáshoz. A legtöbb állatkísérlet mégis azt mutatja, hogy a vese véráramlása megnövekedett, nem csökkent, a szepszisben, bár károsodott tubuláris funkcióval és a tu szignifikáns szövettani bizonyítékának hiányával jár. bularis sérülés.
Központi idegrendszeri diszfunkció
A központi idegrendszer (CNS) részvétele a szepszisben encephalopathiát és perifériás reakciót eredményez neuropátia. A patogenezis rosszul meghatározott, de valószínűleg összefügg a szisztémás hipotenzióval, ami agyi hipoperfúzióhoz vezethet.
Coagulopathia
Szubklinikai koagulopathia, amelyet a thrombin idő enyhe emelkedése (TT) vagy aktivált parciális thromboplastin idő (aPTT) jelez, vagy a a vérlemezkeszám rendkívül gyakori; azonban nyilvánvalóan disszeminált intravaszkuláris koaguláció (DIC) is kialakulhat. A proteáz-aktivált receptorok (PAR-ok), különösen a PAR 1, alkotják a koaguláció és a gyulladás közötti molekuláris kapcsolatot; A PAR1 citoprotektív hatásokat fejt ki, ha aktivált C-fehérje vagy alacsony dózisú trombin stimulálja őket, de nagy dózisú trombinnal aktiválva romboló hatást gyakorol az endothelsejt-gát funkciójára.
A szerv diszfunkciójának és sérülésének mechanizmusai
A szepszisben a sejtsérülés és az ebből eredő szervi diszfunkció pontos mechanizmusai nem teljesen ismertek. A MODS kiterjedt endothel- és parenchymasejt-sérüléssel jár, amelyek közül néhány a következő 4 javasolt mechanizmussal magyarázható.
Hypoxiás hipoxia
A szeptikus keringési elváltozás megzavarja a szövetek oxigénellátását, megváltoztatja a szövetek oxigénszállításának metabolikus szabályozását, és hozzájárul a szervek diszfunkciójához. A mikrovaszkuláris és endoteliális rendellenességek hozzájárulnak a szepszis szeptikus mikrocirkulációs hibájához. A reaktív oxigénfajok, a lítikus enzimek és a vazoaktív anyagok (pl. NO és az endoteliális növekedési faktorok) mikrocirkulációs sérüléshez vezetnek, amelyet az eritrociták képtelenek eligazítani a szeptikus mikrocirkulációban.
Közvetlen citotoxicitás
Az endotoxin, a TNF-α és az NO károsíthatja a mitokondriális elektrontranszportot, ami rendezetlen energia-anyagcseréhez vezet. Ezt citopátiás vagy hisztotoxikus anoxiának hívják, amely képtelen oxigént felhasználni akkor is, ha jelen van.
Apoptózis
Apoptózis ( programozott sejthalál) az a fő mechanizmus, amellyel a diszfunkcionális sejteket normálisan eliminálják. A gyulladáscsökkentő citokinek késleltethetik az apoptózist az aktivált makrofágokban és a neutrofilekben, de más szövetek (pl. Bélhám) gyorsított apoptózison eshetnek át. Ezért az apoptózis elvesztése kritikus szerepet játszik a szepszis szöveti sérülésében.
Immunszuppresszió
A proinflammatorikus és a gyulladáscsökkentő mediátorok egyensúlyhiányhoz vezethetnek közöttük. Gyulladásos reakció vagy immunhiány lehet túlsúlyban, vagy mindkettő jelen lehet.
Gazdaválasz és az eredményt befolyásoló egyéb tényezők
A súlyossághoz kapcsolódó klinikai jellemzők A szepszis szekvenciája magában foglalja a gazdaszervezet reakcióját a fertőzésre, a fertőzés helyét és típusát, az antimikrobiális terápia időzítését és típusát, a megsértő szervezetet, a sokk kialakulását, az alapbetegséget, a beteg hosszú távú egészségi állapotát és a sikertelen betegek számát. szervek. A szepszishez és a szeptikus sokkhoz vezető tényezők nem feltétlenül szükségesek a végső kimenetel meghatározásában.
A szepszisre adott gazdaszervezet válaszait mind gyulladásos, mind gyulladáscsökkentő immunszuppresszív válaszok jellemzik. Ezeknek a reakcióknak az irányát, mértékét és időtartamát mind a gazda tényezők (pl. Genetikai jellemzők, életkor, együttélő betegségek, gyógyszerek), mind a kórokozó tényezők (pl. Mikrobiális terhelés, virulencia) határozzák meg.
A gyulladásos válaszokat a kórokozók által expresszált kórokozókkal összefüggő molekuláris minták és a sejtfelszínen gazdasejtek által expresszált mintázatfelismerő receptorok (toll-szerű receptorok és C-típusú kölcsönhatások) kölcsönhatással indítják. lektin receptorok), az endoszómában (TLR) vagy a citoplazmában (retinsavval indukálható 1-es gén-szerű receptorok és nukleotid-kötő oligomerizációs domén-szerű receptorok).
A túlzott gyulladás következménye a szöveti szövetkárosodás és a nekrotikus sejtpusztulás, amelynek következtében károsodáshoz kapcsolódó molekuláris minták, úgynevezett veszélyességi molekulák szabadulnak fel, amelyek legalább a gyulladást örökítik meg. részben a kórokozók által kiváltott ugyanazon mintafelismerő receptorokra hatva.