US Pharm. 2013; 38 (11) (Onkológiai kiegészítés): 3-6.
Összegzés: A vérszegénység a rákos betegek körében gyakori szövődmény. Ennek oka lehet maga a daganat vagy az alkalmazott techemoterápiás rend. A feltétel súlyossága és prevalenciája számos tényezőtől függ. A kezelés célja a vér oxigénszállító képességének növelése, a fáradtság csökkentése és a beteg általános életminőségének javítása. Az eritropoézist serkentő szereket, a vaspótlást és a vörösvérsejt-transzfúziókat mind különböző körülmények között ajánlották. Míg ezek egyes betegeknél hasznosnak bizonyultak, az optimális terápiás modalitást még meg kell állapítani.
A vérszegénység a daganatos betegek morbiditásának egyik fő oka, rossz fizikai teljesítőképességgel, prognózissal és terápiás eredménnyel összefüggésben. WHO) szerint az anaemia hemoglobin (Hb) szintként < 12 g / dL nem terhes nőknél és < 13 g / dL ≥15 éves férfiaknál.2
Epidemiológia
A vérszegénység az egyik leggyakoribb megnyilvánulás a rákos betegeknél. Valójában kimutatták, hogy az összes daganatos betegek 30-90% -a vérszegény, ez az arány a rák típusától és az alkalmazott anaemia definíciójától függ. 3 Az anaemia előfordulása és súlyossága számos tényezőtől függ, amelyek az 1.4.5. TÁBLÁZAT

Etiológia h2 A daganatos betegek vérszegénységének fő oka kettős: maga a rák és a rák kezelésére alkalmazott terápia. A csontvelőbe beszivárgó rákos sejtek közvetlenül elnyomhatják a vérképzést és vérszegénységet okozhatnak. Továbbá a rákos sejtek felszabadítják a citokineket, amelyek vasmegkötéshez vezethetnek, csökkentve a vörösvértestek (RBC) termelését. A daganatok krónikus vérveszteséget okozhatnak a daganat helyéről, ami a rák és az orgán károsodás progresszív vérszegénységéhez vezethet. 6
Ezt a problémát súlyosbítják a vérveszteségek, táplálkozási hiányosságok, hemolízis, endokrin rendellenességek, örökletes betegség, veseelégtelenség vagy a rákos megbetegedésekkel és a krónikus betegségekkel járó gyulladásos citokinek jelenléte.4,6 A rákos betegek hajlamosak étvágyuk elvesztésére, ami táplálkozási hiányosságokhoz vezet. Gasztrointesztinális (GI) daganatokban szenvedő betegeknél a tápanyagok felszívódása is hiányosságokat okoz. A hemolízis immunmediált antitestekből vagy a koagulációs képesség megváltozásából származik. Ennek eredményeként az anaemia gyakori betegség a közelmúltban rákos megbetegedésben. A nőgyógyászati daganattal diagnosztizált betegek majdnem felének, és a nem Hodgkin-limfómában diagnosztizált betegek egyharmadának vérszegénysége van a diagnózis felállításakor. Ezenkívül a mieloszuppresszió a kemoterápia egyik mellékhatása és az anaemia jelentős hozzájáruló tényezője. . Különösen a csontváz sugárterápiája okoz hematológiai toxicitást és ennélfogva vérszegénységet. 6
Tünetek
A vérszegénység leggyakoribb tünetei a fáradtság, a dyspneaupon megterhelése, a szívdobogás, a depresszió, a szívelégtelenség, a kognitív képesség károsodása. funkció, szédülés és szívelégtelenség. 7,8
Diagnózis
A daganatos betegek vérszegénységének mértékét szuboptimális diagnosztikai intézkedések, a standard definíció hiánya és a az a tény, hogy az ok gyakran több tényezőből áll. 6,9 Részletes előzményeket kell felvenni a tünetek időtartamáról és a megjelenésükig eltelt időről, a társbetegségek jelenlétéről, a család előzményeiről, valamint a daganatellenes gyógyszerek és a sugárzás előzményeiről. Aphysical vizsgálatot kell végezni a szinkopé, a nehézlégzés, a fejfájás, a vertigo, a mellkasi fájdalom, a fáradtság, a kóros menstruáció a nőknél és a bántalmazás érdekében. egy Hb < 11 g / dl vagy a Hb-szám 2 g / dL-es csökkenése. Ez hasznos annak eldöntésében, hogy a citopéniák jelen vannak-e. Szintén ajánlott a perifériás vér kenetének vizuális áttekintése a vörösvérsejtek méretének, alakjának és színének megerősítésére. 6
Kórélettan
A vérszegénység a csökkent keringő eritrociták kombinációjának eredménye. , csökkent csomagolt sejttérfogat és csökkent Hb-szint. 6 Ez különböző patofiziológiai mechanizmusok révén következhet be, beleértve a túlzott vérveszteséget, a vörösvérsejtek fokozottabb pusztulását és a csökkent eritropoézist.
Eritropoietin (EPO), B12-vitamin, folsav és a vas elengedhetetlen az eritropoézis szempontjából. Az eritropoietin ebben a folyamatban szabályozza az eritroid sejtek szaturációját, differenciálódását és túlélését. 10 Az EPO-t elsősorban a vesék termelik, és a csontvelőbe szállítják.11
A kóros vasanyagcsere vagy a vas visszatartása a makrofágokban csökkenti a az eritropoézisben rendelkezésre álló vas.A vas megváltozott anyagcseréjét elsősorban a hepcidin okozza, amely fehérje csökkenti a vas intesztinális felszívódását, valamint a makrofágok által a vas felszabadulását. A hepcidin termelését fokozzák a daganatokból felszabaduló citokinek, ezáltal csökken a keringő vas mennyisége. Azt is kiderült, hogy a citokinek, például az interleukin (IL) -6 termelését bizonyos kemoterápiás kezelések fokozzák.5 A kemoterápia ismételt ciklusai kumulatív módon ronthatják az eritropoézis csökkenését. 7
Amint az oxigén leadása csökken, a test szövetsejtjei hipoxiássá válnak, ami egy sor fiziológiai reakciót eredményez, mivel a test megpróbálja megszerezni vagy fenntartani a szövetek oxigénellátását.
Úgy gondolják, hogy a vasinduktív betegek normális felhasználását megszakíthatja a tumorsejtek közötti kölcsönhatás. és a gazda saját immunrendszere. Ez a kölcsönhatás specifikus gyulladásos citokinek, például az IL-1, a gammainterferon és a tumor nekrózis faktor alfa (TNF-α) fel-szabályozásához vezet, amely csökkentette az eritroid prekurzorok differenciálódását a csontvelőben, megzavarja a normál vasfelhasználást és gátolja a normál hipoxiát hajtott eritropoietin termelés. A nefrotoxikus kemoterápiás szerek súlyosbíthatják a problémát a vesekárosodás okozásával. Ez addig fokozza a vérszegénységet, hogy az erythropoies nem képes kompenzálni az RBC alacsonyabb túlélését. 12
A rákos vérszegénység kockázati tényezői
A rákos vérszegénység esetében a következő kockázati tényezőket azonosították9:
- Myelosupresszív kemoterápia vagy sugárterápia
- Alacsony Hb-szint (10-12 g / dL) a citotoxikus kemoterápia megkezdésekor
- platina- sémákat tartalmaz, ami szintén növeli a transzfúzió támogatásának szükségességét.
Kezelés
A páciens életminőségének általános javulása mellett a vérszegénység kezelése számos ember számára elengedhetetlen. okozza. A vérszegénység veszélyezteti a megfelelő mennyiségű oxigén szállítását az összes sejtbe, beleértve a daganatos sejteket is. 7 Mivel az alacsony szöveti oxigenizáció a daganatok csökkent sugárzási érzékenységével és a kemoterápia egyéb formáival jár, ezeknek a kezeléseknek a hatékonysága csökken a vérszegénységben.
A terápia célja az oxigén-carryin növelése kell legyen A vér kapacitása és a kiváltó ok kezelése. Az olyan alapállapotok, mint a táplálkozási hiányok, könnyebben kezelhetők, mint mások, például az okkult vérveszteség. Különböző lehetőségek állnak rendelkezésre a vérszegénységben szenvedő rákos betegek kezelésére. Ezek közé tartozik15:
- Megfelelő kiegészítő terápia folsavval és / vagy B12-vitaminnal a táplálkozási hiányosságok orvoslására
- Eritropoezist stimuláló szerek (ESA)
- Vaspótlás
- Vérátömlesztés, amely akut súlyos vérveszteségben szenvedő betegek számára javallt. Krónikus vérszegénységben szenvedő betegek esetében az eritropoetikus szereket részesítik előnyben. hagyományosan a vérszegénység kezelését fejlesztette ki krónikus veseelégtelenségben szenvedő betegeknél. Hasonló hatékonyságot és korlátozottságot mutattak, ha vérszegénységben szenvedő rákos betegeknél összehasonlíthatatlan dózisokat alkalmaztak. 5 ESA-t olyan betegek kezelésére javasolják, akiknek az endogén EPO szintje normálisan alacsony, mivel az ESA hatásmódja, valamint immunológiai és hematológiai hatásai hasonlóak az endogén EPO-hoz. Az rHuEPO-n végzett vizsgálatok azt mutatták, hogy javítja a betegek H-szintjét és életminőségét, és csökkenti a transzfúziós szükségleteket. amelyet az American Cancer Societ végzett, megmutatta, hogy a kemoterápia által kiváltott vérszegénység eritropoetikus kezelésének optimális klinikai előnye korai beavatkozással érhető el.18Az ESA-k egyértelműen előnyösek; az ESAtherapy alkalmazása előtt azonban meg kell vizsgálni és kijavítani az anaemia minden egyéb okát. Az Amerikai Hematológiai Társaság (ASH) és az Amerikai Klinikai Onkológiai Társaság (ASCO) azt javasolja, hogy a kezelést akkor kezdjék meg, amikor a Hb szint 10 g / d alá csökken. A dózist csökkenteni kell, ha a Hblevelekben minimálisan 1 g / dL 2-rel nő. héten belül.19 A terápia célja a Hb-t a legkisebb koncentrációra kell felforgatni a transzfúzió elkerülése érdekében. Ha a Hb 1–2 g / dl-es növekedése nem érhető el 6–8 hetes kezelés után, az ESA-kezelést abba kell hagyni.18 Noha az aktuális adatok alapján nehéz megjósolni a betegek válaszát ezekre a terápiákra, kimutatták, hogy a betegek kb. 50-60% -a 2 g / dl Hb-növekedést mutat, ha rHuEPO-val kezelik. 9 Az ESA-terápiát a kezelés befejezése után fel kell függeszteni. a kemoterápiás tanfolyam.20,21
Az alfa darbepoetin ajánlott adagja 2,25 mcg / kg heti szubkután (SC) injekcióként. Ha a Hb szint 6 hét után nem emelkedik legalább 1 g / dl-re, az adagot 4,5 mcg / kg-ra kell növelni. Ha a Hb szint 2 hetes időszak alatt 1 g / dl-nél nagyobb mértékben emelkedik, vagy ha a Hb meghaladja a 12 g / dl-t, a darbepoetin adagját 40% -kal kell csökkenteni. 20 Darbepoetin-kezelést abba kell hagyni, ha a Hb-szint 13 g / dl fölé emelkedik. 9
Az rHuEPO ajánlott adagja 40 000 E heti egyszeri SC vagy 150 E / kg SC adagolása hetente háromszor azoknál a betegeknél, akiknek Hb-szintje 10 g / dl alatt van. Az rHuEPO adagját 25% -kal kell csökkenteni, ha a Hb szint bármely 2 hetes periódusban > 1 g / dl-t emelkedik, vagy eléri a vörösvértest transzfúziójának elkerüléséhez szükséges szintet. 21
Az ESA-k olyan injekciós üvegbe vannak csomagolva, amelyet nem szabad megrázni, mert denaturálódnak. 20,21 Az injekciós üveg tartalmát nem szabad hígítani vagy összegyűjteni.
Az ESA-kezelés kockázatát szintén fel kell mérni. figyelembe venni. Úgy gondolják, hogy az ESA-k növelik a káros kardiovaszkuláris eseményeket, fokozzák a vénás tromboembólia kockázatát, lerövidítik a tumor progresszióját és különböző mechanizmusok révén csökkentik a vérszegénységben szenvedő rákos betegek túlélését. 22,23 kemoterápiával vagy sugárterápiával végzett kezelés.24 Az összes ESA-t blackbox figyelmezteti a halál, a szívinfarktus, agyvérzés, a vénás tromboembólia, az érrendszeri hozzáférés trombózisa, valamint a tumor progressziója és kiújulása kockázatának növelésére. 20,21 az FDA tanácsot ad a betegeknek, gondozóknak és egészségügyi szakembereknek az ESA-k biztonságos használatáról.25
Vaspótlás: A vaspótlást, lehetőleg parenterálisan, alacsony pakkritinszintű betegeknél javasolják (< 30 ng / ml), transzferrin telítettség (TSAT < 15%) és alacsony (< 26 pg / sejt ) retikulocita Hb conten t (CHr). Az anaemiás rákos betegeknél kétféle irondeficienciát ismertek fel:
- Abszolút vashiány (AID), amely krónikus vérzéssel fordul elő például GI vagy nőgyógyászati elváltozások, műtétből származó vérveszteség, táplálkozási hiányosságok és a krónikus betegség vérszegénysége (ACD). Meghatározása a szérum ferritinszintje: < 30 mcg / L, és a csökkent TSAT < 15% .1
- Funkcionális vashiány (FID), amely az eritropoietin folyamatos használata után jelentkezik. Ez az ESA-kezelésre adott nem megfelelő válasz leggyakoribb oka, különösen veseelégtelenségben szenvedő betegeknél. Ezért a legtöbb ESA-terápiában részesülő betegnek végül vaspótlásra lesz szüksége. megvizsgálták a vas- és az ESA-terápiát, és megállapították a vas szerepét a funkcionális vashiányban.1 Míg a jelenlegi bizonyítékok alátámasztják az intravénás vaspótlás alkalmazását a hemoglobin-válasz javítására daganatos vérszegénységben szenvedő betegeknél, prospektív vizsgálatokra van szükség a IV-vas hosszú távú hatékonyságáról és biztonságosságáról . Ezenkívül meg kell határozni az optimális adagolási rendet. 5
A vas beadható orálisan vagy kis molekulatömegű (LMW) vas-dextrán, ferri-glükonát és vas-szacharóz parenterális készítményeként. A parenterálisan beadott vasnak magasabb a válasza, mint az orális vashoz. Tesztadagok ajánlottak a vas-dextránhoz. Tesztadagot kell beadni azoknak a betegeknek is, akik korábban érzékenyek voltak a vas-dextrán vagy más IV-es vas-készítmények iránt, vagy akiknek többféle gyógyszerallergiája van. A 2. TÁBLÁZAT mutatja az IV-es vaspótlás adagolási rendjét. 6
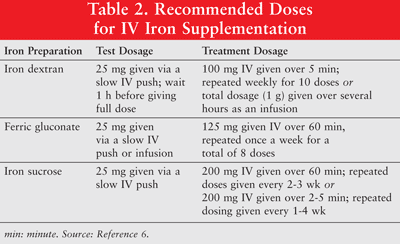
A parenterális vas hipotenzióval, hányingerrel, hányással és / vagy hasmenéssel, fájdalommal, magas vérnyomással, nehézlégzéssel, viszketéssel, fejfájással és szédüléssel jár. Ezenkívül kellemetlen adagolás és költséges is lehet.9 Mivel a nagy molekulatömegű (HMW) vas-dextrán az LMW vas-dextránhoz képest nagyobb gyakorisággal fordul elő káros mellékhatásokkal, utóbbit általában előnyben részesítjük. 6
Piros Vérsejttranszfúzió: A vörösvérsejtek a transzfúzió célzott vérkészítményei a vérszegénység kijavítására vérzés utáni akut vérszegénység esetén. Egyes betegeknél infúzióra lehet szükség, amely negatív citomegalovírusra vezethető vissza.A vörösvérsejt-transzfúzió alkalmazásának célja a vér oxigénszállító képességének hiányának kezelése vagy megelőzése, és a transzfúziót általában nem jelzik, ha a beteg Hblevelje ≥10 g / dl.6
A vörösvérsejt-transzfúziók a Hb és a hematokrit szintjének gyors emelkedésének előnye közvetlenül az infúzió után. Becslések szerint 300 ml (1 egység) tiszta vörösvértest transzfúziója 1 g / dl Hb vagy a hematokrit 3% -os átlagos növekedését eredményezi egy másik normális felnőttnél, aki nem tapasztal egyidejű vérvesztést. Ez a fáradtság általános gyors javulását eredményezi. 6
A páciens vérének keresztbe kell vetni az ABO-kompatibilitást, mielőtt a vörösvértesteket transzfúzióba lehetne helyezni. Ha a betegnek ismételt infúzióra van szüksége, a mellékhatások kockázata minimalizálható a leukocita-csökkentő vér alkalmazásával és az anantihisztinnel vagy acetaminofennel végzett premedikációval. szerek, transzfúziós reakciók, alloimmunizáció és immunszuppresszió. 9 A transzfúzió egyéb kockázatai közé tartoznak a pangásos szívelégtelenség, a fokozott trombotikus események és a vas túlterhelése. tapasztalja a vas túlterhelését. 6
Jövőbeni perspektívák
A rákos betegek vérszegénységének kezelésére új stratégiákat folytatnak. Bár az emberi vér nem helyettesíthető, a kutatók olyan termékeket fejlesztenek ki, amelyek rendelkeznek a vörösvértestek oxigénszállító képességével. A folyamatban Hb-alapú oxigénhordozók és perfluor-szénhidrogének vannak.5
Következtetés
Összességében elmondható, hogy a vérszegénységnek, mint az onkológiában fontos kérdésnek az optimális megközelítését még meg kell határozni. Az egészségügyi szolgáltatók közötti következetesség hiánya, a rákos vérszegénység világos meghatározása és a diagnosztikai kritériumok mind hozzájárulnak ehhez a problémához.
1. Steinmetz HT. Az intravénás vas szerepe a daganatos betegek vérszegénységének kezelésében. Ther Adv Hematol. 2012; 3: 177-191.
2. deBenoist B, McLean E, Egli I és mtsai. A vérszegénység világszerte elterjedtsége 1993–2005: a WHO vérszegénységről szóló globális adatbázisa. Genf, Svájc: Egészségügyi Világszervezet; 2008.
3. Knight K, Wade S, Balducci L. A vérszegénység előfordulása és eredményei rákban: az irodalom szisztematikus áttekintése. Am J Med. 2004; 116 (7A. Kiegészítés): 11S-26S.
4. Schwartz RN. Vérszegénység rákos betegeknél: előfordulási gyakoriság, okok, hatás, kezelés és kezelési irányelvek és protokollok használata. Am J Health Syst Pharm. 2007; 64 (3 kiegészítő 2): S5-S13; vetélkedő S28-S30.
5. Calabrich A, Katz A. Anaemia kezelése rákos betegeknél. Jövőbeli Oncol. 2011; 7: 507-517.
6. Rodgers GM, Becker P, Blinder M és mtsai. Rák és kemoterápia által kiváltott vérszegénység. J Natl Com Canc Canc. 2012; 10: 628-653.
7. Groopman JE, Itri LM. Kemoterápia okozta vérszegénység felnőtteknél: előfordulás és kezelés. J Natl Cancer Inst. 1999; 91: 1616-1634.
8. Ludwig H, Strasser K. Az anaemia tünettana. Semin Oncol. 2001; 28: 7–14.
9. Gillespie TW. Vérszegénység a rákban. Rákápolás. 2003; 26: 119-128.
10. Koeller JM. Klinikai irányelvek a rákkal kapcsolatos vérszegénység kezelésére. Farmakoterápia. 1998; 18: 156-169.
11. Cazzola M, Mercuriali F, Brugnara C. Rekombináns humán eritropoietin alkalmazása az urémia hátterében. Vér. 1997; 89: 424-867.
12. Nowrousian MR, Kasper C, Oberhoff C és mtsai. A rákkal kapcsolatos vérszegénység kórélettana. In: Smith JF, Boogaerts MA, Ehmer B, szerk. Az eritropoietin a rák támogató kezelésében. New York, NY: Marcel Dekker; 1997: 13-34.
13. Vaupel P, Dunst J, Engert A és mtsai. A rekombináns humán eritropoietin (rHuEPO) hatása a tumor szabályozására rák által kiváltott vérszegénységben szenvedő betegeknél. Onkologie. 2005; 28: 216-221.
14. Zhao KL, Liu G, Jiang GL és mtsai. A haemoglobin-szint összefüggése a lokálisan előrehaladott oesophagealis carcinomában szenvedő betegek morbiditásával és mortalitásával, akik sugárkezelést kapnak – három egymást követő klinikai III. Fázisú vizsgálat szekunder elemzése. Clin Oncol (R Coll Radiol). 2006; 18: 621-627.
15. Glaspy JA. Az eritropoetikus szerek fejlődése az onkológiában. Szakértői vélemény a sürgősségi gyógyszerekről. 2005; 10: 553-567.
16. Adamson JW, Spivak JL. A rekombináns humán eritropoietin farmakológiai alkalmazásának fiziológiai alapjai sebészeti és rákkezelésben. Sebészet. 1994; 115: 7-15.
17. Ferrario E, Ferrari L, Bidoli P és mtsai. A rákkal kapcsolatos anaemia kezelése alfa-epoetinnel: áttekintés. Cancer Treat Rev. 2004; 30: 563-575.
18. Lyman GH, Glaspy J. Vannak-e klinikai előnyei a korai eritropoetikus beavatkozásnak a kemoterápia által kiváltott vérszegénységben? Aszisztematikus felülvizsgálat. Rák. 2006; 106: 223-233.
19. Rizzo JD, Brouwers M, Hurley P és mtsai. AmericanSociety of Clinical Oncology / American Society of Hematology Clinical Practice útmutató frissítés az epoetin és darbepoetin rákos felnőtt betegeknél történő alkalmazásáról. J Clin Oncol. 2010; 28: 4996-5010.
20. Aranesp (alfa darbepoetin) felírási információk.Thousand Oaks, Kalifornia: Amgen Inc.; 2012. május 21.
21. Procrit (alfa-epoetin) felírási információ. Horsham, PA: Janssen Products, LP; 2012. július.
22. Beutel G, Ganser A. Az eritropoézist stimuláló szerek kockázatai és előnyei a rák kezelésében. Semin Hematol. 2007; 44: 157-165.
23. Fenner MH, Ganser A. Eritropoietin a rákkal kapcsolatos vérszegénységben. Curr Opin Oncol. 2008; 20: 685-689.
24. Smith RE Jr, Aapro MS, Ludwig H és mtsai. Darbepoetinalfa vérszegénység kezelésére aktív daganatos betegeknél, kemoterápiát vagy sugárterápiát nem kapott: III. Fázisú, multicentrikus, randomizált, kettős-vak, placebo-kontrollos vizsgálat eredményei. J Clin Oncol. 2008; 26: 1040-1050.
25. ESA APPRISE Onkológiai Program. Amgen and Janssen Products, LP. www.esa-apprise.com. Hozzáférés: 2013. október 13.