US Pharm. 2013; 38 (11) (Oncology suppl): 3-6.
ABSTRACT: L’anemia è una complicanza comune nei pazienti con cancro. Può essere causato dal tumore stesso o dal regime terapeutico utilizzato. La gravità e la prevalenza della condizione varia in base a una serie di fattori. Il trattamento ha lo scopo di aumentare la capacità di trasporto dell’ossigeno del sangue, ridurre l’affaticamento e migliorare la qualità generale della vita del paziente. Agenti stimolanti l’eritropoiesi, integrazione di ferro e trasfusioni di globuli rossi sono stati tutti raccomandati in diversi contesti. Anche se si sono dimostrati utili in alcuni pazienti, la modalità terapeutica ottimale deve ancora essere stabilita.
L’anemia è una delle principali cause di morbilità nei pazienti con cancro, collegata a prestazioni fisiche, prognosi ed esiti terapeutici scadenti.1 Secondo l’Organizzazione mondiale della sanità ( OMS), l’anemia è definita come un livello di emoglobina (Hb) di < 12 g / dL nelle donne non gravide e < 13 g / dL negli uomini di età ≥15 anni.2
Epidemiologia
L’anemia è una delle manifestazioni più frequenti nei pazienti con cancro. Infatti, è stato dimostrato che dal 30% al 90% di tutti i malati di cancro sono anemici, una cifra che dipende dal tipo di cancro e dalla definizione di anemia utilizzata.3 L’incidenza e la gravità dell’anemia dipendono da una serie di fattori, elencati nella TABELLA 1.4,5

Eziologia
La principale causa di anemia nei malati di cancro è duplice: il cancro stesso e la terapia utilizzata per la gestione del cancro.Le cellule cancerose che si infiltrano nel midollo osseo possono sopprimere direttamente l’emopoiesi e causare anemia. Inoltre, le cellule tumorali rilasciano citochine che possono portare al sequestro del ferro, riducendo la produzione di globuli rossi (RBC). I tumori possono provocare una perdita di sangue cronica dal sito del tumore, portando ad anemia progressiva dal cancro e danni all’organo.6
Questo problema è aggravato da perdite di sangue, carenze nutrizionali, emolisi, disturbi endocrini, malattie ereditarie, insufficienza renale o la presenza di citochine infiammatorie associate a cancro e malattie croniche.4,6 I malati di cancro tendono a perdere l’appetito, portando a carenze nutrizionali. Nei pazienti con tumori gastrointestinali (GI), anche il malassorbimento dei nutrienti porta a carenze. L’emolisi deriva da anticorpi immuno-mediati o da cambiamenti nella capacità di coagulazione. Di conseguenza, l’anemia è una comorbilità comune nei pazienti a cui è stato recentemente diagnosticato un cancro. Quasi la metà dei pazienti con diagnosi di cancro ginecologico e un terzo dei pazienti con diagnosi di linfoma non Hodgkin, ha anemia alla diagnosi.
Inoltre, la mielosoppressione è uno degli effetti collaterali della chemioterapia e un fattore che contribuisce in modo significativo all’anemia. . La radioterapia allo scheletro in particolare causa anche tossicità ematologica e quindi anemia.6
Sintomi
I sintomi più comuni dell’anemia sono affaticamento, dispnea da sforzo, palpitazioni, depressione, insufficienza cardiaca, compromissione cognitiva. funzione, vertigini e insufficienza cardiaca.7,8
Diagnosi
L’entità del problema dell’anemia nei pazienti oncologici è amplificata da misure diagnostiche non ottimali, dalla mancanza di una definizione standard e dalla fatto che la causa è spesso multifattoriale.6,9 Deve essere presa una storia dettagliata che registri la durata e il tempo all’insorgenza dei sintomi, la presenza di condizioni di comorbidità, la storia familiare e la storia di esposizione a farmaci antineoplastici e radiazioni. Deve essere condotto un esame fisico per verificare sincope, dispnea da esercizio, mal di testa, vertigini, dolore toracico, affaticamento, mestruazioni anomale nelle donne e pallore.6
Il National Cancer Comprehensive Network raccomanda di eseguire aCBC per i pazienti con una Hb < 11 g / dL o una riduzione della conta di Hb di 2 g / dL. Ciò è utile per determinare se sono presenti citopenie. Si raccomanda inoltre una revisione visiva dello striscio di sangue periferico per confermare le dimensioni, la forma e il colore dei globuli rossi.6
Fisiopatologia
L’anemia è il risultato di una combinazione di una diminuzione degli eritrociti circolanti , volume di cellule impaccate ridotto e livelli di Hb ridotti.6 Ciò può verificarsi attraverso vari meccanismi fisiopatologici tra cui perdita eccessiva di sangue, aumento della distruzione dei globuli rossi e diminuzione dell’eritropoiesi.
Eritropoietina (EPO), vitamina B12, acido folico e il ferro è essenziale per l’eritropoiesi. L’eritropoietina controlla la maturazione, la differenziazione e la sopravvivenza delle cellule eritroidi durante questo processo.10 L’EPO è prodotta principalmente dai reni e trasportata al midollo osseo.11
Il metabolismo anormale del ferro o la ritenzione di ferro nei macrofagi riduce la quantità di ferro disponibile per l’eritropoiesi.Il metabolismo alterato del ferro è causato principalmente dall’epcidina, una proteina che riduce l’assorbimento del ferro nell’intestino così come il rilascio di ferro da parte dei macrofagi. La produzione di epcidina è aumentata dalle citochine rilasciate dai tumori, riducendo così la quantità di ferro circolante. È stato anche dimostrato che la produzione di citochine come l’interleuchina (IL) -6 è aumentata da alcuni regimi chemioterapici.5 Cicli ripetuti di chemioterapia possono peggiorare la riduzione dell’eritropoiesi cumulativamente.7
Poiché l’apporto di ossigeno è diminuito, le cellule dei tessuti del corpo diventano ipossiche, determinando una serie di risposte fisiologiche mentre il corpo cerca di ottenere o mantenere l’ossigenazione dei tessuti.
Si ritiene che il normale utilizzo dei pazienti con cancro del ferro possa essere interrotto da un’interazione tra le cellule tumorali e il sistema immunitario dell’ospite. Questa interazione porta alla sovraregolazione di citochine infiammatorie specifiche come IL-1, gammainterferone e fattore di necrosi tumorale alfa (TNF-α), che diminuisce la differenziazione dei precursori eritroidi nel midollo osseo, interferisce con il normale utilizzo del ferro e inibisce la normale ipossia. produzione di tropoietina. Gli agenti chemioterapici nefrotossici possono peggiorare il problema causando insufficienza renale.
Nell’anemia cronica, è stato dimostrato che i tumori rilasciano il fattore che induce l’ananemia, una molecola che riduce la durata della vita degli eritrociti. Ciò esacerba l’anemia al punto che l’eritropoia non può compensare la sopravvivenza inferiore dei globuli rossi.12
Fattori di rischio per l’anemia nel cancro
I seguenti fattori di rischio sono stati identificati per l’anemia nel cancro9:
- Chemioterapia mielosoppressiva o radioterapia
- Bassi livelli di emoglobina (10-12 g / dL) all’inizio della chemioterapia citotossica
- Somministrazione di platino- contenente regimi, che aumenta anche la necessità di supporto trasfusionale.
Trattamento
Oltre a un miglioramento generale della qualità di vita del paziente, il trattamento dell’anemia è essenziale per molti L’anemia compromette la fornitura di quantità sufficienti di ossigeno a tutte le cellule, comprese le cellule tumorali.7 Poiché una bassa ossigenazione dei tessuti è associata a una ridotta sensibilità dei tumori alle radiazioni e ad altre forme di chemioterapia, l’efficacia di questi trattamenti è ridotta nell’anemia.13,14
L’obiettivo della terapia dovrebbe essere quello di aumentare il trasporto di ossigeno g capacità del sangue e trattare la causa sottostante. Le condizioni sottostanti come le carenze nutrizionali sono più facili da trattare rispetto ad altre, come la perdita di sangue occulto. Sono disponibili varie opzioni per la gestione dei malati di cancro con anemia. Questi includono15:
- Terapia supplementare appropriata con acido folico e / o vitamina B12 per correggere le carenze nutrizionali
- Agenti stimolatori dell’eritropoiesi (ESA)
- Integrazione di ferro
- Trasfusioni di sangue, indicate per i pazienti con grave perdita di sangue acuta. Per i pazienti con anemia cronica, sono preferiti gli agenti eritropoietici.
Agenti stimolatori dell’eritropoiesi: gli ESA, inclusa l’eritropoietina alfa umana ricombinante (rHuEPO; Procrit, Epogen) e darbepoetina alfa (Aranesp), erano tradizionalmente sviluppato per la gestione dell’anemia in pazienti con insufficienza renale cronica. Hanno dimostrato un’efficacia e limitazioni simili quando sono usate dosi incomparabili in pazienti oncologici con anemia.5 Gli ESA sono indicati per la gestione di pazienti i cui livelli endogeni di EPO sono anormalmente bassi, poiché la modalità d’azione dell’ESA e gli effetti immunologici ed ematologici sono simili a quelli dell’EPO endogeno.9 Studi condotti su rHuEPO hanno dimostrato che migliora gli Hblevel dei pazienti e la qualità della vita e diminuisce i requisiti trasfusionali.15,16 È stato proposto che gli ESA migliorino anche la funzione cognitiva dei pazienti sottoposti a chemioterapia.17
Una revisione sistemica condotto dall’American Cancer Society ha dimostrato che il beneficio clinico ottimale dal trattamento eritropoietico dell’anemia indotta dalla chemioterapia può essere ottenuto attraverso un intervento precoce.18 C’è chiaramente un vantaggio nell’usare gli ESA; tuttavia, tutte le altre cause di anemia devono essere investigate e corrette prima dell’uso di ESAtherapy.
Darbepoetin e rHuEPO sono entrambi indicati per il trattamento dell’anemia in pazienti con tumori maligni non mieloidi in cui la malattia è correlata alla chemioterapia.5 L’American Society ofHematology (ASH) e l’American Society of Clinical Oncology (ASCO) raccomandano di iniziare il trattamento quando i livelli di Hb scendono al di sotto di 10 g / dL e di ridurre il dosaggio se c’è un aumento minimo di 1 g / dL di Hblevels di 2 settimane.19 Lo scopo della terapia dovrebbe essere quello di portare l’Hb alla concentrazione più bassa per evitare trasfusioni. Se l’aumento minimo da 1 a 2 g / dL di Hb non viene raggiunto dopo 6-8 settimane di trattamento, la terapia con ESA deve essere interrotta.18 Sebbene sia difficile prevedere la risposta del paziente a queste terapie con i dati attuali, è stato dimostrato che circa dal 50% al 60% dei pazienti mostra un aumento di 2 g / dL di Hb quando trattata con rHuEPO.9 La terapia ESA deve essere interrotta al completamento del il corso di chemioterapia.20,21
Il dosaggio raccomandato di darbepoetina alfa è di 2,25 mcg / kg come iniezione sottocutanea (SC) settimanale. Se i livelli di emoglobina non aumentano di almeno 1 g / dL dopo 6 settimane, il dosaggio deve essere aumentato a 4,5 mcg / kg. Se i livelli di emoglobina aumentano di oltre 1 g / dl in un periodo di 2 settimane o se l’emoglobina supera i 12 g / dl, il dosaggio di darbepoetina deve essere ridotto del 40% .20 Darbepoetina deve essere interrotta se i livelli di emoglobina aumentano oltre i 13 g / dl. 9
Il dosaggio raccomandato di rHuEPO è di 40.000 USC somministrate una volta alla settimana o 150 U / kg somministrate SC tre volte alla settimana nei pazienti i cui livelli di Hb sono inferiori a 10 g / dL. Il dosaggio di rHuEPO deve essere ridotto del 25% se il livello di emoglobina aumenta di > 1 g / dL in un periodo di 2 settimane o raggiunge un livello necessario per evitare la trasfusione di globuli rossi.21
Gli ESA sono confezionati in una fiala che non deve essere agitata, poiché si denaturerà.20,21 Il contenuto della fiala non deve essere diluito o riunito.
Anche i rischi della terapia ESA dovrebbero essere preso in considerazione. Si ritiene che gli ESA aumentino gli eventi cardiovascolari avversi, aumentino il rischio di tromboembolia venosa, abbrevino il tempo alla progressione del tumore e riducano la sopravvivenza nei pazienti affetti da cancro anemico attraverso diversi meccanismi.22,23 Per questo motivo, l’uso di ESAsis è sconsigliato nei pazienti oncologici che non sono in fase di trattamento con chemioterapia o radioterapia.24 Tutti gli ESA sono dotati di una scatola nera di avvertimento sull’aumento del rischio di morte, infarto del miocardio, ictus, tromboembolia venosa, trombosi dell’accesso vascolare e tumorprogressione e recidiva.20,21 Il Programma ESA APPRISE Oncologia è stato istituito da la FDA per consigliare i pazienti, gli operatori sanitari e gli operatori sanitari sull’uso sicuro degli ESA.25
Supplemento di ferro: l’integrazione di ferro, preferibilmente per via parenterale, è indicata nei pazienti con bassi livelli di offerritina (< 30 ng / mL), saturazione della transferrina (TSAT < 15%) e bassa (< 26 pg / cell ) reticolociti Hb conten t (CHr). Due tipi di insufficienza sono stati riconosciuti nei pazienti affetti da cancro anemico:
- Carenza di ferro assoluta (AID) che si verifica con sanguinamento cronico dovuto, ad esempio, lesioni gastrointestinali o ginecologiche, perdita di sangue da intervento chirurgico, carenze e anemia da malattia cronica (ACD). È definito come un livello di ferritina sierica di < 30 mcg / L e una diminuzione del TSAT di < 15% .1
- Carenza di ferro funzionale (FID) che insorge dopo un uso continuato di eritropoietina. È la causa più comune di una risposta inadeguata alla terapia con ESA, in particolare nei pazienti con insufficienza renale. Pertanto, la maggior parte dei pazienti in terapia con ESA alla fine richiederà un’integrazione di ferro.6
La supplementazione di ferro è stata introdotta quando la sola terapia con ESA ha dimostrato scarsi tassi di risposta nei pazienti trattati con chemioterapia.1 L’efficacia di una combinazione di IV La terapia con ferro ed ESA è stata testata ed è stato stabilito il ruolo del ferro nella carenza funzionale di ferro.1 Sebbene le prove attuali supportino l’uso della supplementazione di ferro EV per migliorare la risposta dell’emoglobina nei pazienti anemici con cancro, sono necessari studi prospettici sull’efficacia e la sicurezza a lungo termine del ferro EV Inoltre, è necessario stabilire regimi di dosaggio ottimali.5
Il ferro può essere somministrato per via orale o come formulazioni parenterali di destrano, ferricgluconato e ferro saccarosio a basso peso molecolare (LMW). Il ferro somministrato per via parenterale ha una risposta superiore rispetto al ferro per via orale.6 Quest’ultimo è quindi usato raramente nei pazienti oncologici con anemia e non è discusso in questo articolo. Le dosi di prova sono raccomandate per il destrano di ferro. Anche i pazienti che hanno mostrato sensibilità precedenti al destrano di ferro o ad altre preparazioni di ferro EV o a coloro che hanno allergie a più farmaci dovrebbero ricevere una dose di prova. La TABELLA 2 mostra il regime di dosaggio per l’integrazione di ferro EV.6
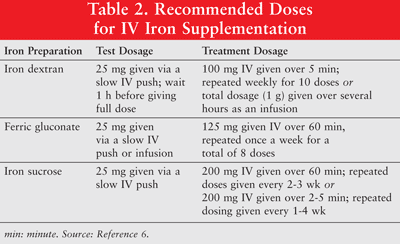
Il ferro per via parenterale è associato a ipotensione, nausea, vomito e / o diarrea, dolore, ipertensione, dispnea, prurito, mal di testa e vertigini. Inoltre, può essere scomodo da somministrare e costoso.9 Poiché il destrano ferroso ad alto peso molecolare (HMW) è associato a una maggiore incidenza di eventi avversi rispetto al destrano ferroso LMW, quest’ultimo è preferibile in generale.6
Rosso Trasfusione di cellule del sangue: i globuli rossi sono il prodotto sanguigno preferito per le trasfusioni per correggere l’anemia nei casi di anemia acuta dopo emorragia. Alcuni pazienti possono richiedere un’infusione negativa per il citomegalovirus.Lo scopo dell’utilizzo di una trasfusione di GR per trattare o prevenire una carenza nella capacità di trasporto dell’ossigeno del sangue e la trasfusione non è solitamente indicata se l’Hblevel del paziente è ≥10 g / dL.6
Offerta trasfusionale di RBC il vantaggio di un rapido aumento dei livelli di Hb e di ematocrito immediatamente dopo l’infusione. Si stima che una trasfusione di 300 mL (1 unità) di globuli rossi puri comporterà un aumento medio di 1 g / dL di Hb o del 3% di ematocrito in un adulto normale che non soffre di perdita di sangue simultanea. Ciò porta a un rapido miglioramento generale della fatica.6
Il sangue del paziente deve essere incrociato per la compatibilità ABO prima che i globuli rossi possano essere trasfusi. Se il paziente necessita di ripetute infusioni, il rischio di reazioni avverse può essere ridotto al minimo mediante l’uso di sangue che riduce i leucociti e la premedicazione con anantistaminico o paracetamolo.6
La trasfusione di globuli rossi non è priva di rischi, incluso il potenziale di infettive trasfusionali agenti, reazioni trasfusionali, alloimmunizzazione e immunosoppressione.9 Altri rischi di trasfusione includono insufficienza cardiaca congestizia, aumento degli eventi trombotici e sovraccarico di ferro.6 È utile notare, tuttavia, che è altamente improbabile che i pazienti che necessitano di infusioni di globuli rossi durante il periodo corrispondente al solo trattamento chemioterapico esperienza di sovraccarico di ferro.6
Prospettive future
Sono attualmente perseguite nuove strategie per la gestione dell’anemia nei pazienti oncologici. Sebbene non vi sia alcun sostituto per il sangue umano, i ricercatori stanno sviluppando prodotti che hanno la capacità di trasporto dell’ossigeno dei globuli rossi. Nella pipeline sono portatori di ossigeno a base di Hb e perfluorocarburi.5
Conclusione
Tutto sommato, l’approccio ottimale all’anemia come questione importante in oncologia deve ancora essere stabilito. La mancanza di coerenza tra gli operatori sanitari, una chiara definizione di anemia nel cancro e criteri diagnostici contribuiscono tutti a questo problema.
1. Steinmetz HT. Il ruolo del ferro per via endovenosa nel trattamento dell’anemia nei malati di cancro. Ther Adv Hematol. 2012; 3: 177-191.
2. deBenoist B, McLean E, Egli I, et al. Prevalenza mondiale dell’anemia 1993-2005: Database globale dell’OMS sull’anemia. Ginevra, Svizzera: Organizzazione mondiale della sanità; 2008.
3. Knight K, Wade S, Balducci L. Prevalenza e risultati dell’anemia nel cancro: una revisione sistematica della letteratura. Am J Med. 2004; 116 (suppl 7A): 11S-26S.
4. Schwartz RN. Anemia in pazienti con cancro: incidenza, cause, impatto, gestione e utilizzo di linee guida e protocolli di trattamento. Am J Health Syst Pharm. 2007; 64 (3 suppl 2): S5-S13; quiz S28-S30.
5. Calabrich A, Katz A. Gestione dell’anemia nei malati di cancro. Future Oncol. 2011; 7: 507-517.
6. Rodgers GM, Becker P, Blinder M, et al. Anemia indotta da cancro e chemioterapia. J Natl Compr Canc Netw. 2012; 10: 628-653.
7. Groopman JE, Itri LM. Anemia indotta da chemioterapia negli adulti: incidenza e trattamento. J Natl Cancer Inst. 1999; 91: 1616-1634.
8. Ludwig H, Strasser K. Symptomatology of anemia. Semin Oncol. 2001; 28: 7-14.
9. Gillespie TW. Anemia nel cancro. Infermieristica contro il cancro. 2003; 26: 119-128.
10. Koeller JM. Linee guida cliniche per il trattamento dell’anemia correlata al cancro. Farmacoterapia. 1998; 18: 156-169.
11. Cazzola M, Mercuriali F, Brugnara C. Uso dell’eritropoietina umana ricombinante al di fuori del contesto dell’uremia. Sangue. 1997; 89: 424-867.
12. Nowrousian MR, Kasper C, Oberhoff C, et al. Patofisiologia dell’anemia correlata al cancro. In: Smith JF, Boogaerts MA, Ehmer B, eds. Eritropoietina nel trattamento di supporto al cancro. New York, NY: Marcel Dekker; 1997: 13-34.
13. Vaupel P, Dunst J, Engert A, et al. Effetti dell’eritropoietina umana ricombinante (rHuEPO) sul controllo del tumore in pazienti con anemia indotta da cancro. Onkologie. 2005; 28: 216-221.
14. Zhao KL, Liu G, Jiang GL, et al. Associazione del livello di emoglobina con morbilità e mortalità dei pazienti con carcinoma esofageo localmente avanzato sottoposti a radioterapia: un’analisi secondaria di tre studi clinici di fase III consecutivi. Clin Oncol (R Coll Radiol). 2006; 18: 621-627.
15. Glaspy JA. Lo sviluppo di agenti eritropoietici in oncologia. Expert Opin Emerg Drugs. 2005; 10: 553-567.
16. Adamson JW, Spivak JL. Basi fisiologiche per l’uso farmacologico dell’eritropoietina umana ricombinante nella chirurgia e nel trattamento del cancro. Chirurgia. 1994; 115: 7-15.
17. Ferrario E, Ferrari L, Bidoli P, et al. Trattamento dell’anemia correlata al cancro con epoetina alfa: una revisione. Cancer Treat Rev.2004; 30: 563-575.
18. Lyman GH, Glaspy J. Ci sono benefici clinici con un intervento eritropoietico precoce per l’anemia indotta dalla chemioterapia? Revisione asistematica. Cancro. 2006; 106: 223-233.
19. Rizzo JD, Brouwers M, Hurley P, et al. Aggiornamento delle linee guida di pratica clinica dell’American Society of Clinical Oncology / American Society of Hematology sull’uso di epoetina e darbepoetina in pazienti adulti con cancro. J Clin Oncol. 2010; 28: 4996-5010.
20. Informazioni sulla prescrizione di Aranesp (darbepoetina alfa).Thousand Oaks, CA: Amgen Inc; Maggio 2012.
21. Informazioni sulla prescrizione di Procrit (epoetina alfa). Horsham, PA: Janssen Products, LP; Luglio 2012.
22. Beutel G, Ganser A. Rischi e benefici degli agenti stimolanti l’eritropoiesi nella gestione del cancro. Semin Hematol. 2007; 44: 157-165.
23. Fenner MH, Ganser A. Eritropoietina nell’anemia correlata al cancro. Curr Opin Oncol. 2008; 20: 685-689.
24. Smith RE Jr, Aapro MS, Ludwig H, et al. Darbepoetinalfa per il trattamento dell’anemia in pazienti con tumore attivo che non ricevono chemioterapia o radioterapia: risultati di uno studio di fase III, multicentrico, randomizzato, in doppio cieco, controllato con placebo. J Clin Oncol. 2008; 26: 1040-1050.
25. Programma di oncologia ESA APPRISE. Prodotti Amgen e Janssen, LP. www.esa-apprise.com. Accesso 13 ottobre 2013.