Abbassamento della pressione del vapore
Come descritto nel capitolo su liquidi e solidi, la tensione di vapore di equilibrio di un liquido è la pressione esercitata dal suo gas fase in cui la vaporizzazione e la condensazione si verificano alla stessa velocità:
\ text {liquid} \ rightleftharpoons \ text {gas}
Dissoluzione di una sostanza non volatile in un liquido volatile si traduce in un abbassamento della tensione di vapore del liquido. Questo fenomeno può essere razionalizzato considerando l’effetto delle molecole di soluto aggiunte sui processi di vaporizzazione e condensazione del liquido. Per vaporizzare, le molecole di solvente devono essere presenti sulla superficie della soluzione. La presenza di soluto diminuisce l’area superficiale disponibile per le molecole di solvente e quindi riduce la velocità di vaporizzazione del solvente. Poiché la velocità di condensazione non è influenzata dalla presenza di soluto, il risultato netto è che l’equilibrio di vaporizzazione-condensazione si ottiene con meno molecole di solvente nella fase vapore (cioè a una pressione di vapore inferiore) (Figura 1). Sebbene questa interpretazione cinetica sia utile, non tiene conto di diversi aspetti importanti della natura colligativa dell’abbassamento della pressione del vapore. Una spiegazione più rigorosa coinvolge la proprietà dell’entropia, un argomento di discussione in un successivo capitolo di testo sulla termodinamica. Ai fini della comprensione dell’abbassamento della tensione di vapore di un liquido, è opportuno notare che la maggiore entropia di una soluzione rispetto al suo solvente e soluto separati serve a stabilizzare efficacemente le molecole di solvente e ostacolare la loro vaporizzazione. Ne risulta una pressione di vapore inferiore e un punto di ebollizione corrispondentemente più alto come descritto nella sezione successiva di questo modulo.
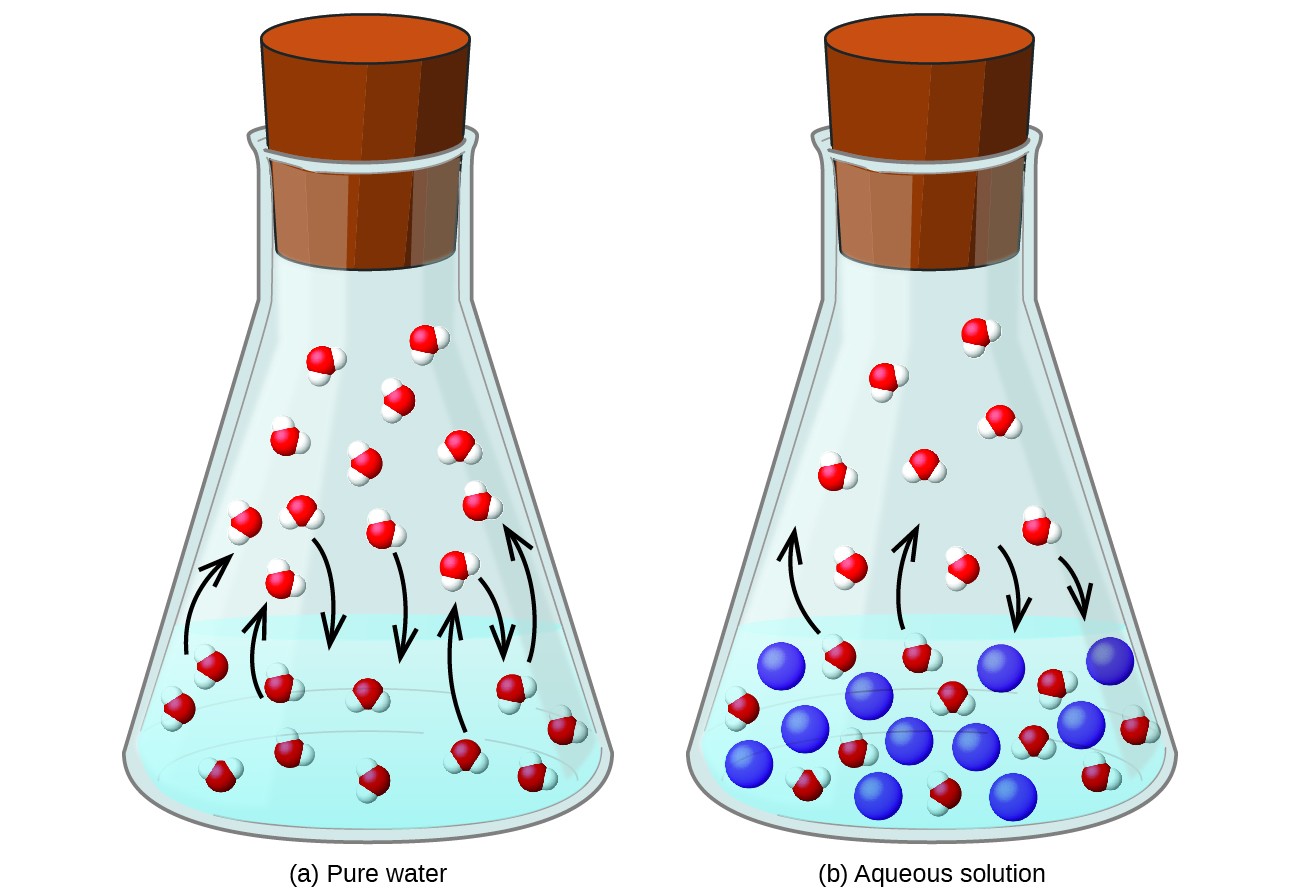
Figura 1. La presenza di soluti non volatili abbassa la tensione di vapore di una soluzione impedendo l’evaporazione delle molecole di solvente.
La relazione tra le pressioni di vapore dei componenti della soluzione e le concentrazioni di questi componenti sono descritti dalla legge di Raoult: la pressione parziale esercitata da qualsiasi componente di una soluzione ideale è uguale alla tensione di vapore del componente puro moltiplicata per la sua frazione molare nella soluzione.
{P} _ {\ text {A}} = {X} _ {\ text {A}} {P} _ {\ text {A}} ^ {\ star}
Ricordando che la pressione totale di una miscela gassosa è uguale alla somma delle pressioni parziali per tutti i suoi componenti (legge di Dalton delle pressioni parziali), la tensione di vapore totale esercitata da una soluzione contenente i componenti è
{ P} _ {\ text {soluzione}} = \ sum _ {i} {P} _ {i} = \ sum _ {i} {X} _ {i} {P} _ {i} ^ {\ star}
Una sostanza non volatile è una la cui tensione di vapore è trascurabile (P ^ {\ star} ≈ 0), e quindi la tensione di vapore sopra una soluzione contenente solo soluti non volatili è dovuta solo al solvente:
{P} _ {\ text {solution}} = {X} _ {\ text {solvent}} {P} _ {\ text {solvent}} ^ {\ star}
Distillazione di soluzioni
La distillazione è una tecnica per separare i componenti di miscele che trova ampia applicazione sia in laboratorio che in ambienti industriali. Viene utilizzato per raffinare il petrolio, isolare i prodotti di fermentazione e purificare l’acqua. Questa tecnica di separazione prevede il riscaldamento controllato di una miscela campione per vaporizzare, condensare e raccogliere selettivamente uno o più componenti di interesse. Un tipico apparecchio per distillazioni su scala di laboratorio è mostrato nella Figura 2.

Figura 2. Un tipico l’unità di distillazione del laboratorio è mostrata in (a) una fotografia e (b) un diagramma schematico dei componenti. (credito a: modifica del lavoro di “Rifleman82” / Wikimedia commons; credito b: modifica del lavoro di “Slashme” / Wikipedia)
Le raffinerie di petrolio utilizzano la distillazione frazionata su larga scala per separare componenti del petrolio greggio. Il petrolio greggio viene riscaldato ad alte temperature alla base di un’alta colonna di frazionamento, vaporizzando molti dei componenti che salgono all’interno della colonna. Quando i componenti vaporizzati raggiungono zone adeguatamente fredde durante la loro risalita, si condensano e vengono raccolti. I liquidi raccolti sono miscele più semplici di idrocarburi e altri composti del petrolio di composizione appropriata per varie applicazioni (ad es. Gasolio, cherosene, benzina), come illustrato nella Figura 3.

Figura 3. Il petrolio greggio è una miscela complessa che viene separata mediante distillazione frazionata su larga scala per isolare varie miscele più semplici.
Elevazione del punto di ebollizione
Come descritto nel capitolo su liquidi e solidi, il punto di ebollizione di un liquido è la temperatura alla quale la sua tensione di vapore è uguale alla pressione atmosferica ambiente.Poiché la tensione di vapore di una soluzione si abbassa a causa della presenza di soluti non volatili, è ovvio che il punto di ebollizione della soluzione verrà successivamente aumentato. Rispetto al solvente puro, una soluzione, quindi, richiederà una temperatura più elevata per ottenere una determinata pressione di vapore, inclusa una equivalente a quella dell’atmosfera circostante. L’aumento del punto di ebollizione osservato quando il soluto non volatile viene sciolto in un solvente, ΔTb, è chiamato elevazione del punto di ebollizione ed è direttamente proporzionale alla concentrazione molale delle specie di soluto:
\ Delta {T} _ {\ text {b}} = {K} _ {\ text {b}} m
dove Kb è la costante di elevazione del punto di ebollizione, o la costante ebullioscopica ed m è la concentrazione molale (molalità) di tutte le specie di soluti.
Le costanti di elevazione del punto di ebollizione sono proprietà caratteristiche che dipendono dall’identità del solvente. I valori di Kb per diversi solventi sono elencati nella Tabella 1.
La misura in cui la tensione di vapore di un solvente viene abbassata e il punto di ebollizione è elevato dipende dal numero totale di particelle di soluto presenti in una data quantità di solvente, non sulla massa o dimensione o identità chimiche delle particelle. Una soluzione acquosa di 1 m di saccarosio (342 g / mol) e una soluzione acquosa di 1 m di glicole etilenico (62 g / mol) mostrerà lo stesso punto di ebollizione perché ogni soluzione ha una mole di particelle di soluto (molecole) per chilogrammo di solvente .
Esempio 6: il punto di ebollizione di una soluzione di iodio
Trova il punto di ebollizione di una soluzione di 92,1 g di iodio, I2, in 800,0 g di cloroformio, CHCl3 , supponendo che lo iodio non sia volatile e che la soluzione sia ideale.
Controlla il tuo apprendimento
Qual è il punto di ebollizione di una soluzione di 1,0 g di glicerina, C3H5 (OH) 3, in 47,8 g di acqua? Supponi una soluzione ideale.
Punto di congelamento della depressione

Figura 4. Salgemma ( NaCl), cloruro di calcio (CaCl2) o una miscela dei due vengono utilizzati per sciogliere il ghiaccio. (credito: modifica del lavoro di Eddie Welker)
Le soluzioni si congelano a temperature inferiori rispetto ai liquidi puri. Questo fenomeno è sfruttato negli schemi di “sbrinamento” che utilizzano sale (Figura 4), cloruro di calcio o urea per sciogliere il ghiaccio su strade e marciapiedi e nell’uso del glicole etilenico come “antigelo” nei radiatori delle automobili. L’acqua di mare gela a una temperatura inferiore a quella dell’acqua dolce, e così gli oceani Artico e Antartico rimangono scongelati anche a temperature inferiori a 0 ° C (così come i fluidi corporei dei pesci e di altri animali marini a sangue freddo che vivono in questi oceani).
La diminuzione del punto di congelamento di una soluzione diluita rispetto a quella del solvente puro, ΔTf, è chiamata depressione del punto di congelamento ed è direttamente proporzionale alla concentrazione molale del soluto
\ Delta {T} _ {\ text {f}} = {K} _ {\ text {f}} m
dove m è la concentrazione molale del soluto in il solvente e Kf è chiamato costante di depressione del punto di congelamento (o costante crioscopica). Proprio come per le costanti di elevazione del punto di ebollizione, queste sono proprietà caratteristiche i cui valori dipendono dall’identità chimica del solvente. I valori di Kf per diversi solventi sono elencati nella Tabella 1.
Proprietà colligative e antighiaccio
Il cloruro di sodio e i suoi analoghi del gruppo 2 calcio e magnesio cloruro sono spesso usati per scongelare strade e marciapiedi, poiché una soluzione di uno qualsiasi di questi sali avrà un punto di congelamento inferiore a 0 ° C, punto di congelamento dell’acqua pura. I sali metallici del gruppo 2 sono spesso miscelati con il cloruro di sodio (“salgemma”) più economico e più facilmente disponibile per l’uso sulle strade, poiché tendono ad essere un po ‘meno corrosivi del NaCl e forniscono una maggiore depressione del punto di congelamento , dal momento che si dissociano per produrre tre particelle per unità di formula, piuttosto che due particelle come il cloruro di sodio.
Poiché questi composti ionici tendono ad accelerare la corrosione del metallo, non sarebbero una scelta saggia da usare in antigelo per il radiatore della tua auto o per sbrinare un aereo prima del decollo.Per queste applicazioni vengono spesso utilizzati composti covalenti, come l’etilene o il glicole propilenico. I glicoli utilizzati nel fluido del radiatore non solo abbassano il punto di congelamento del liquido, ma ne elevano il punto di ebollizione, rendendo il fluido utile sia in inverno che in estate. I glicoli riscaldati vengono spesso spruzzati sulla superficie degli aeroplani prima del decollo in caso di maltempo in inverno per rimuovere il ghiaccio che si è già formato e prevenire la formazione di altro ghiaccio, che sarebbe particolarmente pericoloso se si formasse sulle superfici di controllo dell’aeromobile (Figura 5).

Figura 5. La depressione del punto di congelamento viene sfruttata per rimuovere il ghiaccio da (a) strade e (b) le superfici di controllo dell’aeromobile.
Diagramma di fase per una soluzione
Gli effetti colligativi su pressione di vapore, punto di ebollizione e punto di congelamento descritti nella sezione precedente sono convenientemente riassunti confrontando i diagrammi di fase per un liquido puro e una soluzione derivata da quel liquido. I diagrammi di fase per l’acqua e una soluzione acquosa sono mostrati nella Figura 6.
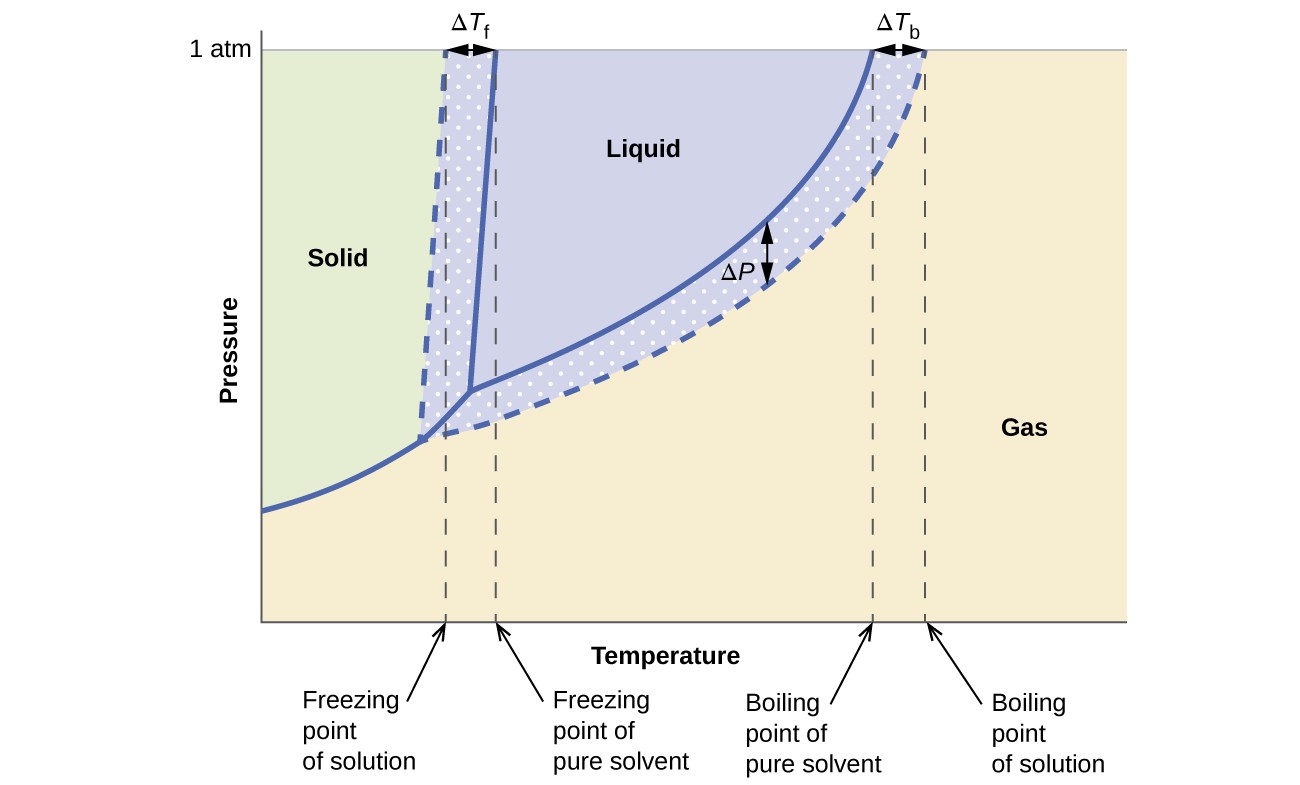
Figura 6. Queste fasi i diagrammi mostrano l’acqua (curve solide) e una soluzione acquosa di non elettrolita (curve tratteggiate).
La curva liquido-vapore per la soluzione si trova sotto la curva corrispondente per il solvente, raffigurante il vapore abbassamento della pressione, ΔP, che risulta dalla dissoluzione del soluto non volatile. Di conseguenza, a una data pressione, il punto di ebollizione della soluzione viene osservato a una temperatura superiore a quella del solvente puro, riflettendo l’elevazione del punto di ebollizione, ΔTb, associata alla presenza di soluto non volatile. La curva solido-liquido per la soluzione è spostata a sinistra di quella per il solvente puro, rappresentando la depressione del punto di congelamento, ΔTb, che accompagna la formazione della soluzione. Infine, si noti che le curve solido-gas per il solvente e la sua soluzione sono identiche. Questo è il caso di molte soluzioni comprendenti solventi liquidi e soluti non volatili. Proprio come per la vaporizzazione, quando una soluzione di questo tipo viene congelata, in realtà sono solo le molecole di solvente che subiscono la transizione da liquido a solido, formando un solvente solido puro che esclude le specie di soluto. Le fasi solida e gassosa, quindi, sono composte solo da solvente, quindi le transizioni tra queste fasi non sono soggette ad effetti colligativi.
Osmosi e pressione osmotica delle soluzioni
Un certo numero di naturali e i materiali sintetici mostrano una permeazione selettiva, il che significa che solo molecole o ioni di una certa dimensione, forma, polarità, carica e così via sono in grado di attraversare (permeare) il materiale. Le membrane cellulari biologiche forniscono eleganti esempi di permeazione selettiva in natura, mentre i tubi di dialisi utilizzati per rimuovere i rifiuti metabolici dal sangue sono un esempio tecnologico più semplicistico. Indipendentemente da come possono essere fabbricati, questi materiali sono generalmente indicati come membrane semipermeabili.
Si consideri l’apparato illustrato nella Figura 7, in cui i campioni di solvente puro e una soluzione sono separati da una membrana che solo solvente le molecole possono permeare. Le molecole di solvente si diffonderanno attraverso la membrana in entrambe le direzioni. Poiché la concentrazione del solvente è maggiore nel solvente puro rispetto alla soluzione, queste molecole si diffonderanno dal lato del solvente della membrana al lato della soluzione a una velocità maggiore di quanto non lo faranno nella direzione inversa. Il risultato è un trasferimento netto di molecole di solvente dal solvente puro alla soluzione. Il trasferimento guidato dalla diffusione di molecole di solvente attraverso una membrana semipermeabile è un processo noto come osmosi.
Figura 7. (a) Una soluzione e un solvente puro sono inizialmente separati da una membrana osmotica. (b) Il trasferimento netto delle molecole di solvente alla soluzione avviene fino a quando la sua pressione osmotica non produce velocità di trasferimento uguali in entrambe le direzioni.
Quando l’osmosi viene eseguita in un apparato come quello mostrato nella Figura 7 , il volume della soluzione aumenta man mano che si diluisce per accumulo di solvente. Ciò fa aumentare il livello della soluzione, aumentando la sua pressione idrostatica (a causa del peso della colonna di soluzione nel tubo) e determinando un trasferimento più rapido delle molecole di solvente sul lato del solvente puro. Quando la pressione raggiunge un valore che produce una velocità di trasferimento del solvente inversa uguale alla velocità di osmosi, il trasferimento di massa del solvente cessa. Questa pressione è chiamata pressione osmotica (Π) della soluzione. La pressione osmotica di una soluzione diluita è correlata alla sua molarità del soluto, M, e alla temperatura assoluta, T, secondo l’equazione
\ Pi = MRT
dove R è la costante universale dei gas.
Se una soluzione viene posta in un apparecchio come quello mostrato nella Figura 8, l’applicazione di una pressione maggiore della pressione osmotica della soluzione inverte l’osmosi e spinge le molecole di solvente dalla soluzione nel solvente puro. Questa tecnica di osmosi inversa viene utilizzata per la desalinizzazione su larga scala dell’acqua di mare e su scala più piccola per produrre acqua di rubinetto ad alta purezza da bere.
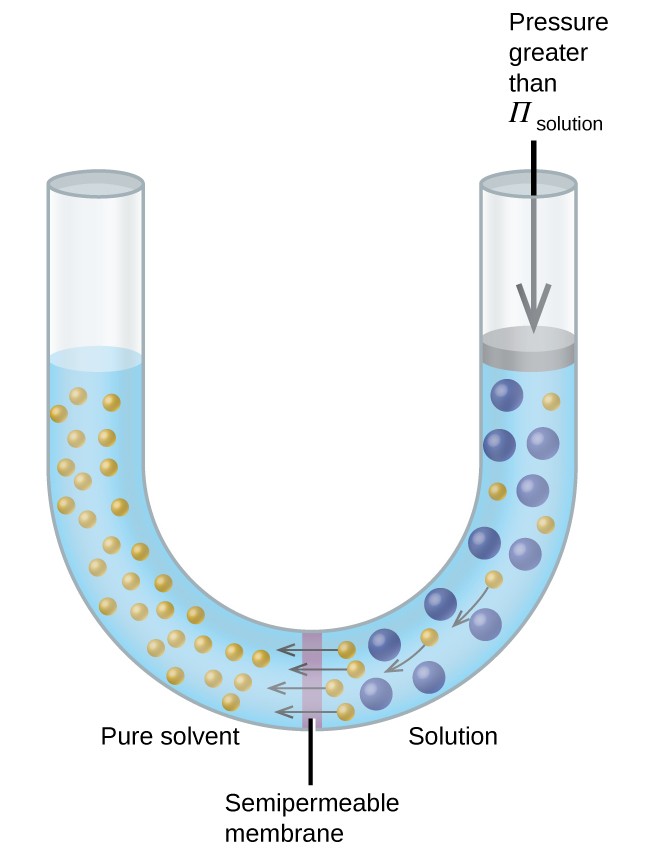
Figura 8. L’applicazione di una pressione maggiore della pressione osmotica di una soluzione provoca l’osmosi inversa. Le molecole di solvente dalla soluzione vengono spinte nel solvente puro.
Purificazione dell’acqua con osmosi inversa
Nel processo di osmosi, la diffusione serve a spostare l’acqua attraverso un membrana semipermeabile da una soluzione meno concentrata a una soluzione più concentrata. La pressione osmotica è la quantità di pressione che deve essere applicata alla soluzione più concentrata per fermare l’osmosi. Se viene applicata una pressione maggiore, l’acqua passerà dalla soluzione più concentrata a una soluzione meno concentrata (più pura). Questo si chiama osmosi inversa. L’osmosi inversa (RO) viene utilizzata per purificare l’acqua in molte applicazioni, dagli impianti di desalinizzazione nelle città costiere, alle macchine per la purificazione dell’acqua nei negozi di alimentari (Figura 9) e le unità domestiche a osmosi inversa più piccole. Con una pompa azionata a mano, piccole unità RO possono essere utilizzate nei paesi del terzo mondo, aree disastrate e in scialuppe di salvataggio. Le nostre forze militari dispongono di una varietà di unità RO azionate da generatore che possono essere trasportate in veicoli in località remote.

Figura 9. I sistemi ad osmosi inversa per la purificazione dell’acqua potabile sono mostrati qui su (a) piccola e (b) grande scala. (credito a: modifica del lavoro di Jerry Kirkhart; credito b: modifica del lavoro di Willard J. Lathrop)
Esempi di osmosi sono evidenti in molti sistemi biologici perché le cellule sono circondato da membrane semipermeabili. Le carote e il sedano che sono diventati molli perché hanno perso acqua possono essere resi croccanti mettendoli nuovamente in acqua. L’acqua entra nelle cellule della carota o del sedano per osmosi. Un cetriolo posto in una soluzione salina concentrata perde acqua per osmosi e assorbe un po ‘di sale per diventare un sottaceto. L’osmosi può anche influenzare le cellule animali. Le concentrazioni di soluto sono particolarmente importanti quando le soluzioni vengono iniettate nel corpo. I soluti nei fluidi cellulari del corpo e nel siero del sangue conferiscono a queste soluzioni una pressione osmotica di circa 7,7 atm. Le soluzioni iniettate nel corpo devono avere la stessa pressione osmotica del siero sanguigno; cioè, dovrebbero essere isotonici con il siero del sangue. Se una soluzione meno concentrata, una soluzione ipotonica, viene iniettata in quantità sufficiente per diluire il siero del sangue, l’acqua del siero diluito passa nelle cellule del sangue per osmosi, provocando l’espansione e la rottura delle cellule. Questo processo è chiamato emolisi. Quando viene iniettata una soluzione più concentrata, una soluzione ipertonica, le cellule perdono acqua nella soluzione più concentrata, avvizziscono ed eventualmente muoiono in un processo chiamato crenazione. Questi effetti sono illustrati nella Figura 10.
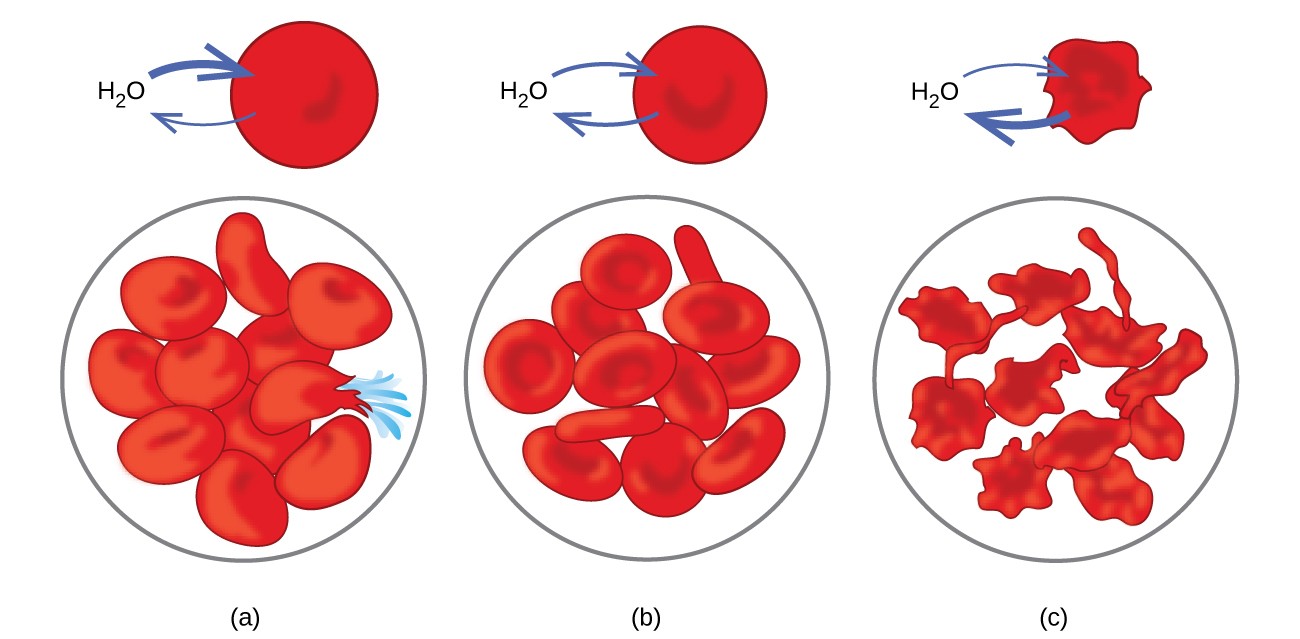
Figura 10. Le membrane dei globuli rossi sono permeabili all’acqua e (a) si gonfierà e forse si romperà in una soluzione ipotonica; b) mantenere volume e forma normali in una soluzione isotonica; e (c) avvizzire e possibilmente morire in una soluzione ipertonica. (credito a / b / c: modifiche del lavoro di “LadyofHats” / Wikimedia commons)
Determinazione delle masse molari
Pressione osmotica e variazioni del punto di congelamento, ebollizione punto e tensione di vapore sono direttamente proporzionali alla concentrazione di soluto presente. Di conseguenza, possiamo utilizzare una misurazione di una di queste proprietà per determinare la massa molare del soluto dalle misurazioni.
Proprietà colligative degli elettroliti
Come notato in precedenza in questo modulo, le proprietà colligative di una soluzione dipendono solo dal numero, non dall’identità, delle specie di soluti disciolte. I termini di concentrazione nelle equazioni per varie proprietà colligative (depressione del punto di congelamento , elevazione del punto di ebollizione, pressione osmotica) riguardano tutte le specie di soluti presenti nella soluzione. Per le soluzioni considerate finora in questo capitolo, i soluti sono stati non elettroliti che si dissolvono fisicamente senza dissociazione o qualsiasi altro processo di accompagnamento. le che si dissolve produce una molecola di soluto disciolta. La dissoluzione di un elettroita, tuttavia, non è così semplice, come illustrato dai due esempi comuni seguenti:
Considerando il primo di questi esempi e assumendo la dissociazione completa, una soluzione acquosa di 1,0 m di NaCl contiene 2,0 moli di ioni (1,0 mol Na + e 1.0 mol Cl−) per ogni chilogrammo di acqua e la depressione del punto di congelamento dovrebbe essere
Quando questa soluzione è effettivamente preparata e la sua depressione del punto di congelamento misurata, si ottiene comunque un valore di 3,4 ° C. Discrepanze simili si osservano per altri composti ionici e le differenze tra i valori delle proprietà colligative misurati e quelli attesi diventano tipicamente più significative all’aumentare delle concentrazioni di soluto. Queste osservazioni suggeriscono che gli ioni di cloruro di sodio (e altri elettroliti forti) non sono completamente dissociati in soluzione.
Per tenere conto di questo ed evitare gli errori che accompagnano l’ipotesi di dissociazione totale, un parametro misurato sperimentalmente denominato in viene utilizzato l’onore del chimico tedesco vincitore del Premio Nobel Jacobus Henricus van’t Hoff. Il fattore van’t Hoff (i) è definito come il rapporto tra le particelle di soluto in soluzione e il numero di unità formula disciolte:
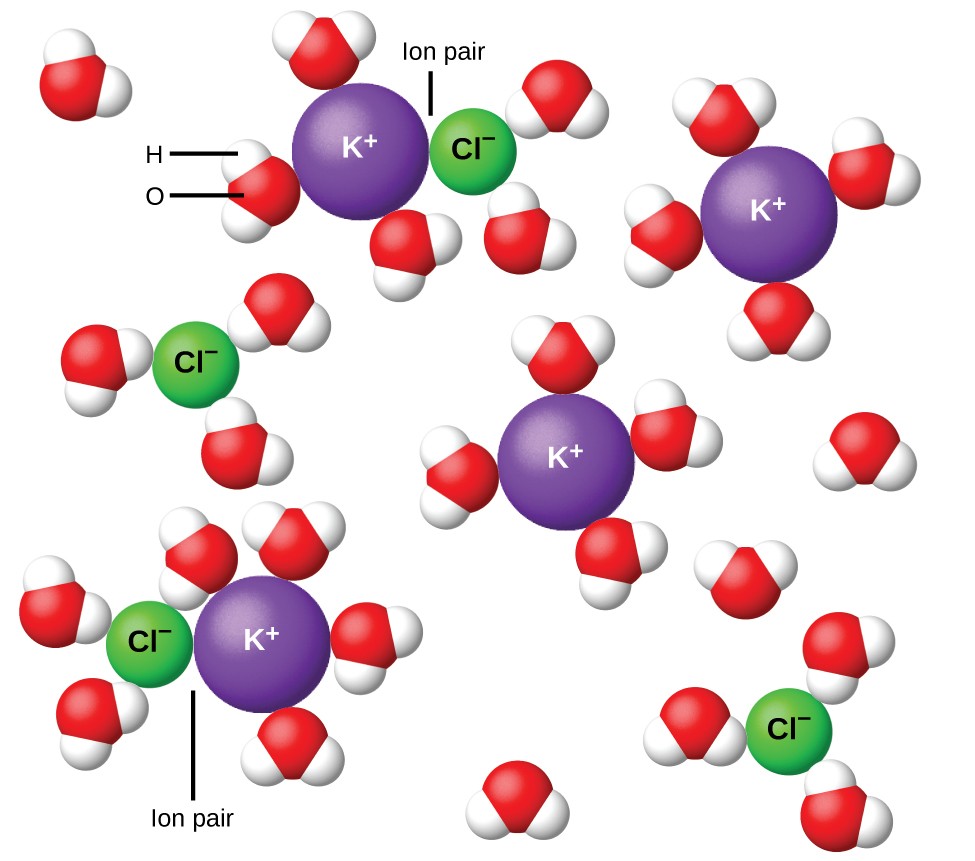
Figura 11. Gli ioni diventano sempre più separati quanto più diluita la soluzione, e le attrazioni interioniche residue si riducono.
Nel 1923, i chimici Peter Debye ed Erich Hückel proposero una teoria per spiegare l’apparente ionizzazione incompleta di elettroliti forti. Hanno suggerito che sebbene l’attrazione interionica in una soluzione acquosa sia notevolmente ridotta dalla solvatazione degli ioni e dall’azione isolante del solvente polare, non è completamente annullata. Le attrazioni residue impediscono agli ioni di comportarsi come particelle totalmente indipendenti (Figura 11). In alcuni casi, uno ione positivo e uno negativo possono effettivamente toccarsi, dando un’unità solvatata chiamata coppia di ioni. Pertanto, l’attività, o la concentrazione effettiva, di un particolare tipo di ione è inferiore a quella indicata dalla concentrazione effettiva. Gli ioni si separano sempre più ampiamente quanto più si diluisce la soluzione e le attrazioni interioniche residue diventano sempre meno. Pertanto, in soluzioni estremamente diluite, le concentrazioni effettive degli ioni (le loro attività) sono essenzialmente uguali alle concentrazioni effettive. Si noti che i fattori di van’t Hoff per gli elettroliti nella tabella 2 sono per soluzioni 0,05 m, alla cui concentrazione il valore di i per NaCl è 1,9, rispetto a un valore ideale di 2.
Esempio 11: punto di congelamento di una soluzione di un elettrolita
La concentrazione di ioni nell’acqua di mare è approssimativamente la stessa di quella di una soluzione contenente 4,2 g di NaCl disciolti in 125 g di acqua. Supponiamo che ciascuno degli ioni nella soluzione NaCl abbia lo stesso effetto sul punto di congelamento dell’acqua come una molecola non elettrolitica e determina la temperatura di congelamento della soluzione (che è approssimativamente uguale alla temperatura di congelamento dell’acqua di mare).
Controlla il tuo apprendimento
Supponi che ciascuno degli ioni nel cloruro di calcio, CaCl2, ha lo stesso effetto sul punto di congelamento dell’acqua di una molecola non elettrolitica. Calcola il punto di congelamento di una soluzione di 0,724 g di CaCl2 in 175 g di acqua.
Provalo
- La carne può essere classificata come fresca (non congelata) anche se è conservata a -1 ° C. Perché la carne non dovrebbe congelare a questa temperatura?
- Un composto organico ha una composizione di 93,46% C e 6,54% H in massa. Una soluzione di 0,090 g di questo composto in 1,10 g di canfora fonde a 158,4 ° C. Il punto di fusione della canfora pura è di 178,4 ° C. Kf per canfora è 37,7 ° C / m. Qual è la formula molecolare del soluto? Mostra i tuoi calcoli.
- Un sale è noto per essere un fluoruro di metallo alcalino. Una rapida determinazione approssimativa del punto di congelamento indica che 4 g di sale disciolti in 100 g di acqua producono una soluzione che congela a circa -1,4 ° C. Qual è la formula del sale? Mostra i tuoi calcoli.
Glossario
attività: concentrazione effettiva di ioni in soluzione; è inferiore alla concentrazione effettiva, a causa delle interazioni ioniche.
elevazione del punto di ebollizione: elevazione del punto di ebollizione di un liquido mediante l’aggiunta di un soluto
costante di elevazione del punto di ebollizione: la costante di proporzionalità nell’equazione che mette in relazione l’elevazione del punto di ebollizione con la molalità del soluto; nota anche come costante ebullioscopica
proprietà colligativa: proprietà di una soluzione che dipende solo dalla concentrazione di una specie di soluto
crenazione: processo mediante il quale le cellule biologiche si avvizziscono a causa della perdita di acqua per osmosi
depressione del punto di congelamento: abbassamento del punto di congelamento di un liquido mediante aggiunta di un soluto
costante di depressione del punto di congelamento: (anche costante crioscopica) costante di proporzionalità nell’equazione relativa punto di congelamento da depressione a soluto molalità
emolisi: rottura dei globuli rossi dovuta all’accumulo di acqua in eccesso per osmosi
ipertonica: di maggiore pressione osmotica
ipotonica : di minore pressione osmotica
coppia di ioni: coppia di anione / cationi solvatati tenuti insieme da una moderata attrazione elettrostatica
isotonica: di uguale pressione osmotica
molalità (m) : un’unità di concentrazione definita come il rapporto tra il numero di moli di soluto e la massa del solvente in chilogrammi
frazione molare (X): il rapporto tra la quantità molare di un componente della soluzione e il numero totale di moli di tutti i componenti della soluzione
osmosi: diffusione di molecole di solvente attraverso una membrana semipermeabile
pressione osmotica (Π ): pressione opposta richiesta per impedire il trasferimento di massa di molecole di solvente attraverso una membrana semipermeabile
Legge di Raoult: la pressione parziale esercitata da un componente della soluzione è uguale al prodotto della frazione molare del componente nella soluzione e del suo equilibrio tensione di vapore allo stato puro
membrana semipermeabile: una membrana che permette selettivamente il passaggio di determinati ioni o molecole
fattore di van’t Hoff (i): il rapporto tra il numero di moli di particelle in una soluzione al numero di moli di unità formula disciolte nella soluzione
- Un nonelettrolita mostrato per confronto. ↵

