Caso clinico
Presentata una donna di 45 anni con una storia di 20 anni di malattia di Crohn con febbre, brividi e affaticamento per 10 giorni. Poco prima della comparsa dei sintomi, la paziente è stata sottoposta a una colonscopia non complicata durante la quale ha eseguito 17 biopsie per sorveglianza o polipectomia. Durante la colonscopia, il suo morbo di Crohn era in remissione e non si osservava infiammazione della mucosa.
Nella DE, i segni vitali della paziente erano HR 110, BP 120/80, RR 18, T 102,5. Aveva una lieve tenerezza addominale superiore destra. Studi di laboratorio hanno rivelato un numero elevato di globuli bianchi (15.000) e AST e ALT (120/137 U / L) elevati, con fosfatasi alcalina leggermente elevata di 200 UI / L. Una scansione di tomografia computerizzata (TC) dell’addome ha rivelato più aree di bassa attenuazione nel lobo epatico destro compatibili con ascessi epatici. Il drenaggio degli ascessi è stato coltivato e è cresciuto Streptococcus anginosus. La risoluzione di tutte le lesioni si è verificata dopo che sono state drenate dalla radiologia interventistica e al paziente è stato somministrato un ciclo di 6 settimane di antibiotici per via endovenosa.
Introduzione
La colonscopia è una procedura comunemente eseguita nella diagnosi e nel trattamento di un’ampia gamma di condizioni, tra cui cancro, malattie infiammatorie intestinali, polipi, sanguinamento e stenosi. Secondo l’American Cancer Society, lo screening della colonscopia è raccomandato ogni 10 anni a partire dai 50 anni.1 Nei pazienti ad alto rischio come quelli con malattia infiammatoria intestinale, la colonscopia viene eseguita più spesso. La procedura è ancora il modo più efficace per trovare e rimuovere piccoli polipi precancerosi e quindi ridurre il rischio di morte per cancro del colon e del retto.
In generale, la colonscopia è molto sicura. Una revisione sistematica del 2008 di 12 studi per un totale di 57.742 colonscopie eseguite per lo screening del rischio medio ha mostrato un tasso complessivo di eventi avversi gravi di appena 2,8 per 1000 procedure e una mortalità dello 0,007% .2 Tuttavia, il rischio di colonscopia non è costante tra i gruppi e alcune complicanze sono più comuni di altri. Gli anziani corrono un rischio maggiore di complicazioni gravi rispetto ai pazienti più giovani. In uno studio su 53.220 colonscopie, i pazienti di età compresa tra 80 e 84 anni hanno avuto un tasso significativamente più alto di complicanze gravi rispetto ai pazienti di età compresa tra 66 e 69 anni. Il rischio di complicanze gravi è stato aumentato anche tra i pazienti con condizioni di comorbilità come una storia di ictus, BPCO, fibrillazione atriale e insufficienza cardiaca.
L’ascesso epatico piogenico (PLA) è una complicanza rara ma grave della colonscopia . La maggior parte delle complicanze della colonscopia si presenterà entro 7 giorni, ma il PLA può presentarsi giorni o addirittura settimane più tardi e la storia della colonscopia recente potrebbe non essere nemmeno evocata a meno che il medico non sia a conoscenza di questa entità.4-6 A causa della natura ritardata di PLA, è probabile che questi pazienti vengano diagnosticati al pronto soccorso.
Altre complicazioni tardive come la sindrome da elettrocoagulazione post-polipectomia ei problemi più comuni di emorragia ritardata, dolore addominale aspecifico, reazioni agli agenti di sedazione e la perforazione può essere vista anche nell’ED. Al contrario, l’esplosione di gas o l’emorragia immediata si vedranno raramente nell’ED, poiché questi problemi si presentano tipicamente rapidamente nella suite di endoscopia, dove vengono affrontati in modo urgente. I medici ED devono essere consapevoli di tutte le possibili complicazioni e del loro corso nel tempo e avere gli strumenti per diagnosticare e trattare correttamente lo sfortunato paziente post-colonscopia che soffre di una grave complicanza.
Complicazioni
Pyogenic Ascesso epatico
La PLA è una malattia pericolosa con elevata morbilità e mortalità che si verifica a un tasso da 10 a 20 casi ogni 100.000 ricoveri ospedalieri.4-6 Con i progressi nelle tecniche diagnostiche e negli interventi, la mortalità sta migliorando.7 Tuttavia i pazienti sono ancora in grave pericolo, soprattutto se la diagnosi è ritardata, come spesso accade, perché i pazienti possono presentarsi in modo aspecifico. Uno studio retrospettivo su 63 pazienti con PLA ha mostrato che la febbre era comune (59%), ma altri segni e sintomi come dolore al quadrante superiore destro e segni peritoneali erano presenti solo nel 39% e nel 14% rispettivamente.8 La diagnosi in questo studio era spesso ritardava in media una settimana dall’insorgenza dei sintomi.
La colonscopia è un precipitante raro ma probabilmente anche sottovalutato della PLA. Si pensa che microforature silenziose durante la procedura conducano a infezioni che possono seminare il fegato attraverso la circolazione portale. Allo stesso modo, altre infezioni intra-addominali come la diverticolite possono potenzialmente causare PLA se l’area infetta viene drenata dalla vena porta.9 La clearance epatica dei batteri attraverso la rete portale è un fenomeno normale nei pazienti sani, ma l’ostruzione biliare, la scarsa perfusione e l’elevata carica batterica (come nel caso dell’infezione o delle biopsie multiple durante la colonscopia che semina il flusso sanguigno) possono predisporre alla proliferazione e all’ascesso formazione. La letteratura descrive circa il 34% dei casi di PLA come criptogenici, ma una parte di questi potrebbero essere pazienti con colonscopia recente che non è stata riconosciuta come un fattore di rischio per il processo patologico.8
La maggior parte degli isolati di PLA sono polimicrobici e comprendeva una normale flora enterica. Le emocolture sono positive nel 33-65% dei casi, ma le colture di ascessi sono quasi tutte positive.10 I microrganismi più comunemente isolati sono specie Streptococcus (37%), Eserichia Coli (33%), specie Bacteroides (24%), Klebsiella pneumoniae (18%) e streptococchi microaerofili (12%). 10-11 Lo Strep anginosus, trovato nel caso di questo paziente, è un coccus anaerobico Gram-positivo facoltativo e uno degli organismi più comuni presenti nel PLA.
Una tempestiva diagnosi di PLA è fondamentale, perché anche se la diagnosi e la terapia migliorano, la mortalità rimane al 10% .5,7 Le complicanze infettive della colonscopia in generale sono rare, ma anche in questo caso la relazione causale è probabilmente sottovalutata. La colonscopia è stata implicata in almeno alcuni casi di PLA.12-14 Ma la batteriemia sistemica transitoria, osservata nel 4% delle colonscopie, non sembra aumentare il rischio di infezione di per sé.15 Piuttosto, si pensa che l’infezione da PLA si diffonda tramite microperforazioni effettive.
Sebbene sia noto che le perforazioni franche sono relativamente rare (meno dello 0,1% delle colonscopie), l’incidenza e la fisiopatologia delle microperforazioni non sono del tutto note.16-17 Forti della conoscenza di questa clinica entità, un medico che ha una buona storia e un alto indice di sospetto può diagnosticare più rapidamente la PLA in un paziente con colonscopia recente.
Infezione
È comunemente accettato che la batteriemia transitoria dopo la colonscopia si verifica in circa il 4% delle procedure, sebbene l’intervallo sia compreso tra 0 e 25% e i fattori di rischio per la batteriemia non siano definiti.18 Tassi più elevati di batteriemia si verificano durante le attività quotidiane di routine come lavarsi i denti e masticare il cibo. Sebbene i segni o sintomi di infezione sistemica nei pazienti con batteriemia transitoria siano rari, i pazienti possono avvertire febbre, brividi e disturbi che imitano tutto, dalle infezioni delle vie respiratorie superiori a quelle addominali.18
Sebbene la batteriemia transitoria sia un rischio accettato di colonscopia , non vi è alcun beneficio comprovato per la profilassi antibiotica di routine e la maggior parte dei pazienti non avrà assunto antibiotici peri-procedura.18 Le attuali linee guida dell’American Society for Gastroenterology (ASGE) concordano con l’American Heart Association (AHA) e raccomandano contro la profilassi antibiotica per pazienti sottoposti a colonscopia di routine.19
Può essere difficile differenziare i sintomi di una batteriemia transitoria dalla vera infezione.18 In generale, i pazienti con sintomi infettivi nei giorni successivi alla colonscopia giustificano studi di laboratorio che includano emocolture e, a seconda l’indice di sospetto di perforazione, imaging addominale.20-21 Se il sospetto di perforazione è basso o la diagnosi s è escluso, l’idratazione EV e gli antibiotici possono essere somministrati se giustificato dallo stato clinico del paziente.
Sanguinamento
Il sanguinamento post-polipectomia può essere immediato o ritardato. Il sanguinamento immediato è associato a tecniche di polipectomia che non utilizzano il cauterio o quando viene utilizzata la corrente miscelata per la procedura. Il sanguinamento ritardato è più comunemente visto nel DE, poiché il sanguinamento immediato viene spesso rilevato al momento della procedura e affrontato dall’endoscopista. Il sanguinamento ritardato può essere visto fino a 7 giorni dopo la procedura. Si pensa che si verifichi a causa della desquamazione di un’escara che copriva un vaso sanguigno oa causa dell’estensione della zona di necrosi termica al tessuto non danneggiato, che potrebbe provocare sanguinamento se coinvolge un vaso sanguigno.19,22
Diversi studi di grandi dimensioni hanno riportato emorragie in 1-6 colonscopie su 1000 (0,1% -0,6%) .22 Tuttavia, uno studio che analizzava oltre 50.000 colonscopie ha rilevato che il tasso di emorragia gastrointestinale era significativamente diverso a seconda che fosse stata eseguita la polipectomia. Il sanguinamento post-polipectomia si verifica all’1-2%, con tassi più elevati osservati con la rimozione di polipi più grandi. Il rischio di sanguinamento post-polipectomia può essere aumentato nei pazienti con trombocitopenia o coagulopatie.23
I fattori di rischio noti per il sanguinamento post-colonscopia includono la dimensione del polipo, il numero di polipi rimossi, la storia del recente uso di anticoagulanti o il polipo istologia.22 Stranamente, studi multipli e ampi non hanno trovato l’uso di aspirina associato a sanguinamento post-polipectomia.24-26
I pazienti con emorragia ritardata possono presentare qualsiasi segno di sanguinamento o anemia, inclusi affaticamento, debolezza , pallore, emorragia grossolana o coaguli dopo la pulizia, tachicardia, dolore al petto e mancanza di respiro.I pazienti potrebbero descrivere l’ematochezia o la melena, a seconda della posizione dell’emorragia.
La gestione iniziale di un paziente con sospetta emorragia comprende il trattamento delle vie aeree di base, della respirazione e della circolazione con 2 IV di grande diametro, fluidi cristalloidi e monitoraggio cardiaco. I pazienti con emorragia grave del tratto gastrointestinale inferiore possono scompensarsi rapidamente e dovrebbero avere un tipo attivo e uno screening nel caso sia necessaria la trasfusione.
L’imaging non è sempre necessario e, se possibile, la decisione per l’imaging dovrebbe essere presa insieme al GI consultare, preferibilmente, il medico che ha eseguito la colonscopia. La ripetizione della colonscopia è spesso la procedura diagnostica e terapeutica di scelta. L’American College of Radiology attribuisce la valutazione di adeguatezza più alta alla colonscopia, sebbene includa anche la CTA dell’addome / pelvi e la scansione di globuli rossi Tc-99m addome / pelvi come possibili passaggi appropriati nella diagnosi.27
Se il paziente è instabile e l’endoscopista che esegue non è disponibile, il medico ED deve consultare la radiologia interventistica generale (IR), GI e chirurgia.
Perforazione
La perforazione colonscopica (PC) è una delle complicazioni più gravi e temute della colonscopia. Sebbene rara, la PC provoca un’elevata morbilità e mortalità.28-32 La perforazione può derivare da forze meccaniche contro la parete intestinale, barotrauma o elettrocauterizzazione e può portare a formazione di ascessi, formazione di fistole, sepsi intra-addominale, degenza ospedaliera prolungata e persino morte.
La PC si verifica in circa lo 0,016% delle colonscopie diagnostiche, ma può essere osservata fino al 5% delle colonscopie terapeutiche.33-35 A seconda di ciò che è stato effettivamente fatto durante la colonscopia, il rischio di perforazione può essere maggiore o inferiore alla media, quindi ottenere la relazione o la storia operativa dall’endoscopista può essere utile per determinare il rischio.
Rischio di PC per varie procedure colonscopiche: 1,36-37
-Screening colonscopia: 0,01-0,1%
-Dilatazione della stenosi anastomotica: 0-6%
-Dilatazione della stenosi della malattia di Crohn: 0-18%
-Stent posizionamento: 4%
-Posizionamento del tubo di decompressione colon: 2%
-Resezione della mucosa endoscopica colon 0-5%
A parte gli eventi durante il procedura, fattori di rischio specifici per PC includono età avanzata, comorbidità multiple, diverticolosi, ostruzione, resezione di polipi, polipi di dimensioni superiori a 1 cm o quelli trovati nel colon destro, ridotta mobilità del colon, debolezza esistente nella parete del colon , precedente tentativo incompleto di colonscopia o inesperienza endoscopica.20
I pazienti con PC possono presentare un dolore addominale improvviso e in peggioramento, seguito dalla completa dissipazione falsamente rassicurante del dolore mentre la perforazione decomprime l’organo infiammato. Poiché il contenuto gastrointestinale continua a riversarsi nel peritoneo, si sviluppano un peggioramento del dolore e dei sintomi peritoneali. Tuttavia, i sintomi variano in base alla posizione e alle dimensioni della perforazione, al grado di infiltrazione fecale nel peritoneo e all’età e alle comorbidità del paziente.
In particolare, le perforazioni possono anche essere retroperitoneali, corrispondenti al posizione del colon ascendente e discendente e delle flessioni epatiche e spleniche. Sebbene il sintomo più comune di una perforazione del colon sia il dolore addominale, i pazienti anziani possono avere una risposta attenuata. Altri sintomi includono febbre, nausea, vomito, dispnea, dolore toracico, dolore scapolare e dolore al collo. Le perforazioni retroperitoneali, in particolare, possono avere sintomi minimi o atipici, e i segni vitali possono mostrare tachicardia e febbre, ma potrebbero anche essere normali.20
La gestione iniziale di una sospetta perforazione include attenzione alle vie aeree, respirazione, circolazione con 2 IV di grande diametro, fluidi cristalloidi e monitor cardiaco. Dovrebbero essere ottenuti laboratori tra cui CBC, CMP, lipasi e tipo e screening. Il paziente deve essere rigorosamente NPO con antibiotici empirici IV. L’imaging statistico con TC addome / pelvi o radiografia addominale se instabile deve essere ordinato insieme a un consulto chirurgico stat.21
Sindrome post-polipectomia
Sindrome post-polipectomia, nota anche come sindrome da elettrocoagulazione post-polipectomia o sindrome da ustione transmurale, deriva da una lesione da elettrocoagulazione alla parete intestinale, che crea un’ustione transmurale e una peritonite focale senza perforazione franca.38 L’incidenza riportata varia da 3 su 100.000 (0,003%) a 1 su 1000 (0,1% ). La sindrome post-polipectomia è stata segnalata in 6 pazienti su 16.318 colonscopie eseguite tra il 1994 e il 2002 in un grande sistema sanitario integrato.39 I fattori di rischio per questa complicanza rara sono sconosciuti.
I pazienti con sindrome post-polipectomia di solito sono presenti entro 12 ore dalla colonscopia con febbre, tachicardia e dolore addominale. Tuttavia, l’insorgenza dei sintomi può essere ritardata fino a 5-7 giorni dopo la procedura.40 I pazienti spesso hanno leucocitosi e possono mostrare rigidità e tachicardia, che imitano la perforazione del colon.41
Tuttavia, a differenza della perforazione, che può richiedere un intervento chirurgico d’urgenza, i pazienti con sindrome post-polipectomia sono generalmente gestiti in modo conservativo con fluidi per via endovenosa, controllo del dolore e avanzamento graduale della dieta, con o senza antibiotici mirati a patogeni negativi e anaerobici.42 I casi meno gravi possono essere gestiti anche in ambiente ambulatoriale con antibiotici orali e liquidi chiari per 1-2 giorni.42-43
Poiché questi pazienti possono essere indistinguibili dai pazienti con perforazione, qualsiasi paziente sospettato di sindrome post-polipectomia garantisce laboratori e imaging. Nella sindrome post-polipectomia, la TAC di solito mostra un ispessimento focale della parete del colon con la formazione di grasso circostante senza aria extramurale, sebbene nei casi lievi la TAC possa essere negativa.42 Indipendentemente dal risultato di imaging, come con la perforazione, se la sindrome post-polipectomia si sospetta, il paziente dovrebbe avere un consulto chirurgico.
Perle
- La colonscopia è un test di screening ampiamente utilizzato nei pazienti sopra i 50 anni. Le complicanze possono essere precoci o ritardate. I medici EM devono essere consapevoli delle possibili complicanze e della tempistica prevista, al fine di diagnosticare e gestire con precisione ogni possibile complicanza che si presenta.
- Le complicanze includono emorragia, perforazione, sindrome post-polipectomia, infezione, esplosione di gas e ascesso epatico piogenico.
- L’anamnesi sui fattori del paziente e sulla procedura stessa (condizioni sottostanti, farmaci, se i polipi sono stati rimossi, se è stato usato il cauterio, se c’è stato sanguinamento immediato) può guidare la diagnosi e la gestione nell’ED.
- L’ascesso epatico piogenico può presentarsi 1-2 settimane dopo la colonscopia con dolore al quadrante superiore destro e febbre.
- Gran parte del colon è retroperitoneale. Le perforazioni retroperitoneali possono causare sintomi vaghi e atipici, quindi l’indice di sospetto deve essere alto.
- La sindrome post-polipectomia può simulare la perforazione e di solito può essere differenziata mediante imaging.
Riferimenti / ulteriori letture:
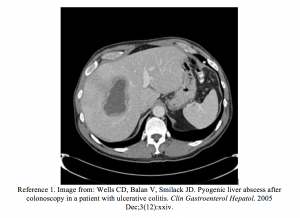
- Wells CD, Balan V, Smilack JD. Ascesso epatico piogenico dopo colonscopia in un paziente con colite ulcerosa. Clin Gastroenterol Hepatol. 2005 dicembre; 3 (12): XXIV.
- Whitlock, E.P., Lin, J.S., Liles, E. et al. Screening per il cancro del colon-retto: una revisione sistematica mirata e aggiornata per la US Preventive Services Task Force. Ann Intern Med. 2008; 149: 638–658.
- Warren JL, Klabunde CN, Mariotto AB, Meekins A, Topor M, Brown ML, Ransohoff. Eventi avversi dopo la colonscopia ambulatoriale nella popolazione Medicare. Ann Intern Med. 2009; 150 (12): 849.
- Johannsen EC, Sifri CD, Madoff LC. Ascessi epatici piogenici Infect Dis Clin North Am. 2000; 14: 547–63.
- Meddings L, Myers RP, Hubbard J, et al. Uno studio basato sulla popolazione degli ascessi epatici piogeni negli Stati Uniti: incidenza, mortalità e tendenze temporali. Sono J Gastroenterol. 2010; 105: 117–24.
- Kaplan GG, Gregson DB, Laupland KB. Studio basato sulla popolazione dell’epidemiologia e dei fattori di rischio per l’ascesso epatico piogenico. Clin Gastroenterol Hepatol. 2004; 2: 1032-8.
- Petri A, Höhn J, Hódi Z, Wolfárd A, Balogh A. Ascesso epatico piogenico – 20 anni di esperienza. Confronto di risultati di trattamento in due periodi. Langenbecks Arch Surg. 2002; 387: 27–31.
- Pang TC, Fung T, Samra J, Hugh TJ, Smith RC. Ascesso epatico piogenico: un audit di 10 anni di esperienza. World J Gastroenterol. 2011; 17: 1622–30.
- Murarka S, Pranav F, Dandavate V. Disseminate Streptococcus anginosus da diverticolite sigmoidea. J Glob Infect Dis. 2011; 3: 79–81.
- Branum GD, Tyson GS, Branum MA, Meyers WC. Ascesso epatico. Cambiamenti di eziologia, diagnosi e gestione. Ann Surg. 1990 dicembre 212 (6): 655-62.
- Gyorffy EJ, Frey CF, Silva J Jr, McGahan J. Pyogenic liver ascess. Strategie diagnostiche e terapeutiche. Ann Surg. 1987 dicembre 206 (6): 699-705.
- Bonenfant F, Rousseau É, Farand P. Streptococcus anginosuspyogenic ascesso epatico dopo una colonscopia di screening. Il Canadian Journal of Infectious Diseases & Medical Microbiology. 2013; 24 (2): e45-e46.
- Ian G. Harnik. Ascesso epatico piogenico che si presenta dopo polipectomia maligna. Dig Dis Sci. 2007; 52: 3524-5.
- Paraskeva KD, Bury RW, Isaacs P.Streptococcus milleri ascessi epatici: una complicanza insolita dopo la rimozione colonscopia di un osso di pesce colpito. Gastrointest Endosc. 2000; 51: 357–8.
- DE basso, Shoenut JP, Kennedy JK, et al. Valutazione prospettica del rischio di batteriemia con colonscopia e polipectomia. Dig Dis Sci. 1987; 32: 1239–43.
- Becker F, Nusko G, Welke J, Hahn EG, Mansmann U. Follow-up dopo polipectomia colorettale: un’analisi rischio-beneficio delle raccomandazioni di sorveglianza tedesca. Int J Colorettale Dis. 2007; 22: 929–39.
- Macrae FA, Tan KG, Williams CB. Verso una colonscopia più sicura: un rapporto sulle complicanze di 5000 colonscopie diagnostiche o terapeutiche. Intestino. 1983; 24: 376–83.
- Nelson, D.B.Complicazioni di malattie infettive dell’endoscopia gastrointestinale: parte II, infezioni esogene. Gastrointest Endosc. 2003; 57: 695–711.
- Khashab, M.A., Chithadi, K.V., Acosta, R.D. et al. Profilassi antibiotica per endoscopia gastrointestinale. ASGE Standards of Practice Committee. Gastrointest Endosc. 2015; 81: 81-89.
- Lohsiriwat V. Perforazione colonscopica: incidenza, fattori di rischio, gestione ed esito. Giornale mondiale di gastroenterologia: WJG. 2010; 16 (4): 425-430.
- American College of Radiology ACR Appropriateness Criteria: Acute (Nonlocalized)
- Ko, C.W. and Dominitz, J.A. Complicazioni della colonscopia: magnitudo e gestione. Gastrointest Endosc Clin N Am. 2010; 20: 659–671.
- Warren JL, Klabunde CN, Mariotto AB, et al. Eventi avversi dopo la colonscopia ambulatoriale nella popolazione Medicare. Ann Intern Med 2009; 150: 849-57.
- Hui, A.J., Wong, R.M., Ching, J.Y. et al. Rischio di sanguinamento da polipectomia colonscopia con anticoagulanti e agenti antipiastrinici: analisi di 1657 casi. Gastrointest Endosc. 2004; 59: 44–48.
- Sawhney, M.S., Salfiti, N., Nelson, D.B. et al. Fattori di rischio per sanguinamento postpolipectomia grave ritardato. Endoscopia. 2008; 40: 115–119
- Yousfi, M., Gostout, C.J., Baron, T.H. et al. Emorragia gastrointestinale inferiore postpolipectomia: ruolo potenziale dell’aspirina. Sono J Gastroenterol. 2004; 99: 1785–1789.
- Criteri di adeguatezza ACR dell’American College of Radiology: gestione radiologica del sanguinamento del tratto gastrointestinale inferiore. https://acsearch.acr.org/docs/69457/Narrative/ (Accesso 16 luglio 2017).
- Lohsiriwat V, Sujarittanakarn S, Akaraviputh T, Lertakyamanee N, Lohsiriwat D, Kachinthorn U. Perforazione colonscopica: un rapporto dal centro di formazione per l’endoscopia dell’Organizzazione mondiale di gastroenterologia in Thailandia. World J Gastroenterol. 2008; 14: 6722–6725.
- Iqbal CW, Cullinane DC, Schiller HJ, Sawyer MD, Zietlow SP, Farley DR. Gestione chirurgica e risultati di 165 perforazioni colonscopiche da un singolo istituto. Arch Surg. 2008; 143: 701–706; discussione 706-707.
- Teoh AY, Poon CM, Lee JF, Leong HT, Ng SS, Sung JJ, Lau JY. Risultati e predittori di mortalità e formazione di stomia nella gestione chirurgica delle perforazioni colonscopiche: una revisione multicentrica. Arch Surg. 2009; 144: 9-13.
- Lüning TH, Keemers-Gels ME, Barendregt WB, Tan AC, Rosman C. Perforazioni colonscopiche: una revisione di 30.366 pazienti. Surg Endosc. 2007; 21: 994–997.
- Mai CM, Wen CC, Wen SH, Hsu KF, Wu CC, Jao SW, Hsiao CW. Perforazione iatrogena del colon mediante colonscopia: una complicanza fatale per i pazienti ad alto rischio anestetico. Int J Colorettale Dis. 2010 aprile; 25 (4): 449-54.
- Rathgaber SW, Wick TM. Completamento della colonscopia e tassi di complicanze in uno studio di gastroenterologia di comunità. Gastrointest Endosc. 2006; 64: 556–562.
- Damore LJ, Rantis PC, Vernava AM, Longo WE. Perforazioni colonscopiche. Eziologia, diagnosi e gestione. Dis Colon Rectum. 1996; 39: 1308–1314.
- Repici A, Pellicano R, Strangio G, Danese S, Fagoonee S, Malesci A. Resezione della mucosa endoscopica per neoplasia colorettale precoce: base patologica, procedure e risultati. Dis Colon Rectum. 2009; 52: 1502–1515.
- Chukmaitov A, Bradley CJ, Dahman B, et al. Associazione di tecniche di polipectomia, volume endoscopico e tipo di struttura con complicanze della colonscopia. Gastrointest Endosc. 2013; 77: 436.
- Fisher DA, Maple DT, et al. Complicazioni della colonscopia. ASGE Standards of Practice Committee Gastrointest Endosc. 2011; 74: 745. Dolore addominale e febbre o sospetto ascesso addominale; Variante 1: paziente postoperatorio con febbre. https://acsearch.acr.org/docs/69356/Narrative/ (consultato il 17 luglio 2017).
- Hirasawa K, Sato C, Makazu M, et al. Sindrome da coagulazione: perforazione ritardata dopo trattamenti endoscopici colorettali. Giornale mondiale di endoscopia gastrointestinale. 2015; 7 (12): 1055-1061.
- Levin TR, Zhao W, Conell C, Seeff LC, Manninen DL, Shapiro JA, Schulman J. Complications of colonscopy in an integrated health care delivery system. Ann Intern Med. 2006; 145 (12): 880.
- Kim HW. Cosa c’è di diverso tra la febbre postpolipectomia e la sindrome della coagulazione postpolipectomia? Clin Endosc. 2014; 47 (3): 205–6.
- Stock C, Ihle P, Sieg A, Schubert I, Hoffmeister M, Brenner H Eventi avversi che richiedono il ricovero entro 30 giorni dopo lo screening ambulatoriale e colonscopie senza screening. Gastrointest Endosc. 2013 marzo; 77 (3): 419-29.
- Sethi A, Song LMWK. Eventi avversi correlati alla resezione della mucosa endoscopica del colon e alla polipectomia. Gastrointest Endosc Clin N Am. 2015; 25 (1): 55-69.
- Benson BC, Myers JJ, Laczek JT. Sindrome da elettrocoagulazione postpolipectomia: un imitatore della perforazione del colon. Case Rep Emerg Med. 2013; 2013 687931.