- La presenza di alte concentrazioni di anticorpi (titolo > 1: 640) dovrebbe far sospettare che si tratti di una malattia autoimmune presente. In questo scenario, raccomando che i sieri vengano poi testati per gli anticorpi contro dsDNA, Sm, RNP, Ro (SS-A), La (SS-B) e forse Scl-70. La presenza di anticorpi contro uno qualsiasi di questi aumenta notevolmente la probabilità che il paziente abbia LES, MCTD, Sjögren o sclerodermia. Alcuni laboratori testeranno automaticamente questi anticorpi ogni volta che lo screening ANA è positivo. Tuttavia, la presenza di questi anticorpi non è diagnostica della malattia. Se non è possibile fare una diagnosi iniziale, è mia prassi osservare attentamente il paziente nel tempo per lo sviluppo di una malattia associata ad ANA e visitare il paziente almeno due volte all’anno.
- La combinazione di titoli bassi di anticorpi (< 1:80) e nessun o pochi segni o sintomi di malattia fanno presagire una probabilità molto minore di una malattia autoimmune. Di conseguenza, questi pazienti con titoli ANA bassi devono essere rivalutati meno frequentemente, ogni anno a meno che i sintomi clinici non evolvano per suggerire una malattia autoimmune.
- È altamente improbabile che un paziente con ANA negativo abbia SLE o MCTD , Sjögren o sclerodermia. Tuttavia, se esiste ancora una forte evidenza clinica di una malattia autoimmune sistemica, si possono testare gli anticorpi specifici contro DNA a doppia elica (ds), Sm, RNP, Ro, La o Scl-70, sebbene, nella mia esperienza, sono tipicamente negativi. Tuttavia, è prudente vedere tali pazienti in cui vi è un alto indice clinico di sospetto, almeno annualmente, sebbene più frequentemente se clinicamente indicato.
- Gli anticorpi antinucleari producono un’ampia gamma di pattern di colorazione (omogenei, diffusi , periferico, orlo, maculato, nucleolare, anticentromero, ecc.). È stato riconosciuto che il pattern di colorazione nucleare ha una sensibilità e specificità relativamente basse per diverse malattie autoimmuni. La presenza di anticorpi diretti contro antigeni nucleari specifici è solitamente più utile. (Questi anticorpi includono quanto segue: dsDNA, Sm, RNP, Ro, La o Scl-70.)
Negli ultimi anni, ricercatori e aziende biotecnologiche hanno sviluppato saggi immunologici per sostituire il test IF ANA.4-23 La logica alla base di questo tentativo si riferisce alle caratteristiche prestazionali della tecnica IF. Questo test è molto laborioso ed è soggetto a variazioni dovute alle diverse interpretazioni dei tecnici. A complicare il test è anche lo sbiadimento dell’immagine mentre viene esaminata in un microscopio a fluorescenza. Inoltre, la tecnica IF utilizza diluizioni seriali dei sieri dei pazienti, che daranno risultati che potrebbero non essere lineari. Le variazioni del titolo di due volte sono comuni nei test giornalieri sullo stesso campione; si dice che quattro volte le differenze siano “significative”. Al contrario, i dosaggi immunologici in fase solida sono automatizzati e altamente riproducibili. I risultati sono lineari e la tecnica è meno laboriosa e quindi più economica da eseguire.
A causa di queste considerazioni, dovrebbero esserci risparmi economici in impiegando un dosaggio immunologico in fase solida per quantificare un ANA. Pertanto, nel tentativo di sviluppare analisi immunologiche ANA in fase solida, un certo numero di gruppi ha messo sulla fase solida qualunque antigene sia tipicamente analizzato nei più specifici test immunologici ANA (ad esempio, DNA, Sm, RNP, Ro / SSA, La / SSB, nucleoproteina, estratti cellulari, ecc.) Nei rapporti pubblicati, il coefficiente di correlazione tra i titoli ANA e questi saggi in fase solida è abbastanza buono. Pertanto, molte aziende commerciali hanno cambiato i loro ANA a questi saggi immunologici in fase solida.4-23 Tuttavia, motivo di preoccupazione è l’alta frequenza / percentuale di risultati falsi negativi in pazienti con LES noto e malattie correlate, nonché la continua alta frequenza di “falsi positivi” (ad es. un ANA positivo in qualcuno senza SLE) in questi studi.15-21 Ulteriore lavoro è necessario per migliorare la sensibilità e soprattutto la specificità di questi test immunologici in fase solida per garantire che i pazienti con LES e malattie correlate non vengano trascurati da questi test immunologici in fase solida.
Anticorpi al DNA
Gli anticorpi al DNA possono essere principalmente suddivisi in quelli che reagiscono con DNA a filamento singolo (ss) e quelli che riconoscono dsDNA.24-26
Anti- Anticorpi anti-ssDNA sono stati segnalati in SLE, artrite reumatoide, lupus farmaco-correlato, parenti sani di pazienti con LES e, meno comunemente, in altre malattie reumatiche. (Vedi Tabella 2, p. 17.) Pertanto, l’anti-ssDNA ha un’utilità limitata per la diagnosi di LES o altre malattie reumatiche. L’anti-ssDNA non si correla bene con l’attività della malattia e quindi non è utile per la gestione della malattia.
Gli anticorpi contro il dsDNA sono più frequentemente rilevati dai saggi immunologici in fase solida, ma anche in alcuni laboratori dal saggio crithidia IF o occasionalmente il saggio radioimmunologico di Farr.La maggior parte dei laboratori ospedalieri e commerciali ne fa solo uno. Il test di Farr ha probabilmente la più alta specificità e la più bassa sensibilità dei tre test per la diagnosi di LES, mentre i test in fase solida hanno la massima sensibilità e la più bassa specificità; il test crithidia cade nel mezzo. Il saggio di Farr ha anche lo svantaggio di utilizzare materiale radioattivo, che la maggior parte dei laboratori evita, e il test dei critidi è molto laborioso. Preferisco il test ELISA per l’uso quotidiano.
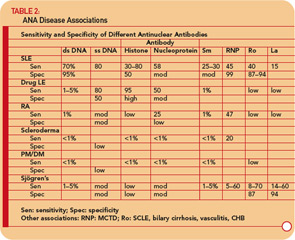
Gli anti-dsDNA sono specifici (95%) sebbene non altamente sensibili (70%) per SLE, rendendoli molto utili per la diagnosi quando positivi.9 (Vedi Tabella 2 , p. 17.) Si trovano occasionalmente in altre condizioni, tra cui artrite reumatoide, artrite giovanile, lupus indotto da farmaci, epatite autoimmune e persino in persone normali.
I titoli degli anticorpi anti-dsDNA spesso fluttuano con attività della malattia, in particolare la nefrite lupica, e sono quindi utili in molti pazienti per seguire il decorso del LES. Se un paziente ha un titolo in aumento, o un titolo molto alto, ma clinicamente è quiescente, non tratto l’anomalia sierologica, ma lo considero un segnale di avvertimento che il paziente deve essere seguito più da vicino e trattato quando accade qualcosa clinicamente per giustificare un cambiamento nella terapia. Tuttavia, alcuni ricercatori hanno trattato queste anomalie sierologiche (specialmente se associate a bassi livelli di complemento) e hanno riportato risultati clinici migliori. Al contrario, utilizzo un titolo decrescente in qualcuno che sta migliorando dopo una riacutizzazione del trattamento come guida per ridurre il trattamento (p. Es., Corticosteroidi e / o immunosoppressori).
L’associazione tra anticorpi anti-dsDNA e altri le manifestazioni patologiche del LES sono molto meno chiare. Ad esempio, non esiste alcuna relazione tra il titolo anti-dsDNA e l’attività della malattia del LES neuropsichiatrico.
Distinguere le manifestazioni attive del lupus dalle complicazioni infettive o dagli effetti tossici dei farmaci e dalle malattie non correlate è sempre una sfida. La presenza di anticorpi anti-dsDNA può essere utile in alcuni pazienti per fare questa distinzione.
Anticorpi anti-Smith e anti-ribonucleoproteina
Anticorpi anti-Smith (Sm) e anti-ribonucleoproteina (anti-RNP) vengono rilevati più frequentemente dai test immunologici in fase solida.24,27
Gli anticorpi anti-Sm si trovano solo nel 10% -40% dei pazienti con LES, ma sono molto rari nei pazienti con altre condizioni (cioè, non sono sensibili ma sono altamente specifiche). La misurazione dei titoli anti-Sm può essere utile dal punto di vista diagnostico, in particolare in un momento in cui gli anticorpi anti-DNA non sono rilevabili. Data la sensibilità relativamente bassa dell’anti-Sm, tuttavia, un valore negativo non esclude in alcun modo la diagnosi di SLE.
Gli anticorpi anti-RNP si trovano in circa il 40-60% dei pazienti con SLE, ma non sono specifici per SLE, essendo una caratteristica distintiva di MCTD. Questi anticorpi possono anche verificarsi a bassi titoli e basse frequenze in altre malattie reumatiche tra cui RA e sclerodermia. (Vedi Tabella 2, p. 17.)
Né il titolo (livelli) di anticorpi anti-Sm né anti-RNP è correlato ad alcuna attività clinica.
Anti-Ro / SSA e anticorpi anti-La / SSB
Gli anticorpi anti-Ro / SSA e La / SSB vengono rilevati più frequentemente dai saggi immunologici in fase solida.28,29 Sono stati rilevati anti-Ro / SSA e anti-La / SSB in alta frequenza nei pazienti con sindrome di Sjögren e SLE, ma anche in pazienti con dermatite fotosensibile e nello 0,1% – 0,5% degli adulti sani.
Gli anticorpi anti-Ro / SSA si trovano in circa il 50% dei pazienti con SLE. (Vedi Tabella 2, p. 17.) Sono stati associati a fotosensibilità, lupus cutaneo subacuto, vasculite cutanea (porpora palpabile), malattia polmonare interstiziale, lupus neonatale e blocco cardiaco congenito. Gli anticorpi anti-Ro / SSA si trovano in circa il 75% dei pazienti con sindrome di Sjögren primaria (vedere Tabella 2, p. 17) e titoli elevati di questi anticorpi sono associati a una maggiore incidenza di caratteristiche extra ghiandolari, in particolare porpora e vasculite. Al contrario, gli anticorpi Ro / SSA sono presenti solo nel 10-15% dei pazienti con sindrome di Sjögren secondaria associata ad artrite reumatoide. Pertanto, la presenza di anticorpi Ro / SSA o anti-La / SSB in pazienti con sospetta sindrome di Sjögren primaria supporta fortemente la diagnosi.
Circa il 50% dei pazienti con LES che hanno anticorpi anti-Ro hanno anche -La anticorpo, un antigene della proteina RNA strettamente correlato. Allo stesso modo, la maggior parte dei pazienti con sindrome di Sjögren ha anche anticorpi anti-La (SSB). È estremamente raro trovare pazienti con anticorpi anti-La senza anticorpi anti-Ro.
A mio parere, le indicazioni per ordinare un test per gli anticorpi anti-Ro / SSA e anti-La / SSB sono le seguenti:
- Donne con LES in gravidanza o potrebbe rimanere incinta in futuro;
- Donne che hanno avuto precedenti di aver dato alla luce un bambino con blocco cardiaco o miocardite;
- Pazienti con una storia di eruzioni cutanee fotosensibili inspiegabili;
- Pazienti fortemente sospettati di avere LES ma che hanno un test ANA negativo; o
- Pazienti con sintomi di xerostomia, cheratocongiuntivite secca e / o ingrossamento delle ghiandole salivari e lacrimali.
Anticorpi anti-proteina P
Anti- gli anticorpi contro la proteina P ribosomiale sono stati rilevati nel 10-20% dei pazienti con LES negli Stati Uniti e nel 40-50% dei pazienti asiatici con LES, ma raramente in altre malattie reumatiche.30 Gli anticorpi anti-proteina P ribosomiale possono essere altamente specifico per la psicosi associata al lupus, sebbene non tutti gli studi lo abbiano confermato. La depressione e il coinvolgimento renale ed epatico nei pazienti con lupus sono stati anche associati ad anticorpi anti-proteina P ribosomiale in alcuni piccoli studi.
A causa della bassa sensibilità e della scarsa correlazione clinica, molti ricercatori, me compreso, vedono scarsa utilità clinica in questo test.
Anticorpi anti-centromero
Gli anticorpi anti-centromero (ACA) si trovano quasi esclusivamente nei pazienti con sclerosi sistemica cutanea limitata (lcSSc), specialmente in quelli con CREST.31 ACA sono stati osservati nel 57% dei pazienti con CREST ma sono stati osservati anche in pazienti con altre condizioni, inclusi alcuni pazienti con il solo fenomeno di Raynaud. Gli ACA vengono tipicamente rilevati dal caratteristico pattern IF sulle cellule Hep-2.
Anticorpi anti-Scl-70 (topoisomerasi-1)
Circa dal 15% al 20% dei pazienti con sclerodermia hanno anticorpi contro una proteina 70kd (topoisomerasi-1), successivamente denominata Scl-70.31 Il metodo usuale per il rilevamento è l’ELISA. La presenza di questi anticorpi sembra aumentare il rischio di fibrosi polmonare tra i pazienti con sclerodermia ed è abbastanza specifica per la malattia.
Riepilogo
Se si sospetta SLE sulla base dell’anamnesi, esame e esame emocromocitometrico completo (p. es., leucopenia, trombocitopenia), richiedere un test ANA. Se è negativo, è altamente improbabile che il paziente abbia il LES e il paziente può essere rassicurato. Se il titolo è < 1: 160, SLE è improbabile e il paziente può essere rassicurato sul fatto che SLE è improbabile, ma il paziente deve essere seguito periodicamente. Un titolo ≥1: 160 aumenta la probabilità di LES e disturbi correlati. Tuttavia, è importante ricordare che l’85% delle persone con ANA positivo non ha il LES. Se l’ANA è positivo, si dovrebbe anche verificare la presenza di anticorpi contro dsDNA, Sm, RNP, Ro / SSA e La / SSB. La presenza di questi anticorpi aumenta notevolmente la probabilità che il paziente abbia LES e disturbi correlati (vedere Tabella 2, p. 17) e il paziente deve essere seguito più da vicino. La rilevazione degli anticorpi anti-centromero e anti-Scl-70 è molto utile per la diagnosi di sclerodermia. La rilevazione di anticorpi contro Ro / SSA e La / SSB sono utili anche per la diagnosi della sindrome di Sjögren.
L’unico di questi test che è utile per monitorare l’attività è l’anti-dsDNA.
Ringraziamenti: sono in debito con il lavoro di molti autori di UpToDate in Medicine, il cui lavoro ha fornito un quadro utile per lo sviluppo di questo articolo, nonché con Drs. Robert Shmerling, David Lee e Donald Bloch, con cui ho scritto articoli e capitoli sullo stesso argomento.
Dr. Schur è professore di medicina presso la Harvard Medical School e la divisione di reumatologia, immunologia e allergia nel dipartimento di medicina del Brigham and Women’s Hospital di Boston.
- Reichlin M. Misurazione e significato clinico di anticorpi antinucleari. Aggiornato. Ottobre 2008.
- Comitato ad hoc dell’American College of Rheumatology sulle linee guida per i test immunologici. Linee guida per i test immunologici di laboratorio nelle malattie reumatiche: un’introduzione. Artrite reumata. 2002; 47: 429-433.
- Solomon DH, Kavanaugh AJ, Schur PH, et al. Linee guida basate sull’evidenza per l’uso dei test immunologici: test degli anticorpi antinucleari. Artrite reumata. 2002; 47: 434-444.
- Sinclair D, Saas M, Williams D, Hart M, Goswami R. Può un ELISA sostituire l’immunofluorescenza per il rilevamento di anticorpi anti-nucleari? – L’uso di routine di anti – ELISA per lo screening di anticorpi nucleari. Clin Lab. 2007; 53: 183-191.
- Avaniss-Aghajani E, Berzon S, Sarkissian A. Valore clinico dei saggi immunologici basati su microsfere multiplex per la rilevazione di autoanticorpi contro antigeni nucleari. Clin Vaccine Immunol. 2007; 14: 505-509.
- Copple SS, Martins TB, Masterson C, Joly E, Hill HR. Confronto di tre immunodosaggi multiplex per la rilevazione di anticorpi contro gli anticorpi nucleari estraibili utilizzando sieri clinicamente definiti. Ann N Y Acad Sci.2007; 1109: 464-472.
- Caramaschi P, Ruzzenente O, Pieropan S, et al. Determinazione della specificità degli ANA mediante immunodosaggio a microsfere fluorescenti multiplex in pazienti con positività agli ANA ad alti titoli dopo il trattamento con infliximab: risultati preliminari. Rheumatol Int. 2007; 27: 649-654.
- Biagini RE, Parks CG, Smith JP, Sammons DL, Robertson SA. Prestazioni analitiche del test AtheNA MultiLyte ANA II nei sieri di pazienti affetti da lupus con più ANA positivi. Anal Bioanal Chem. 2007; 388: 613-618.
- Gonzalez C, Garcia-Berrocal B, Perez M, et al. Screening di laboratorio delle malattie del tessuto connettivo mediante un nuovo test di screening ENA automatizzato (EliA Symphony) in pazienti clinicamente definiti. Clin Chim Acta. 2005; 359: 109-114.
- Eissfeller P, Sticherling M, Scholz D, et al. Confronto di diversi sistemi di test per la rilevazione simultanea di autoanticorpi nelle malattie del tessuto connettivo. Ann N Y Acad Sci. 2005; 1050: 327-339.
- Smith J, Onley D, Garey C, et al. Determinazione della specificità ANA utilizzando la piattaforma UltraPlex. Ann N Y Acad Sci. 2005; 1050: 286-294.
- Martins TB, Burlingame R, von Muhlen CA, et al. Valutazione del saggio immunologico su microsfere fluorescenti multiplex per la rilevazione di autoanticorpi contro antigeni nucleari. Clin Diagn Lab Immunol. 2004; 11: 1054-1059.
- Bernardini S, Infantino M, Bellincampi L, et al. Screening degli anticorpi antinucleari: confronto tra dosaggio immunoenzimatico basato su omogenati nucleari, antigeni purificati o ricombinanti e test di immunofluorescenza. Clin Chem Lab Med. 2004; 42: 1155-1160.
- Nossent H, Rekvig OP. Screening di anticorpi antinucleari in questo nuovo millennio: addio al microscopio? Scand J Rheumatol. 2001; 30: 123-126; discussione 127-128.
- Lopez-Hoyos M, Rodriguez-Valverde V, Martinez-Taboada V. Performance dello screening della malattia del tessuto connettivo con anticorpi antinucleari. Ann N Y Acad Sci. 2007; 1109: 322-329.
- Ghillani P, Rouquette AM, Desgruelles C, et al. Valutazione del test di screening LIAISON ANA per il test degli anticorpi antinucleari nelle malattie autoimmuni. Ann N Y Acad Sci. 2007; 1109: 407-413.
- Bonilla E, Francis L, Allam F, et al. La microscopia a immunofluorescenza è superiore alle sfere fluorescenti per il rilevamento della reattività degli anticorpi antinucleari nei pazienti con lupus eritematoso sistemico. Clin Immunol. 2007; 124: 18-21.
- Nifli AP, Notas G, Mamoulaki M, et al. Confronto tra un test fluorescente multiplex basato su biglie e metodi di immunofluorescenza per la rilevazione di autoanticorpi ANA e ANCA nel siero umano. Metodi J Immunol. 2006; 311: 189-197.
- Shovman O, Gilburd B, Zandman-Goddard G, et al. Saggio immunologico multi-litico AtheNA multiplex per lo screening degli ANA nelle malattie autoimmuni. Autoimmunità. 2005; 38: 105-109.
- Ulvestad E. Caratteristiche delle prestazioni e utilità clinica di un ELISA ibrido per il rilevamento di ANA. Apmis. 2001; 109: 217-222.
- Olaussen E, Rekvig OP. Test di screening per gli anticorpi antinucleari (ANA): uso selettivo degli antigeni nucleari centrali come base razionale per lo screening mediante ELISA. J Autoimmun. 1999; 13: 95-102.
- Homburger HA, Cahen YD, Griffiths J, Jacob GL. Rilevazione di anticorpi antinucleari: valutazione comparativa del dosaggio immunoenzimatico e metodi di immunofluorescenza indiretta. Arch Pathol Lab Med. 1998; 122: 993-999.
- Gniewek RA, Stites DP, McHugh TM, Hilton JF, Nakagawa M. Confronto dei metodi di test degli anticorpi antinucleari: test di immunofluorescenza contro dosaggio immunoenzimatico. Clin Diagn Lab Immunol. 1997; 4: 185-188.
- Reichlin M. Antibodies to DNA, SM e RNP. Aggiornato. Ottobre 2008.
- Hahn BH. Anticorpi contro il DNA. Nuovo Engl J Med. 1998; 338: 1359.
- Kavanaugh AF, Solomon DH, the American College of Rheumatology Ad Hoc Committee on Immunologic Testing Guidelines. Linee guida per i test immunologici di laboratorio nelle malattie reumatiche: test degli anticorpi anti-DNA. Artrite reumata. 2002; 47: 546-555.
- Benito-Garcia E, Schur PH, Lahita R. Linee guida per i test di laboratorio immunologici nelle malattie reumatiche: test anticorpali Anti-Sm e Anti-RNP. Artrite reumata. 2004; 51: 1030-1044.
- Reichlin M. Significato clinico degli anticorpi anti-Ro / SSA e anti-La / SSB. Aggiornato. Ottobre 2008.
- Reveille JD, Sherrer YRS, Solomon DH, Schur P, Kavanaugh A. Linee guida basate sull’evidenziazione per l’uso di test di laboratorio immunologici: Anti-Ro (SS-A) e La (SS- B): un rapporto del comitato ad hoc ACR sulle linee guida per i test immunologici. Presentato per la pubblicazione.
- Anticorpi anti-proteina P Reichlin M. Antiribosomal. Aggiornato. Ottobre 2008.
- Denton CP. Classificazione della sclerodermia. Aggiornato. Ottobre 2008.