Infiammazione intravascolare maligna
La sepsi è stata definita un processo di infiammazione intravascolare maligna . Normalmente, una cascata immunologica potente e complessa garantisce una pronta risposta protettiva all’invasione di microrganismi negli esseri umani. Una difesa immunologica carente può consentire il consolidamento dell’infezione; tuttavia, una risposta eccessiva o scarsamente regolata può danneggiare l’ospite attraverso il rilascio disadattivo di composti infiammatori generati indigeni (vedere l’immagine sotto).
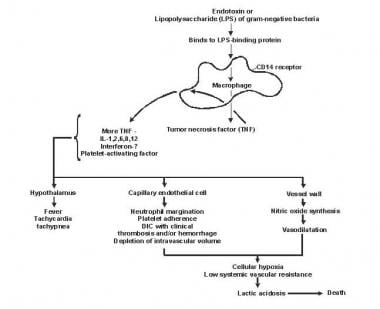 Patogenesi della sepsi e dell’insufficienza multiorgano.
Patogenesi della sepsi e dell’insufficienza multiorgano. Il lipide A e altri prodotti batterici rilasciano citochine e altri immunomodulatori che mediano le manifestazioni cliniche della sepsi. Interleuchine, fattore di necrosi tumorale (TNF) -α, interferone gamma (IFN-γ) e altri fattori stimolanti le colonie vengono prodotti rapidamente entro pochi minuti o ore dopo le interazioni di monociti e macrofagi con il lipide A.
Il rilascio dei mediatori infiammatori diventa un processo auto-stimolante e il rilascio di altri mediatori simili, tra cui l’interleuchina (IL) -1, il fattore di attivazione delle piastrine, IL-2, IL-6, IL-8, IL-10 e ossido nitrico (NO), aumenta ulteriormente i livelli di citochine. Ciò porta alla continua attivazione di leucociti polimorfonucleati (PMN), macrofagi e linfociti; mediatori proinfiammatori reclutano più di queste cellule. Tutti questi processi creano uno stato di dissonanza immunologica distruttiva.
La sepsi è descritta come un processo autodistruttivo che consente l’estensione della normale risposta fisiopatologica all’infezione per coinvolgere tessuti e risultati altrimenti normali in MODS. La disfunzione d’organo o l’insufficienza d’organo può essere il primo segno clinico di sepsi e nessun sistema di organi è immune dalle conseguenze degli eccessi infiammatori della sepsi. La mortalità aumenta con l’aumentare dell’insufficienza d’organo.
Sebbene non controllata, una volta che il MODS si sviluppa, di solito sono presenti prove sistemiche di sovraregolazione sia proinfiammatoria che antinfiammatoria, suggerendo che il fallimento dell’omeostasi della difesa dell’ospite è il percorso finale dalla sepsi alla MODS, piuttosto che un semplice danno d’organo indotto dall’ipotensione, come può verificarsi con lo shock emorragico. La sopravvivenza da sepsi grave con MODS è solitamente associata a una riduzione generalizzata sia della risposta proinfiammatoria che antinfiammatoria.
Recentemente è emersa una nuova ipotesi che la sopravvivenza dalla sepsi grave richiede un down-regolazione generalizzata della risposta immunitaria del corpo, delle funzioni energetiche e delle prestazioni degli organi associati. Pertanto, MODS può dalla risposta adattativa dell’ospite a un’infiammazione travolgente, consentendo all’infiammazione di risolversi senza causare danni permanenti agli organi terminali. Come discusso di seguito, tutti gli organi rivelano un’iporesponsività generalizzata che è chiaramente anormale per la salute ma può segnare una strategia di sopravvivenza nella sepsi grave.
Disfunzione dei sistemi di organi
Disturbo circolatorio
Un significativo squilibrio nell’autoregolazione della circolazione è tipico della sepsi. I mediatori vasoattivi causano vasodilatazione e aumentano la permeabilità microvascolare nel sito di infezione. L’NO gioca un ruolo centrale nella vasodilatazione dello shock settico. Inoltre, può verificarsi una ridotta secrezione di vasopressina, che può consentire la persistenza della vasodilatazione.
Nella sepsi si verificano cambiamenti nella prestazione ventricolare sistolica e diastolica. Attraverso l’uso del meccanismo di Frank-Starling, la gittata cardiaca viene spesso aumentata per mantenere la pressione sanguigna in presenza di vasodilatazione sistemica. I pazienti con malattie cardiache preesistenti non sono in grado di aumentare la gittata cardiaca in modo appropriato.
A livello regionale, la sepsi interferisce con la normale distribuzione del flusso sanguigno sistemico ai sistemi degli organi. Di conseguenza, gli organi centrali potrebbero non ricevere l’appropriata erogazione di ossigeno e il risultato è la cosiddetta ipoperfusione regionale.
La microcircolazione è l’organo bersaglio chiave per le lesioni nella sepsi poiché l’endotelio vascolare è universalmente influenzato dai mediatori infiammatori circolanti. Sebbene non sia chiaro se le anomalie microcircolatorie siano la causa o un innocente spettatore del danno d’organo, si osserva una chiara disfunzione microvascolare. Si osserva una diminuzione del numero di capillari perfusi, sebbene con l’applicazione di terapie vasodilatatorie si verifichi un reclutamento microvascolare completo. Si verifica anche disfunzione mitocondriale ed è spesso associata a ridotti gradienti di potenziale transmembrana mitocondriale, che sono necessari per guidare la fosforilazione ossidativa. Il risultato finale è un’apparente incapacità degli organi terminali di estrarre l’ossigeno al massimo.
Continua il dibattito sul fatto che questo fallimento del metabolismo energetico sia un meccanismo citoprotettivo adattivo simile all’ibernazione o rifletta una patologia mitocondriale primaria. Queste sono aree di ricerca attiva ma attualmente non si traducono in chiare linee guida di pratica clinica. L’aumento della permeabilità endoteliale capillare porta a un diffuso edema tissutale ricco di proteine.
Shock settico e SIRS sono caratterizzati da depressione miocardica reversibile, che può dimostrarsi resistente alla catecolamina e alla somministrazione di liquidi. Il “fattore depressivo miocardico” circolante, che probabilmente rappresenta gli effetti sinergici di TNF-α, IL-1β, altre citochine e NO, è implicato nella patogenesi. Le due caratteristiche di questa depressione miocardica acuta da stress sono la ridotta reattività adrenergica e la disfunzione diastolica che porta a relativa resistenza alle catecolamine e cuori piccoli piuttosto che dilatati. L’ischemia miocardica macrovascolare e l’ipoperfusione sono improbabili contributori.
Nella sepsi grave e nello shock settico, la disfunzione microcircolatoria e la depressione mitocondriale causano sofferenza dei tessuti regionali, e quindi la disossia regionale persiste. Questa condizione è chiamata sindrome da distress microcircolatorio e mitocondriale (MMDS). La disfunzione autoregolatoria infiammatoria indotta da sepsi persiste e il fabbisogno di ossigeno non è compensato dalla fornitura, portando a MODS.
Ridistribuzione del volume del fluido intravascolare risultante da un ridotto tono vascolare arterioso, diminuito ritorno venoso dal flusso venoso e il rilascio di sostanze depressive del miocardio causa ipotensione.
Disfunzione polmonare
La lesione endoteliale nel sistema vascolare polmonare porta a disturbi flusso sanguigno capillare e maggiore permeabilità microvascolare, con conseguente edema interstiziale e alveolare. L’intrappolamento dei neutrofili all’interno del microcircolo polmonare avvia e amplifica il danno alle membrane dei capillari alveolari. Il danno polmonare acuto e la sindrome da distress respiratorio acuto (ARDS) sono manifestazioni frequenti di questi effetti. In effetti, la sepsi e la polmonite sono le cause più comuni di ARDS.
Disfunzione gastrointestinale
Il tratto gastrointestinale (GI) può aiutare a propagare la lesione della sepsi. La crescita eccessiva di batteri nel tratto gastrointestinale superiore può essere aspirata nei polmoni, producendo polmonite nosocomiale o da aspirazione. La normale funzione di barriera dell’intestino può essere compromessa, consentendo la traslocazione di batteri, endotossine e normali proteasi digestive nella circolazione sistemica ed estendendo la risposta settica.
Lo shock settico può causare ileo paralitico che può portare a un ritardo nell’istituzione della nutrizione enterale. Si ritiene che una produzione eccessiva di NO sia l’agente eziologico dell’ileo indotto dalla sepsi. Il livello ottimale di apporto nutrizionale viene ostacolato a fronte di un elevato fabbisogno proteico e calorico. Narcotici e miorilassanti possono peggiorare ulteriormente la motilità del tratto gastrointestinale.
Disfunzione epatica
Come conseguenza del ruolo svolto dal fegato nella difesa dell’ospite, le funzioni sintetiche anormali causate dalla disfunzione epatica possono contribuire sia all’inizio che alla progressione della sepsi. Il sistema reticoloendoteliale del fegato funge da prima linea di difesa nell’eliminazione dei batteri e dei loro prodotti; la disfunzione epatica porta a una ricaduta di questi prodotti nella circolazione sistemica.
L’insufficienza epatica (“fegato shockato”) può essere manifestata da aumenti degli enzimi epatici e della bilirubina, difetti della coagulazione e incapacità di espellere le tossine come l’ammoniaca, che porta a un peggioramento dell’encefalopatia.
Disfunzione renale
Lesione renale acuta (AKI) spesso accompagna la sepsi. Sono state segnalate diverse eziologie per AKI e la causa è tipicamente ritenuta multifattoriale. Il meccanismo di AKI è complesso ma probabilmente comporta una diminuzione del volume intravascolare effettivo risultante da ipotensione sistemica, vasocostrizione renale diretta, rilascio di citochine, e l’attivazione dei neutrofili da endotossine e altri peptidi, che contribuiscono al danno renale. Tuttavia, la maggior parte degli studi sugli animali mostra che il flusso sanguigno renale è aumentato, non diminuito, nella sepsi, sebbene associato a una funzione tubulare compromessa e alla mancanza di prove istologiche significative di tu lesione bulare.
Disfunzione del sistema nervoso centrale
Il coinvolgimento del sistema nervoso centrale (SNC) nella sepsi produce encefalopatia e periferica neuropatia. La patogenesi è scarsamente definita ma è probabilmente correlata all’ipotensione sistemica, che può portare a ipoperfusione cerebrale.
Coagulopatia
Coagulopatia subclinica, segnalata da un lieve aumento del tempo di trombina (TT) o tempo di tromboplastina parziale attivata (aPTT) o da una moderata riduzione del la conta piastrinica, è estremamente comune; tuttavia, può anche svilupparsi una coagulazione intravascolare disseminata (DIC). I recettori attivati dalla proteasi (PAR), in particolare PAR 1, formano il legame molecolare tra coagulazione e infiammazione; PAR1 esercita effetti citoprotettivi quando stimolato dalla proteina C attivata o dalla trombina a basso dosaggio, ma esercita effetti distruttivi sulla funzione di barriera delle cellule endoteliali quando attivato da trombina ad alte dosi.
Meccanismi di disfunzione e lesione d’organo
I meccanismi precisi del danno cellulare e della conseguente disfunzione d’organo nella sepsi non sono completamente compresi. La MODS è associata a una diffusa lesione delle cellule endoteliali e parenchimali, alcune delle quali possono essere spiegate dai seguenti 4 meccanismi proposti.
Ipossia ipossica
La lesione circolatoria settica interrompe l’ossigenazione dei tessuti, altera la regolazione metabolica dell’apporto di ossigeno ai tessuti e contribuisce alla disfunzione degli organi. Le anomalie microvascolari ed endoteliali contribuiscono al difetto microcircolatorio settico nella sepsi. Le specie reattive dell’ossigeno, gli enzimi litici e le sostanze vasoattive (p. Es., NO e fattori di crescita endoteliali) provocano danni microcircolatori, aggravati dall’incapacità degli eritrociti di navigare nel microcircolo settico.
Citotossicità diretta
Endotossina, TNF-α e NO possono causare danni al trasporto di elettroni mitocondriali, portando a un metabolismo energetico disordinato. Questa è chiamata anossia citopatica o istotossica, un’incapacità di utilizzare l’ossigeno anche quando è presente.
Apoptosi
Apoptosi ( morte cellulare programmata) è il meccanismo principale attraverso il quale le cellule disfunzionali vengono normalmente eliminate. Le citochine proinfiammatorie possono ritardare l’apoptosi nei macrofagi e nei neutrofili attivati, ma altri tessuti (p. Es., Epitelio intestinale) possono subire un’apoptosi accelerata. Pertanto, lo squilibrio dell’apoptosi gioca un ruolo critico nel danno tissutale della sepsi.
Immunosoppressione
L’interazione tra proinfiammatori e mediatori antinfiammatori possono portare a uno squilibrio tra di loro. Può predominare una reazione infiammatoria o un’immunodeficienza, oppure possono essere presenti entrambe.
Risposta dell’ospite e altri fattori che influenzano l’esito
Caratteristiche cliniche correlate alla gravità di sepsi includono la risposta dell’ospite all’infezione, il sito e il tipo di infezione, la tempistica e il tipo di terapia antimicrobica, l’organismo offensivo, lo sviluppo dello shock, la malattia sottostante, le condizioni di salute a lungo termine del paziente e il numero di organi. I fattori che portano alla sepsi e allo shock settico potrebbero non essere essenziali nel determinare il risultato finale.
La risposta dell’ospite alla sepsi è caratterizzata sia da risposte proinfiammatorie che da risposte immunosoppressive antinfiammatorie. La direzione, l’entità e la durata di queste reazioni sono determinate sia da fattori dell’ospite (p. Es., Caratteristiche genetiche, età, malattie coesistenti, farmaci) sia da fattori patogeni (p. Es., Carica microbica, virulenza).
Le risposte infiammatorie sono avviate dall’interazione tra i pattern molecolari associati ai patogeni espressi dai patogeni e i recettori di riconoscimento dei pattern espressi dalle cellule ospiti sulla superficie cellulare (recettori toll-like e C-type recettori della lectina), nell’endosoma (TLR) o nel citoplasma (recettori simili al gene 1 inducibili dall’acido retinoico e recettori simili al dominio di oligomerizzazione leganti i nucleotidi).
La conseguenza di un’infiammazione esagerata è il danno ai tessuti collaterali e la morte cellulare necrotica, che si traduce nel rilascio di modelli molecolari associati al danno, le cosiddette molecole di pericolo che perpetuano almeno l’infiammazione in parte agendo sugli stessi recettori di riconoscimento dei pattern attivati dai patogeni.