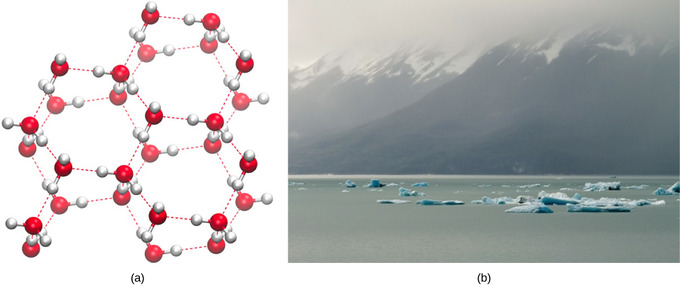
Staat van water: gas, vloeistof en vast
De vorming van waterstofbruggen is een belangrijke kwaliteit van vloeibaar water die cruciaal is voor het leven zoals we dat kennen. Omdat watermoleculen waterstofbruggen met elkaar maken, krijgt water een aantal unieke chemische eigenschappen in vergelijking met andere vloeistoffen, en aangezien levende wezens een hoog watergehalte hebben, is het begrijpen van deze chemische eigenschappen essentieel om het leven te begrijpen. In vloeibaar water worden constant waterstofbruggen gevormd en verbroken terwijl de watermoleculen langs elkaar glijden. Het verbreken van deze bindingen wordt veroorzaakt door de beweging (kinetische energie) van de watermoleculen als gevolg van de warmte in het systeem. Wanneer de warmte wordt verhoogd terwijl water wordt gekookt, zorgt de hogere kinetische energie van de watermoleculen ervoor dat de waterstofbruggen volledig breken en kunnen watermoleculen als gas (stoom of waterdamp) in de lucht ontsnappen. Aan de andere kant, wanneer de temperatuur van water wordt verlaagd en water bevriest, vormen de watermoleculen een kristallijne structuur die wordt gehandhaafd door waterstofbinding (er is niet genoeg energie om de waterstofbruggen te verbreken). Dit maakt ijs minder dicht dan vloeibaar water, een fenomeen dat je niet ziet bij het stollen van andere vloeistoffen.
Materiële fasen: kijk wat er gebeurt met intermoleculaire bindingen tijdens faseveranderingen in deze interactieve.
De lagere dichtheid van water in vaste vorm is te wijten aan de manier waarop waterstofbruggen georiënteerd zijn tijdens het bevriezen: de watermoleculen worden verder uit elkaar geduwd in vergelijking met vloeibaar water. Bij de meeste andere vloeistoffen omvat stolling wanneer de temperatuur daalt, de verlaging van de kinetische energie tussen moleculen, waardoor ze nog dichter dan in vloeibare vorm kunnen worden verpakt en de vaste stof een grotere dichtheid krijgt dan de vloeistof.
De lage dichtheid De dichtheid van ijs, een anomalie, zorgt ervoor dat het drijft op het oppervlak van vloeibaar water, zoals een ijsberg of de ijsblokjes in een glas water. In meren en vijvers vormt zich ijs op het wateroppervlak, waardoor een isolerende barrière ontstaat die de dieren en het plantenleven in de vijver tegen bevriezing beschermt. Zonder deze laag isolerend ijs zouden planten en dieren die in de vijver leven, bevriezen in het stevige blok ijs en niet kunnen overleven. Het nadelige effect van bevriezing op levende organismen wordt veroorzaakt door de uitzetting van ijs ten opzichte van vloeibaar water. De ijskristallen die zich bij bevriezing vormen, breken de delicate membranen die essentieel zijn voor het functioneren van levende cellen, waardoor ze onomkeerbaar worden beschadigd. Cellen kunnen het bevriezen alleen overleven als het water erin tijdelijk wordt vervangen door een andere vloeistof, zoals glycerol.