US Pharm. 2013; 38 (11) (Oncology suppl): 3-6.
SAMENVATTING: Anemie is een veel voorkomende complicatie bij patiënten met kanker. Het kan worden veroorzaakt door de tumor zelf of door het gebruikte chemotherapeutische regime. De ernst en prevalentie van de aandoening is afhankelijk van een aantal factoren. De behandeling is gericht op het vergroten van het zuurstoftransporterend vermogen van het bloed, het verminderen van vermoeidheid en het verbeteren van de algehele kwaliteit van leven van de patiënt. Erytropoëse-stimulerende middelen, ijzersuppletie en transfusies van rode bloedcellen zijn allemaal aanbevolen in verschillende omgevingen. Hoewel deze bij sommige patiënten gunstig zijn gebleken, moet de optimale therapeutische methode nog worden vastgesteld.
Anemie is een belangrijke oorzaak van morbiditeit bij patiënten met kanker, die verband houdt met slechte fysieke prestaties, prognose en therapeutisch resultaat.1 Volgens de World Health Organization ( WHO), wordt bloedarmoede gedefinieerd als een hemoglobinegehalte (Hb) van < 12 g / dL bij niet-zwangere vrouwen en < 13 g / dL bij mannen ≥15 jaar.2
Epidemiologie
Anemie is een van de meest voorkomende manifestaties bij patiënten met kanker. Het is zelfs aangetoond dat 30% tot 90% van alle kankerpatiënten bloedarmoede heeft, een cijfer dat afhankelijk is van het type kanker en de definitie van anemie die wordt gebruikt.3 De incidentie en ernst van de anemie zijn afhankelijk van een aantal factoren, die worden vermeld in TABEL 1.4,5

Etiologie
De belangrijkste oorzaak van bloedarmoede bij kankerpatiënten is tweeledig: de kanker zelf en de therapie die wordt gebruikt voor de behandeling van de kanker. Kankercellen die het beenmerg infiltreren, kunnen de hematopoëse direct onderdrukken en bloedarmoede veroorzaken. Bovendien geven de kankercellen cytokines af die kunnen leiden tot ijzeropslag, waardoor de productie van rode bloedcellen (RBC’s) wordt verminderd. Tumoren kunnen leiden tot chronisch bloedverlies van de tumorplaats, leidend tot progressieve anemie door de kanker en tot beschadiging van de organen.6
Dit probleem wordt verergerd door bloedverlies, voedingstekorten, hemolyse, endocriene aandoeningen, erfelijke ziekte, nierinsufficiëntie of de aanwezigheid van inflammatoire cytokines geassocieerd met kanker en chronische ziekten.4,6 Kankerpatiënten hebben de neiging hun eetlust te verliezen, wat leidt tot voedingstekorten. Bij patiënten met gastro-intestinale (GI) tumoren leidt malabsorptie van voedingsstoffen ook tot tekortkomingen. Hemolyse is het resultaat van immuungemedieerde antilichamen en hun stollingscapaciteit. Als gevolg hiervan is bloedarmoede een veel voorkomende comorbiditeit bij patiënten die onlangs met kanker zijn gediagnosticeerd. Bijna de helft van de patiënten bij wie gynaecologische kanker is vastgesteld en een derde van de patiënten bij wie non-Hodgkin-lymfoom is vastgesteld, heeft bij de diagnose bloedarmoede.
Bovendien is myelosuppressie een van de bijwerkingen van chemotherapie en een belangrijke factor die bijdraagt aan bloedarmoede. . Vooral radiotherapie van het skelet veroorzaakt ook hematologische toxiciteit en dus bloedarmoede.6
Symptomen
De meest voorkomende symptomen van bloedarmoede zijn vermoeidheid, kortademigheid bij inspanning, hartkloppingen, depressie, hartfalen, cognitieve stoornissen. functie, duizeligheid en hartfalen.7,8
Diagnose
De omvang van het probleem van anemie bij kankerpatiënten wordt versterkt door suboptimale diagnostische maatregelen, het ontbreken van een standaarddefinitie en de feit dat de oorzaak vaak multifactorieel is.6,9 Er moet een gedetailleerde geschiedenis worden opgenomen waarin de duur en de tijd tot het begin van de symptomen, de aanwezigheid van comorbide aandoeningen, de familiegeschiedenis en de geschiedenis van blootstelling aan antineoplastische geneesmiddelen en straling worden vastgelegd. Er moet een lichamelijk onderzoek worden uitgevoerd om te controleren op syncope, kortademigheid bij inspanning, hoofdpijn, duizeligheid, pijn op de borst, vermoeidheid, abnormale menstruatie bij vrouwen en palor.6
Het National Cancer Comprehensive Network beveelt aan om aCBC uit te voeren bij patiënten met een Hb < 11 g / dL of een vermindering van het aantal Hb met 2 g / dL. Dit is handig om te bepalen of cytopenieën aanwezig zijn. Een visuele beoordeling van het uitstrijkje van perifeer bloed om de grootte, vorm en kleur van de rode bloedcellen te bevestigen, wordt ook aanbevolen.6
Pathofysiologie
Anemie is het resultaat van een combinatie van verminderde circulerende erytrocyten , verminderd verpakt celvolume en verlaagde Hb-spiegels.6 Dit kan gebeuren door verschillende pathofysiologische mechanismen, waaronder overmatig bloedverlies, verhoogde vernietiging van rode bloedcellen en afname van de erytropoëse.
Erytropoëtine (EPO), vitamine B12, foliumzuur en ijzer is essentieel voor erytropoëse. Erytropoëtine regelt de verzadiging, differentiatie en overleving van erytroïde cellen tijdens dit proces.10 EPO wordt voornamelijk geproduceerd door de nieren en naar het beenmerg getransporteerd. ijzer dat beschikbaar is voor erythropoëse.Het veranderde metabolisme van ijzer wordt voornamelijk veroorzaakt door hepcidine, een eiwit dat zowel de opname van ijzer in de darmen als de afgifte van ijzer door de macrofagen vermindert. De aanmaak van hepcidine wordt verhoogd door cytokinen die vrijkomen uit tumoren, waardoor de hoeveelheid circulerend ijzer afneemt. Er is ook aangetoond dat de productie van cytokines zoals interleukine (IL) -6 wordt verhoogd door bepaalde chemotherapeutische behandelingen.5 Herhaalde chemotherapiecycli kunnen de afname van erytropoëse cumulatief verergeren.7
Aangezien de zuurstoftoevoer afneemt, de weefselcellen van het lichaam worden hypoxisch, wat resulteert in een reeks fysiologische reacties terwijl het lichaam probeert weefseloxygenatie te verkrijgen of te behouden.
Aangenomen wordt dat het normale gebruik van patiënten met ijzerincidentie kan worden onderbroken door een interactie tussen de tumorcellen en het eigen immuunsysteem van de gastheer. Deze interactie leidt tot de opwaartse regulatie van specifieke inflammatoire cytokinen zoals IL-1, gammainterferon en tumornecrosefactor alfa (TNF-α), die de differentiatie van erytroïde precursoren in het beenmerg verminderen, het normale ijzergebruik verstoren en normale hypoxie remmen. productie van erytropoëtine. Nefrotoxische chemotherapeutische middelen kunnen het probleem verergeren doordat ze nierinsufficiëntie veroorzaken.
Bij chronische anemie is aangetoond dat tumoren de ananemie-inducerende factor afgeven, een molecuul dat de levensduur van erytrocyten verkort. Dit verergert bloedarmoede tot het punt waarop erytropoëse de inferieure overleving van de rode bloedcellen niet kan compenseren.12
Risicofactoren voor bloedarmoede bij kanker
De volgende risicofactoren zijn vastgesteld voor bloedarmoede bij kanker9:
- Myelosuppressieve chemotherapie of bestralingstherapie
- Lage Hb-waarden (10-12 g / dL) bij aanvang van cytotoxische chemotherapie
- Toediening van platina- behandelingsschema’s, waardoor ook de behoefte aan transfusieondersteuning toeneemt.
Behandeling
Afgezien van een algehele verbetering van de kwaliteit van leven van de patiënt, is behandeling van anemie essentieel voor een aantal Anemia belemmert de levering van voldoende hoeveelheden zuurstof aan alle cellen, inclusief tumorcellen.7 Aangezien lage weefseloxygenatie gepaard gaat met een verminderde gevoeligheid van tumoren voor straling en andere vormen van chemotherapie, is de werkzaamheid van deze behandelingen bij anemie verminderd.13,14
Het doel van de therapie zou moeten zijn om het zuurstofgehalte te verhogen bloedcapaciteit en behandeling van de onderliggende oorzaak. onderliggende aandoeningen zoals voedingstekorten zijn gemakkelijker te behandelen dan andere, zoals occult bloedverlies. Er zijn verschillende opties beschikbaar voor de behandeling van kankerpatiënten met anemie. Deze omvatten15:
- Passende aanvullende therapie met foliumzuur en / of vitamine B12 om voedingstekorten te corrigeren
- Erytropoëse-stimulerende middelen (ESA’s)
- IJzersuppletie
- Bloedtransfusies, die zijn geïndiceerd voor patiënten met acuut ernstig bloedverlies. Voor patiënten met chronische anemie hebben erytropoëtische middelen de voorkeur.
Erytropoëse-stimulerende middelen: ESA’s, waaronder recombinant humaan erytropoëtine alfa (rHuEPO; Procrit, Epogen) en darbepoëtine alfa (Aranesp), werden traditioneel ontwikkeld voor de behandeling van anemie bij patiënten met chronisch nierfalen. Ze hebben vergelijkbare werkzaamheid en beperkingen aangetoond bij gebruik van onvergelijkbare doses bij kankerpatiënten met anemie.5 ESA’s zijn geïndiceerd voor de behandeling van patiënten bij wie de endogene EPO-waarden normaal laag zijn, aangezien het ESA-werkingsmechanisme en de immunologische en hematologische effecten vergelijkbaar zijn met die van endogene EPO.9 uitgevoerd op rHuEPO hebben aangetoond dat het de Hbl-niveaus en kwaliteit van leven van patiënten verbetert en de transfusievereisten verlaagt.15,16 Er is voorgesteld dat ESA’s ook de cognitieve functie verbeteren van patiënten die chemotherapie krijgen.17
Een systemische review uitgevoerd door de American Cancer Society toonde aan dat een optimaal klinisch voordeel van erytropoëtische behandeling van door chemotherapie geïnduceerde anemie kan worden bereikt door vroegtijdige interventie.18 Het gebruik van ESA’s heeft duidelijk een voordeel; alle andere oorzaken van anemie moeten echter worden onderzocht en gecorrigeerd voordat ESA-therapie wordt gebruikt.
Darbepoëtine en rHuEPO zijn beide geïndiceerd voor de behandeling van anemie bij patiënten met niet-myeloïde maligniteiten bij wie manemie verband houdt met chemotherapie.5 De American Society of Hematology (ASH) en de American Society of Clinical Oncology (ASCO) bevelen aan om met de behandeling te beginnen wanneer het Hb-gehalte onder 10 g / dl daalt en de dosering te verlagen als er een minimale stijging van 1 g / dl in Hbl-niveaus is met 2 weken.19 Het doel van de therapie is om het Hb tot de laagste concentratie te brengen om transfusie te voorkomen. Als de minimale toename van 1 tot 2 g / dl Hb na 6 tot 8 weken behandeling niet wordt bereikt, moet de ESA-therapie worden stopgezet.18 Hoewel het moeilijk is om met de huidige gegevens de respons van de patiënt op deze therapieën te voorspellen, is aangetoond dat ongeveer 50% tot 60% van de patiënten een toename van 2 g / dl in Hb vertoont wanneer ze worden behandeld met rHuEPO.9. ESA-therapie moet worden stopgezet na voltooiing van chemotherapie.20,21
De aanbevolen dosering voor darbepoetin alfa is 2,25 mcg / kg als wekelijkse subcutane (SC) injectie. Als de Hb-waarden na 6 weken niet met minstens 1 g / dl stijgen, moet de dosering worden verhoogd tot 4,5 mcg / kg. Als de Hb-spiegels met meer dan 1 g / dl stijgen in een periode van 2 weken of als Hb 12 g / dl overschrijdt, moet de dosering van darbepoëtine met 40% worden verlaagd. 20 Darbepoëtine moet worden gestopt als de Hb-spiegels boven 13 g / dl stijgen. 9
De aanbevolen dosering van rHuEPO is 40.000 E SC eenmaal per week toegediend of 150 E / kg SC driemaal per week toegediend bij patiënten met een Hb-spiegel van minder dan 10 g / dL. De dosering van rHuEPO moet met 25% worden verlaagd als het Hb-gehalte > 1 g / dL in een periode van 2 weken stijgt of een niveau bereikt dat nodig is om RBC-transfusie te voorkomen.21
ESA’s zijn verpakt in een injectieflacon die niet mag worden geschud, aangezien ze denatureren.20,21 De inhoud van de injectieflacon mag niet worden verdund of samengevoegd.
De risico’s van ESA-therapie moeten ook zijn in overweging genomen. ESA’s worden verondersteld ongunstige cardiovasculaire gebeurtenissen te verhogen, het risico op veneuze trombo-embolie te vergroten, de tijd tot tumorprogressie te verkorten en de overleving bij anemische kankerpatiënten te verminderen via verschillende mechanismen.22,23 Om deze reden wordt het gebruik van ESA’s ontmoedigd bij kankerpatiënten die geen behandeling met chemotherapie of radiotherapie.24 Alle ESA’s worden geleverd met een blackbox-waarschuwing over het verhogen van het risico op overlijden, myocardinfarct, beroerte, veneuze trombo-embolie, trombose van vasculaire toegang en tumorprogressie en recidief.20,21 Het ESA APPRISE OncologyProgramma is opgezet door de FDA om patiënten, zorgverleners en beroepsbeoefenaren in de gezondheidszorg te adviseren over het veilige gebruik van ESA’s.25
IJzersuppletie: ijzersuppletie, bij voorkeur parenteraal, is geïndiceerd bij patiënten met een laag offerritinegehalte (< 30 ng / ml), transferrineverzadiging (TSAT < 15%) en laag (< 26 pg / cel ) reticulocyt Hb inhoud t (CHr). Bij anemische kankerpatiënten zijn twee soorten ijzerstoornis vastgesteld:
- Absoluut ijzertekort (AID) dat optreedt bij chronische bloeding als gevolg van bijvoorbeeld GI of gynaecologische laesies, bloedverlies door een operatie, tekorten en anemie van chronische ziekte (ACD). Het wordt gedefinieerd als een serum-ferritinegehalte van < 30 mcg / L en een verlaagde TSAT van < 15% .1
- Functioneel ijzertekort (FID) dat ontstaat na voortgezet gebruik van erytropoëtine. Het is de meest voorkomende oorzaak van een inadequate respons op ESA-therapie, vooral bij patiënten met nierfalen. Daarom zullen de meeste patiënten die ESA-therapie ondergaan uiteindelijk ijzersuppletie nodig hebben.6
IJzersuppletie werd geïntroduceerd toen ESA-therapie alleen een slechte respons vertoonde bij patiënten die met chemotherapie werden behandeld.1 De werkzaamheid van een combinatie van IV ijzer- en ESA-therapie werd getest en de rol van ijzer bij functionele ijzertekort werd vastgesteld.1 Hoewel huidig bewijs het gebruik van intraveneuze ijzersuppletie ondersteunt om de hemoglobinerespons bij anemische patiënten met kanker te verbeteren, zijn prospectieve onderzoeken naar de werkzaamheid en veiligheid van intraveneus ijzer nodig. .Bovendien moeten optimale doseringsregimes worden vastgesteld.5
IJzer kan oraal worden toegediend of als parenterale formuleringen van ijzerdextraan met laag molecuulgewicht (LMW), ferricgluconaat en ijzersucrose. Parenteraal toegediend ijzer heeft een superieure respons in vergelijking met oraal ijzer.6 Dit laatste wordt daarom zelden gebruikt bij kankerpatiënten met anemie en wordt in dit artikel niet besproken. Testdoses worden aanbevolen voor ijzerdextraan. Patiënten die eerder gevoeligheden hebben vertoond voor ijzerdextraan of andere intraveneuze ijzerpreparaten of patiënten met meerdere geneesmiddelenallergieën, moeten ook een testdosis krijgen. TABEL 2 toont het doseringsregime voor IV-ijzersuppletie.6
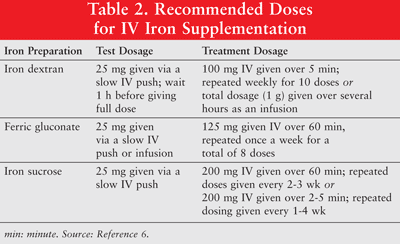
Parenteraal ijzer wordt in verband gebracht met hypotensie, misselijkheid, braken en / of diarree, pijn, hypertensie, dyspnoe, pruritus, hoofdpijn en duizeligheid. Bovendien kan het ongemakkelijk zijn om toe te dienen en kan het kostbaar zijn.9 Aangezien ijzerdextran met een hoog molecuulgewicht (HMW) in verband wordt gebracht met een hogere incidentie van bijwerkingen dan LMW-ijzerdextran, heeft dit laatste in het algemeen de voorkeur.6
Rood Bloedceltransfusie: RBC’s zijn het bloedproduct bij voorkeur voor transfusies om anemie te corrigeren in gevallen van acute anemie na bloeding. Bij bepaalde patiënten kan een infusie nodig zijn die cytomegalovirus-negatief is.Het doel van het gebruik van een RBC-transfusie is het behandelen of voorkomen van een tekort aan het zuurstofdragend vermogen van het bloed, en transfusie is meestal niet geïndiceerd als het H-niveau van de patiënt ≥ 10 g / dL is.6
RBC-transfusies bieden het voordeel van een snelle toename van Hb- en hematocrietwaarden onmiddellijk na infusie. Geschat wordt dat een transfusie van 300 ml (1 eenheid) zuivere rode bloedcellen zal resulteren in een gemiddelde toename van 1 g / dl Hb of 3% hematocriet bij een andere volwassen normale volwassene die geen gelijktijdig bloedverlies ervaart. Dit leidt tot een algehele snelle verbetering van vermoeidheid.6
Het bloed van de patiënt moet worden vergeleken op ABO-compatibiliteit voordat de rode bloedcellen kunnen worden getransfundeerd. Als de patiënt herhaalde infusies nodig heeft, kan het risico op bijwerkingen worden geminimaliseerd door het gebruik van leukocytenreducerend bloed en premedicatie met anantihistamine of paracetamol.6
RBC-transfusie is niet zonder risico’s, inclusief de kans op transfusie-overdraagbare infectieziekten. middelen, transfusiereacties, alloimmunisatie en immunosuppressie.9 Andere risico’s van transfusie zijn onder meer congestief hartfalen, verhoogde trombotische voorvallen en ijzerstapeling.6 Het is echter nuttig op te merken dat patiënten die RBC-infusies nodig hebben tijdens de periode die overeenkomt met alleen chemotherapiebehandeling hoogst onwaarschijnlijk zijn. ervaren ijzerstapeling.6
Toekomstperspectieven
Nieuwe strategieën voor het beheersen van bloedarmoede bij kankerpatiënten worden momenteel nagestreefd. Hoewel er geen vervanging is voor menselijk bloed, zijn onderzoekers bezig met de ontwikkeling van producten die het zuurstoftransporterend vermogen van rode bloedcellen hebben. In de pijplijn zitten op Hb gebaseerde zuurstofdragers en perfluorkoolwaterstoffen.5
Conclusie
Al met al moet de optimale benadering van anemie als een belangrijk probleem in de oncologie nog worden vastgesteld. Gebrek aan consistentie tussen zorgverleners, een duidelijke definitie van bloedarmoede bij kanker en diagnosecriteria dragen allemaal bij aan dit probleem.
1. Steinmetz HT. De rol van intraveneus ijzer bij de behandeling van bloedarmoede bij kankerpatiënten. Ther Adv Hematol. 2012; 3: 177-191.
2. deBenoist B, McLean E, Egli I, et al. Wereldwijde prevalentie van anemie 1993-2005: WHO Global Database on Anemia. Genève, Zwitserland: Wereldgezondheidsorganisatie; 2008.
3. Knight K, Wade S, Balducci L. Prevalentie en uitkomsten van bloedarmoede bij kanker: een systematische review van de literatuur. Ben J Med. 2004; 116 (suppl 7A): 11S-26S.
4. Schwartz RN. Bloedarmoede bij patiënten met kanker: incidentie, oorzaken, impact, beheer en gebruik van behandelrichtlijnen en protocollen. Ben J Health Syst Pharm. 2007; 64 (3 suppl 2): S5-S13; quiz S28-S30.
5. Calabrich A, Katz A. Beheer van bloedarmoede bij kankerpatiënten. Toekomstige Oncol. 2011; 7: 507-517.
6. Rodgers GM, Becker P, Blinder M, et al. Door kanker en chemotherapie geïnduceerde bloedarmoede. J Natl Compr Canc Netw. 2012; 10: 628-653.
7. Groopman JE, Itri LM. Door chemotherapie geïnduceerde anemie bij volwassenen: incidentie en behandeling. J Natl Cancer Inst. 1999; 91: 1616-1634.
8. Ludwig H, Strasser K. Symptomatologie van bloedarmoede. Semin Oncol. 2001; 28: 7-14.
9. Gillespie TW. Bloedarmoede bij kanker. Cancer Nursing. 2003; 26: 119-128.
10. Koeller JM. Klinische richtlijnen voor de behandeling van aan kanker gerelateerde anemie. Farmacotherapie. 1998; 18: 156-169.
11. Cazzola M, Mercuriali F, Brugnara C. Gebruik van recombinant menselijk erytropoëtine buiten de setting van uremie. Bloed. 1997; 89: 424-867.
12. Nowrousian MR, Kasper C, Oberhoff C, et al. Pathofysiologie van kankergerelateerde bloedarmoede. In: Smith JF, Boogaerts MA, Ehmer B, eds. Erytropoëtine bij kankerondersteunende behandeling. New York, NY: Marcel Dekker; 1997: 13-34.
13. Vaupel P, Dunst J, Engert A, et al. Effecten van recombinant humaan erytropoëtine (rHuEPO) op tumorcontrole bij patiënten met door kanker geïnduceerde anemie. Onkologie. 2005; 28: 216-221.
14. Zhao KL, Liu G, Jiang GL, et al. Associatie van hemoglobinegehalte met morbiditeit en mortaliteit van patiënten met lokaal gevorderd slokdarmcarcinoom die radiotherapie ondergaan – een secundaire analyse van drie opeenvolgende klinische fase III-onderzoeken. Clin Oncol (R Coll Radiol). 2006; 18: 621-627.
15. Glaspy JA. De ontwikkeling van erytropoëtische middelen in de oncologie. Deskundig advies Emerg Drugs. 2005; 10: 553-567.
16. Adamson JW, Spivak JL. Fysiologische basis voor het farmacologische gebruik van recombinant humaan erytropoëtine bij chirurgie en behandeling van kanker. Chirurgie. 1994; 115: 7-15.
17. Ferrario E, Ferrari L, Bidoli P, et al. Behandeling van kankergerelateerde anemie met epoëtine alfa: een overzicht. Cancer Treat Rev. 2004; 30: 563-575.
18. Lyman GH, Glaspy J. Zijn er klinische voordelen met een vroegtijdige erytropoëtische interventie voor door chemotherapie geïnduceerde anemie? Een systematische review. Kanker. 2006; 106: 223-233.
19. Rizzo JD, Brouwers M, Hurley P, et al. AmericanSociety of Clinical Oncology / American Society of Hematology update richtlijn klinische praktijk over het gebruik van epoëtine en darbepoëtine bij volwassen patiënten met kanker. J Clin Oncol. 2010; 28: 4996-5010.
20. Aranesp (darbepoetin alfa) voorschrijfinformatie.Thousand Oaks, Californië: Amgen Inc; Mei 2012.
21. Procrit (epoëtine alfa) voorschrijfinformatie. Horsham, PA: Janssen Products, LP; Juli 2012.
22. Beutel G, Ganser A.Risico’s en voordelen van erytropoëse-stimulerende middelen bij het beheer van kanker. Semin Hematol. 2007; 44: 157-165.
23. Fenner MH, Ganser A. Erytropoëtine bij kankergerelateerde bloedarmoede. Curr Opin Oncol. 2008; 20: 685-689.
24. Smith RE Jr, Aapro MS, Ludwig H, et al. Darbepoetinalfa voor de behandeling van anemie bij patiënten met actieve kanker die geen chemotherapie of radiotherapie krijgen: resultaten van een fase III, multicenter, gerandomiseerd, dubbelblind, placebogecontroleerd onderzoek. J Clin Oncol. 2008; 26: 1040-1050.
25. ESA APPRISE Oncologieprogramma. Amgen en Janssen Products, LP. www.esa-apprise.com. Toegang tot 13 oktober 2013.