Dampdrukverlaging
Zoals beschreven in het hoofdstuk over vloeistoffen en vaste stoffen, is de evenwichtsdampdruk van een vloeistof de druk die wordt uitgeoefend door de gasvormige fase waarin verdamping en condensatie met gelijke snelheid optreden:
\ text {liquid} \ rightleftharpoons \ text {gas}
Een niet-vluchtige stof oplossen in een vluchtige vloeistof resulteert in een verlaging van de dampspanning van de vloeistof. Dit fenomeen kan worden gerationaliseerd door rekening te houden met het effect van toegevoegde opgeloste moleculen op de verdampings- en condensatieprocessen van de vloeistof. Om te verdampen, moeten oplosmiddelmoleculen aanwezig zijn aan het oppervlak van de oplossing. De aanwezigheid van opgeloste stof verkleint het oppervlak dat beschikbaar is voor oplosmiddelmoleculen en vermindert daardoor de snelheid van oplosmiddelverdamping. Omdat de condensatiesnelheid niet wordt beïnvloed door de aanwezigheid van opgeloste stof, is het netto resultaat dat het verdamping-condensatie-evenwicht wordt bereikt met minder oplosmiddelmoleculen in de dampfase (d.w.z. bij een lagere dampdruk) (Figuur 1). Hoewel deze kinetische interpretatie nuttig is, houdt ze geen rekening met verschillende belangrijke aspecten van de colligatieve aard van dampdrukverlaging. Een meer rigoureuze uitleg betreft de eigenschap van entropie, een onderwerp van discussie in een later hoofdstuk over thermodynamica. Om de verlaging van de dampspanning van een vloeistof te begrijpen, is het voldoende op te merken dat de grotere entropie van een oplossing in vergelijking met het afzonderlijke oplosmiddel en de opgeloste stof dient om de oplosmiddelmoleculen effectief te stabiliseren en hun verdamping te belemmeren. Het resultaat is een lagere dampspanning en een overeenkomstig hoger kookpunt, zoals beschreven in de volgende sectie van deze module.
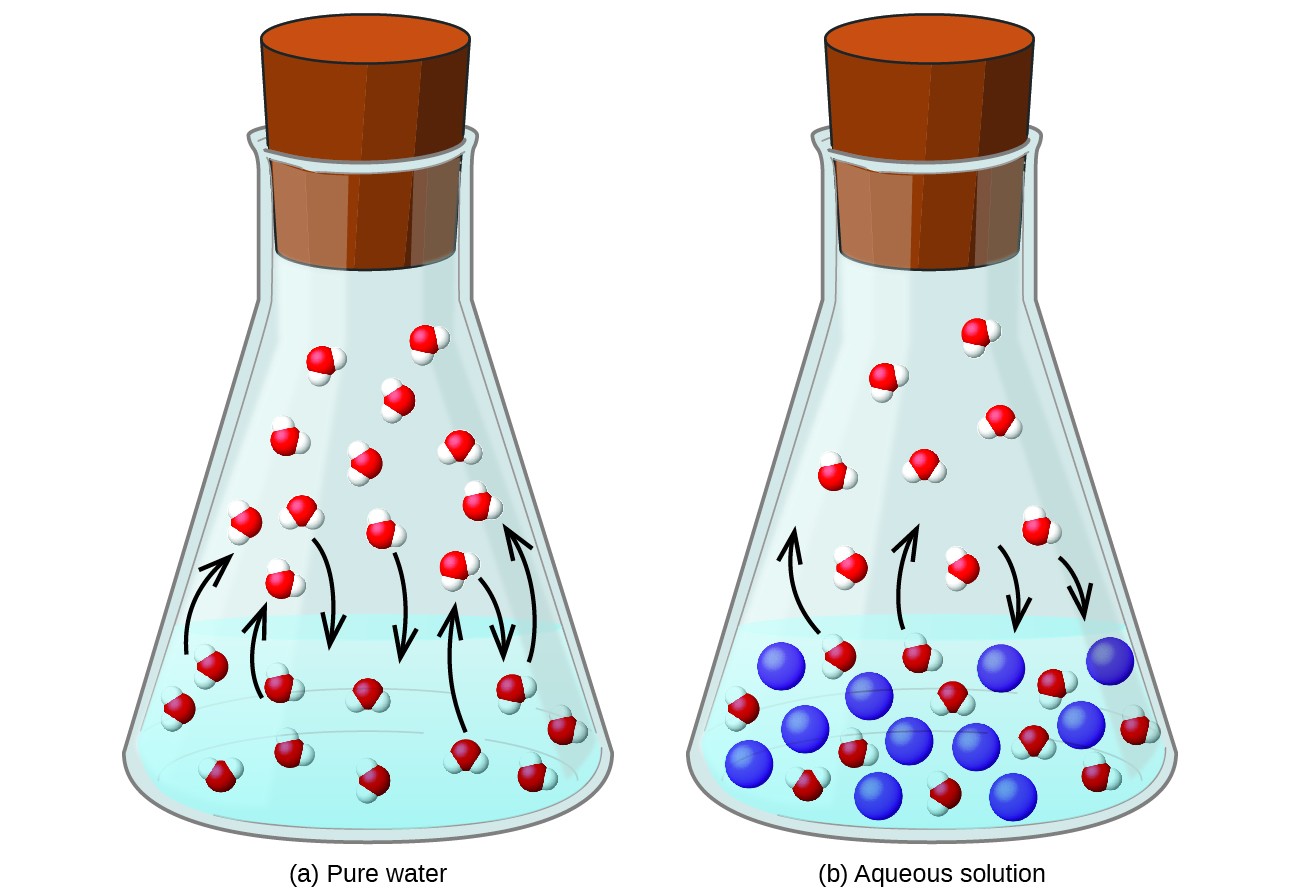
Figuur 1. De aanwezigheid van niet-vluchtige opgeloste stoffen verlaagt de dampspanning van een oplossing door de verdamping van oplosmiddelmoleculen te belemmeren.
De relatie tussen de dampdrukken van oplossingscomponenten en de concentraties van die componenten worden beschreven door de wet van Raoult: de partiële druk die wordt uitgeoefend door een component van een ideale oplossing is gelijk aan de dampspanning van de zuivere component vermenigvuldigd met de molfractie in de oplossing.
{P} _ {\ text {A}} = {X} _ {\ text {A}} {P} _ {\ text {A}} ^ {\ star}
Eraan herinnerend dat de totale druk van een gasvormig mengsel gelijk is aan de som van de partiële drukken voor al zijn componenten (wet van Dalton van partiële drukken), is de totale dampdruk uitgeoefend door een oplossing die i componenten bevat
{ P} _ {\ text {solution}} = \ sum _ {i} {P} _ {i} = \ sum _ {i} {X} _ {i} {P} _ {i} ^ {\ star}
Een niet-vluchtige stof is een stof waarvan de dampspanning verwaarloosbaar is (P ^ {\ star} ≈ 0), en dus is de dampspanning boven een oplossing die alleen niet-vluchtige opgeloste stoffen bevat alleen te wijten aan het oplosmiddel:
{P} _ {\ text {solution}} = {X} _ {\ text {solvent}} {P} _ {\ text {solvent}} ^ {\ star}
Destillatie van oplossingen
Destillatie is een techniek voor het scheiden van de componenten van mengsels die zowel in het laboratorium als in industriële omgevingen veel wordt toegepast. Het wordt gebruikt om aardolie te raffineren, fermentatieproducten te isoleren en om water te zuiveren. Deze scheidingstechniek omvat de gecontroleerde verwarming van een monstermengsel om selectief een of meer van belang zijnde componenten te verdampen, condenseren en te verzamelen. Een typisch apparaat voor destillaties op laboratoriumschaal wordt getoond in figuur 2.

Figuur 2. Een typische laboratoriumdestillatie-eenheid wordt getoond in (a) een foto en (b) een schematisch diagram van de componenten. (credit a: wijziging van werk door “Rifleman82” / Wikimedia commons; credit b: wijziging van werk door “Slashme” / Wikipedia)
Olieraffinaderijen gebruiken grootschalige fractionele destillatie om de componenten van ruwe olie. De ruwe olie wordt verwarmd tot hoge temperaturen aan de basis van een hoge fractioneringskolom, waardoor veel van de componenten die in de kolom opstijgen verdampen. Omdat verdampte componenten tijdens hun opstijging voldoende koele zones bereiken, condenseren ze en worden ze verzameld. De opgevangen vloeistoffen zijn eenvoudigere mengsels van koolwaterstoffen en andere petroleumverbindingen die een geschikte samenstelling hebben voor verschillende toepassingen (bijv. Dieselbrandstof, kerosine, benzine), zoals weergegeven in figuur 3.

Figuur 3. Ruwe olie is een complex mengsel dat wordt gescheiden door grootschalige gefractioneerde destillatie om verschillende eenvoudigere mengsels te isoleren.
Kookpuntverhoging
Zoals beschreven in het hoofdstuk over vloeistoffen en vaste stoffen, is het kookpunt van een vloeistof de temperatuur waarbij de dampspanning gelijk is aan de atmosferische omgevingsdruk.Omdat de dampspanning van een oplossing wordt verlaagd door de aanwezigheid van niet-vluchtige opgeloste stoffen, is het logisch dat het kookpunt van de oplossing vervolgens zal worden verhoogd. In vergelijking met puur oplosmiddel heeft een oplossing daarom een hogere temperatuur nodig om een bepaalde dampspanning te bereiken, inclusief een die equivalent is aan die van de omringende atmosfeer. De toename van het kookpunt die wordt waargenomen wanneer niet-vluchtige opgeloste stof wordt opgelost in een oplosmiddel, ΔTb, wordt kookpuntverhoging genoemd en is rechtevenredig met de molaire concentratie van opgeloste stoffen:
\ Delta {T} _ {\ text {b}} = {K} _ {\ text {b}} m
waarbij Kb de kookpunt-elevatieconstante is, of de ebullioscopische constante en m de molaire concentratie (molaliteit) van alle opgeloste stoffen.
Kookpuntverhogingsconstanten zijn karakteristieke eigenschappen die afhangen van de identiteit van het oplosmiddel. De waarden van Kb voor verschillende oplosmiddelen staan vermeld in tabel 1.
De mate waarin de dampspanning van een oplosmiddel wordt verlaagd en het kookpunt wordt verhoogd, hangt af van het totale aantal opgeloste deeltjes dat in een bepaalde hoeveelheid aanwezig is oplosmiddel, niet op de massa of grootte of chemische identiteiten van de deeltjes. Een 1 m waterige oplossing van sucrose (342 g / mol) en een 1 m waterige oplossing van ethyleenglycol (62 g / mol) zullen hetzelfde kookpunt vertonen omdat elke oplossing één mol opgeloste deeltjes (moleculen) per kilogram oplosmiddel heeft .
Voorbeeld 6: het kookpunt van een jodiumoplossing
Vind het kookpunt van een oplossing van 92,1 g jodium, I2, in 800,0 g chloroform, CHCl3 , ervan uitgaande dat het jodium niet-vluchtig is en dat de oplossing ideaal is.
Check Your Learning
Wat is het kookpunt van een oplossing van 1,0 g glycerine, C3H5 (OH) 3, in 47,8 g water? Ga uit van een ideale oplossing.
Vriespuntdepressie

Figuur 4. Steenzout ( NaCl), calciumchloride (CaCl2) of een mengsel van beide worden gebruikt om ijs te smelten. (tegoed: wijziging van werk door Eddie Welker)
Oplossingen bevriezen bij lagere temperaturen dan zuivere vloeistoffen. Dit fenomeen wordt benut in “de-icing” -programma’s waarbij zout (Figuur 4), calciumchloride of ureum wordt gebruikt om ijs op wegen en trottoirs te smelten, en bij het gebruik van ethyleenglycol als “antivries” in autoradiatoren. Zeewater bevriest bij een lagere temperatuur dan zoet water, en dus blijven de Arctische en Antarctische oceanen zelfs bij temperaturen onder 0 ° C onbevroren (net als de lichaamsvloeistoffen van vissen en andere koudbloedige zeedieren die in deze oceanen leven).
De daling van het vriespunt van een verdunde oplossing vergeleken met die van het zuivere oplosmiddel, ΔTf, wordt de vriespuntverlaging genoemd en is recht evenredig met de molale concentratie van de opgeloste stof.
\ Delta {T} _ {\ text {f}} = {K} _ {\ text {f}} m
waarbij m de molale concentratie is van de opgeloste stof in het oplosmiddel en Kf wordt de vriespuntverlagingsconstante (of cryoscopische constante) genoemd. Net als bij kookpuntverhogingsconstanten zijn dit karakteristieke eigenschappen waarvan de waarden afhangen van de chemische identiteit van het oplosmiddel. De waarden van Kf voor verschillende oplosmiddelen staan vermeld in tabel 1.
Colligatieve eigenschappen en ontdooifunctie
Natriumchloride en zijn groep 2 analogen calcium en magnesiumchloride worden vaak gebruikt om het ontdooien van wegen en trottoirs, omdat een oplossing van een van deze zouten een vriespunt heeft lager dan 0 ° C, het vriespunt van zuiver water. De metaalzouten van groep 2 worden vaak gemengd met het goedkopere en beter verkrijgbare natriumchloride (“steenzout”) voor gebruik op wegen, aangezien ze de neiging hebben iets minder corrosief te zijn dan de NaCl, en ze zorgen voor een grotere verlaging van het vriespunt. , aangezien ze dissociëren om drie deeltjes per formule-eenheid op te leveren, in plaats van twee deeltjes zoals natriumchloride.
Omdat deze ionische verbindingen de corrosie van metaal versnellen, zouden ze geen verstandige keuze zijn om te gebruiken in antivries voor de radiator in uw auto of om een vliegtuig te ontdooien voordat u vertrekt.Voor deze toepassingen worden vaak covalente verbindingen, zoals ethyleen- of propyleenglycol, gebruikt. De glycolen die in radiatorvloeistof worden gebruikt, verlagen niet alleen het vriespunt van de vloeistof, maar ze verhogen ook het kookpunt, waardoor de vloeistof zowel in de winter als in de zomer bruikbaar is. Verwarmde glycolen worden vaak vóór het opstijgen bij slecht weer in de winter op het oppervlak van vliegtuigen gesproeid om reeds gevormd ijs te verwijderen en de vorming van meer ijs te voorkomen, wat vooral gevaarlijk zou zijn als het zich op de stuurvlakken van het vliegtuig zou vormen (Figuur 5).

Figuur 5. Vriespuntverlaging wordt benut om ijs van (a) wegen te verwijderen en (b) de stuurvlakken van vliegtuigen.
Fasediagram voor een oplossing
De colligatieve effecten op dampspanning, kookpunt en vriespunt beschreven in de vorige sectie worden overzichtelijk samengevat door de fasediagrammen voor een zuivere vloeistof en een oplossing afgeleid van die vloeistof te vergelijken. Fasediagrammen voor water en een waterige oplossing worden getoond in Figuur 6.
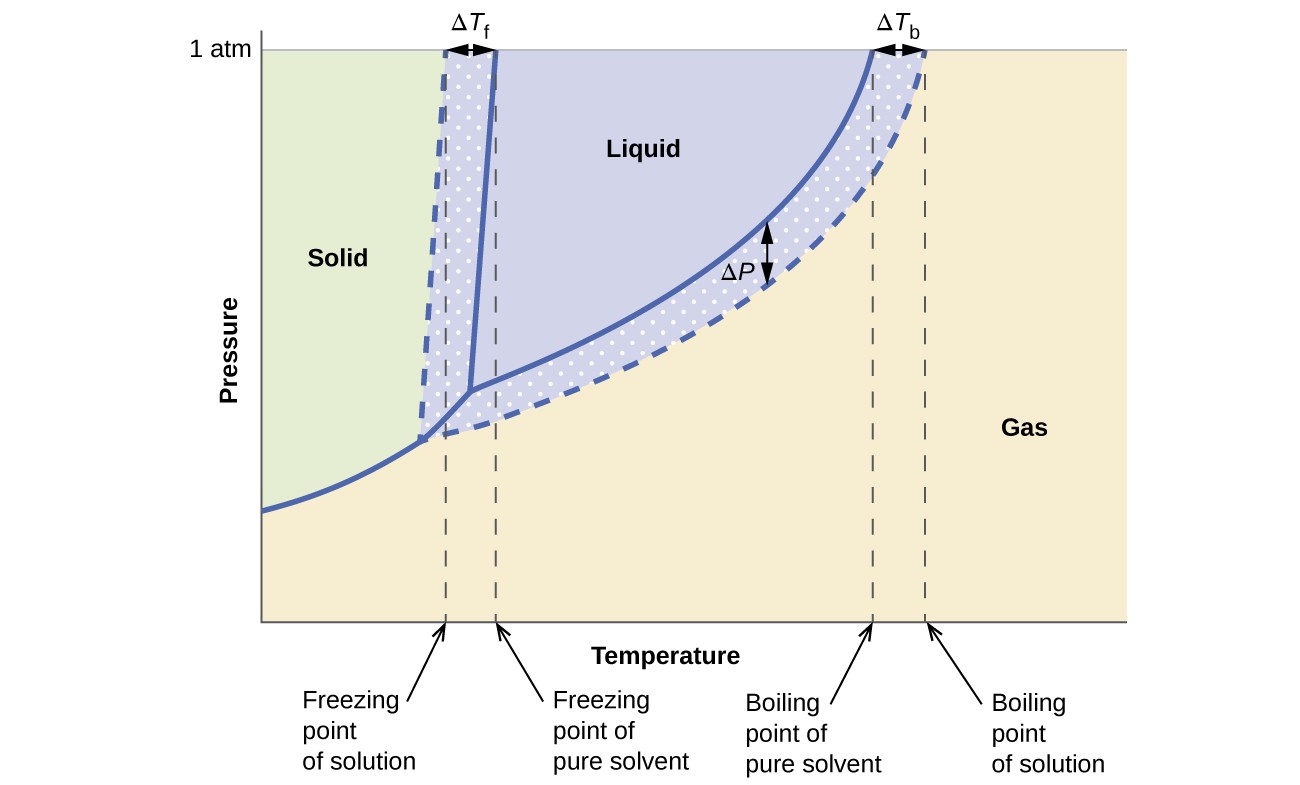
Figuur 6. Deze fasen diagrammen tonen water (doorgetrokken curven) en een waterige oplossing van niet-elektrolyt (onderbroken curven).
De vloeistof-dampcurve voor de oplossing bevindt zich onder de overeenkomstige curve voor het oplosmiddel en geeft de damp weer drukverlaging, ΔP, die het gevolg is van het oplossen van niet-vluchtige opgeloste stof. Bijgevolg wordt bij elke gegeven druk het kookpunt van de oplossing waargenomen bij een hogere temperatuur dan dat van het zuivere oplosmiddel, wat de kookpuntverhoging, ΔTb, weerspiegelt die verband houdt met de aanwezigheid van niet-vluchtige opgeloste stof. De vast-vloeistofcurve voor de oplossing wordt links van die voor het zuivere oplosmiddel verplaatst, wat de vriespuntverlaging, ΔTb, vertegenwoordigt die gepaard gaat met de vorming van de oplossing. Merk ten slotte op dat de vaste-gas-curven voor het oplosmiddel en zijn oplossing identiek zijn. Dit is het geval voor veel oplossingen die vloeibare oplosmiddelen en niet-vluchtige opgeloste stoffen bevatten. Net als bij verdamping, wanneer een oplossing van deze soort wordt bevroren, zijn het eigenlijk alleen de oplosmiddelmoleculen die de overgang van vloeistof naar vaste stof ondergaan, waarbij ze een puur vast oplosmiddel vormen dat opgeloste stoffen uitsluit. De vaste en gasvormige fasen zijn daarom alleen samengesteld uit oplosmiddelen en daarom zijn overgangen tussen deze fasen niet onderhevig aan colligatieve effecten.
Osmose en osmotische druk van oplossingen
Een aantal natuurlijke en synthetische materialen vertonen selectieve permeatie, wat betekent dat alleen moleculen of ionen van een bepaalde grootte, vorm, polariteit, lading, enzovoort, door het materiaal kunnen (permeëren). Biologische celmembranen zijn elegante voorbeelden van selectieve permeatie in de natuur, terwijl dialysebuizen die worden gebruikt om metabolisch afval uit bloed te verwijderen, een eenvoudiger technologisch voorbeeld zijn. Ongeacht hoe ze kunnen worden vervaardigd, deze materialen worden over het algemeen semipermeabele membranen genoemd.
Beschouw het apparaat geïllustreerd in figuur 7, waarin monsters van puur oplosmiddel en een oplossing worden gescheiden door een membraan dat alleen oplosmiddel bevat. moleculen kunnen doordringen. Oplosmiddelmoleculen zullen in beide richtingen over het membraan diffunderen. Aangezien de concentratie van het oplosmiddel in het zuivere oplosmiddel groter is dan in de oplossing, zullen deze moleculen sneller diffunderen van de oplosmiddelzijde van het membraan naar de oplossingszijde dan in de omgekeerde richting. Het resultaat is een netto overdracht van oplosmiddelmoleculen van het zuivere oplosmiddel naar de oplossing. Diffusiegestuurde overdracht van oplosmiddelmoleculen door een semipermeabel membraan is een proces dat bekend staat als osmose.
Figuur 7. (a) Een oplossing en zuiver oplosmiddel worden aanvankelijk gescheiden door een osmotisch membraan. (b) De netto overdracht van oplosmiddelmoleculen naar de oplossing vindt plaats totdat de osmotische druk ervan gelijke overdrachtssnelheden in beide richtingen oplevert.
Wanneer osmose wordt uitgevoerd in een apparaat zoals dat getoond in figuur 7 , neemt het volume van de oplossing toe naarmate deze verdund wordt door ophoping van oplosmiddel. Dit zorgt ervoor dat het niveau van de oplossing stijgt, waardoor de hydrostatische druk toeneemt (vanwege het gewicht van de kolom met oplossing in de buis) en resulteert in een snellere overdracht van oplosmiddelmoleculen terug naar de zuivere oplosmiddelzijde. Wanneer de druk een waarde bereikt die een omgekeerde overdrachtssnelheid van het oplosmiddel oplevert die gelijk is aan de osmosesnelheid, stopt de bulkoverdracht van oplosmiddel. Deze druk wordt de osmotische druk (Π) van de oplossing genoemd. De osmotische druk van een verdunde oplossing is gerelateerd aan de molariteit van de opgeloste stof, M, en de absolute temperatuur, T, volgens de vergelijking
\ Pi = MRT
waarbij R de universele gasconstante is.
Als een oplossing wordt geplaatst in een apparaat zoals weergegeven in figuur 8, wordt bij het uitoefenen van een grotere druk dan de osmotische druk van de oplossing de osmose omgekeerd en worden oplosmiddelmoleculen uit de oplossing in het zuivere oplosmiddel geduwd. Deze techniek van omgekeerde osmose wordt gebruikt voor grootschalige ontzilting van zeewater en op kleinere schaal om zuiver kraanwater te produceren om te drinken.
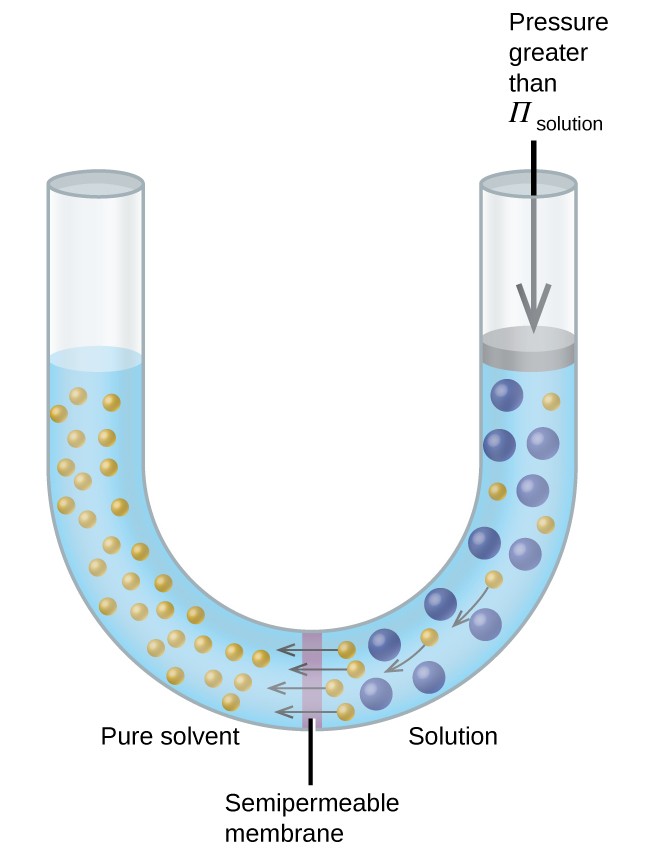
Figuur 8. Door een druk toe te passen die groter is dan de osmotische druk van een oplossing, wordt osmose omgekeerd. Oplosmiddelmoleculen uit de oplossing worden in het zuivere oplosmiddel geduwd.
Omgekeerde osmose waterzuivering
Bij osmose dient diffusie om water door een semipermeabel membraan van een minder geconcentreerde oplossing naar een meer geconcentreerde oplossing. Osmotische druk is de hoeveelheid druk die op de meer geconcentreerde oplossing moet worden uitgeoefend om ervoor te zorgen dat de osmose stopt. Als er meer druk wordt uitgeoefend, gaat het water van de meer geconcentreerde oplossing naar een minder geconcentreerde (meer zuivere) oplossing. Dit heet omgekeerde osmose. Omgekeerde osmose (RO) wordt gebruikt om water in veel toepassingen te zuiveren, van ontziltingsinstallaties in kuststeden tot waterzuiveringsmachines in supermarkten (Figuur 9), en kleinere omgekeerde osmose-huishoudelijke eenheden. Met een handbediende pomp kunnen kleine RO-units worden gebruikt in derdewereldlanden, rampgebieden en in reddingsboten. Onze strijdkrachten hebben een verscheidenheid aan door een generator aangedreven RO-eenheden die in voertuigen naar afgelegen locaties kunnen worden vervoerd.

Figuur 9. Omgekeerde osmose-installaties voor het zuiveren van drinkwater worden hier getoond op (a) kleine en (b) grote schaal. (credit a: wijziging van werk door Jerry Kirkhart; credit b: wijziging van werk door Willard J. Lathrop)
Voorbeelden van osmose zijn duidelijk in veel biologische systemen omdat cellen omgeven door semipermeabele membranen. Wortelen en selderij die slap zijn geworden doordat ze water hebben verloren, kunnen weer knapperig worden gemaakt door ze in water te leggen. Water komt door osmose in de wortel- of selderijcellen. Een komkommer die in een geconcentreerde zoutoplossing wordt geplaatst, verliest water door osmose en neemt wat zout op om een augurk te worden. Osmose kan ook dierlijke cellen aantasten. Concentraties van opgeloste stoffen zijn vooral belangrijk wanneer oplossingen in het lichaam worden geïnjecteerd. Opgeloste stoffen in lichaamsvloeistoffen en bloedserum geven deze oplossingen een osmotische druk van ongeveer 7,7 atm. Oplossingen die in het lichaam worden geïnjecteerd, moeten dezelfde osmotische druk hebben als bloedserum; dat wil zeggen dat ze isotoon moeten zijn met bloedserum. Als een minder geconcentreerde oplossing, een hypotone oplossing, in voldoende hoeveelheid wordt geïnjecteerd om het bloedserum te verdunnen, gaat water uit het verdunde serum door osmose in de bloedcellen, waardoor de cellen uitzetten en scheuren. Dit proces wordt hemolyse genoemd. Wanneer een meer geconcentreerde oplossing, een hypertone oplossing, wordt geïnjecteerd, verliezen de cellen water aan de meer geconcentreerde oplossing, verschrompelen en sterven mogelijk in een proces dat crenatie wordt genoemd. Deze effecten worden geïllustreerd in figuur 10.
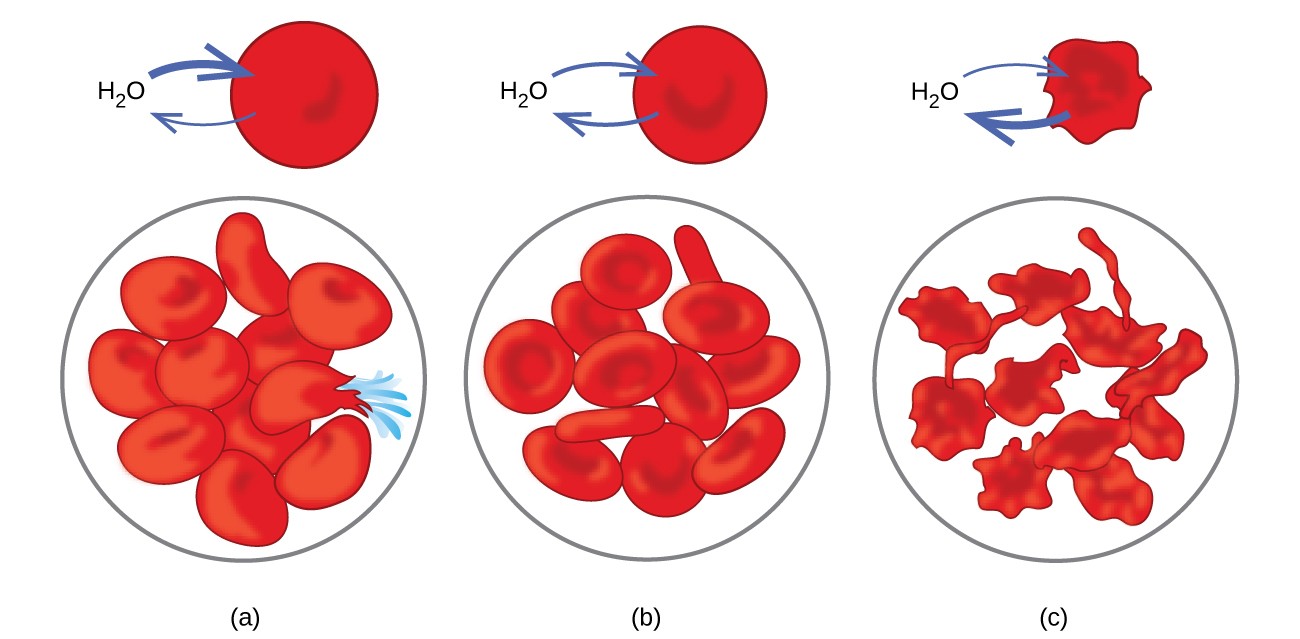
Figuur 10. Rode bloedcelmembranen zijn waterdoorlatend en zal (a) zwellen en mogelijk scheuren in een hypotone oplossing; (b) behoud van normaal volume en vorm in een isotone oplossing; en (c) verschrompelen en mogelijk afsterven in een hypertone oplossing. (credit a / b / c: aanpassingen van het werk door “LadyofHats” / Wikimedia commons)
Bepaling van molaire massa
Osmotische druk en veranderingen in vriespunt, koken punt en dampspanning zijn recht evenredig met de concentratie van de aanwezige opgeloste stof. Daarom kunnen we een meting van een van deze eigenschappen gebruiken om de molaire massa van de opgeloste stof uit de metingen te bepalen.
Colligatieve eigenschappen van elektrolyten
Zoals eerder in deze module opgemerkt, zijn de colligatieve eigenschappen van een oplossing alleen afhankelijk van het aantal, niet van de identiteit, van de opgeloste soorten opgeloste stoffen. De concentratietermen in de vergelijkingen voor verschillende colligatieve eigenschappen (vriespuntverlaging , kookpuntverhoging, osmotische druk) hebben betrekking op alle opgeloste soorten die in de oplossing aanwezig zijn. Voor de oplossingen die tot dusver in dit hoofdstuk zijn besproken, zijn de opgeloste stoffen niet-elektrolyten die fysiek oplossen zonder dissociatie of enig ander begeleidend proces. le dat oplost, levert één opgelost molecuul op. Het oplossen van een elektroyt is echter niet zo eenvoudig, zoals geïllustreerd door de twee algemene voorbeelden hieronder:
Gezien het eerste van deze voorbeelden, en uitgaande van volledige dissociatie, bevat een 1,0 m waterige oplossing van NaCl 2,0 mol ionen (1,0 mol Na + en 1.0 mol Cl−) per kilogram water, en de vriespuntverlaging is naar verwachting
Wanneer deze oplossing daadwerkelijk wordt bereid en de vriespuntverlaging wordt gemeten, wordt een waarde van 3,4 ° C verkregen. Soortgelijke discrepanties worden waargenomen voor andere ionische verbindingen, en de verschillen tussen de gemeten en verwachte colligatieve eigenschapswaarden worden doorgaans groter naarmate de concentraties opgeloste stof toenemen. Deze waarnemingen suggereren dat de ionen van natriumchloride (en andere sterke elektrolyten) niet volledig gedissocieerd zijn in oplossing.
Om hier rekening mee te houden en de fouten te vermijden die gepaard gaan met de aanname van totale dissociatie, wordt een experimenteel gemeten parameter genoemd in eer van de Nobelprijswinnende Duitse chemicus Jacobus Henricus van’t Hoff wordt gebruikt. De van’t Hoff-factor (i) wordt gedefinieerd als de verhouding tussen opgeloste deeltjes in oplossing en het aantal opgeloste formule-eenheden:
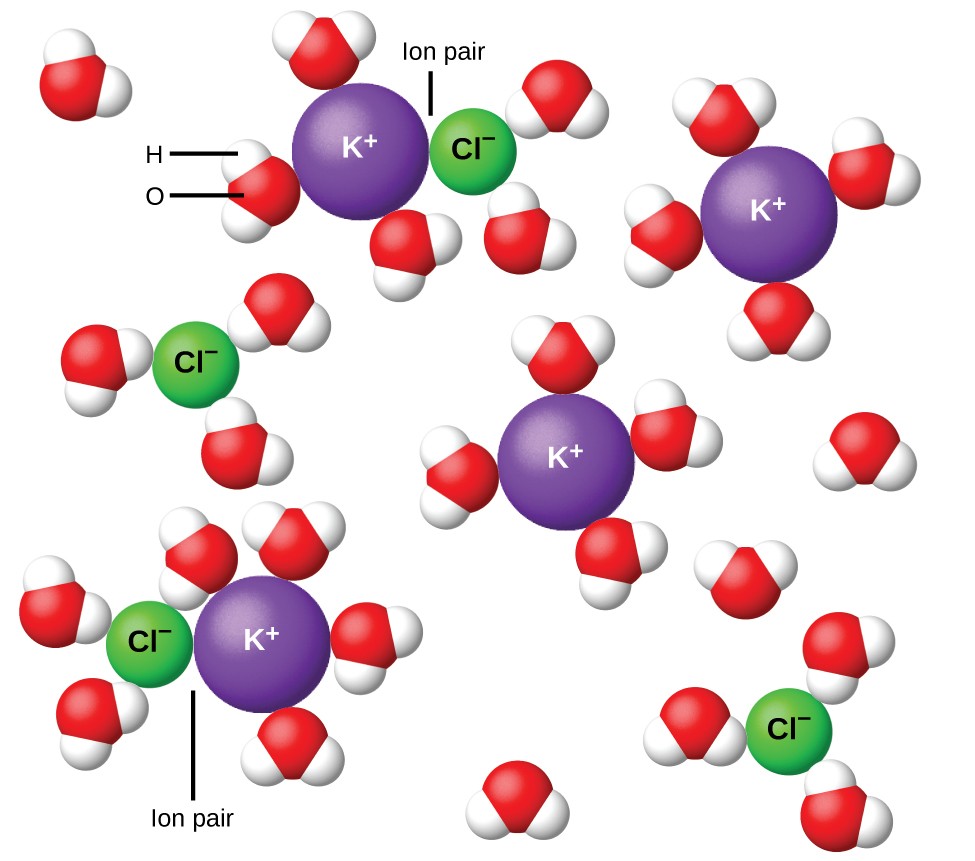
Figuur 11. Ionen worden steeds wijder van elkaar gescheiden naarmate de oplossing verdund wordt, en de resterende interionische attracties worden minder.
In 1923 stelden de chemici Peter Debye en Erich Hückel een theorie voor om de schijnbaar onvolledige ionisatie van sterke elektrolyten te verklaren. Ze suggereerden dat, hoewel interionische aantrekking in een waterige oplossing sterk wordt verminderd door solvatatie van de ionen en de isolerende werking van het polaire oplosmiddel, deze niet volledig teniet wordt gedaan. De overblijvende attracties voorkomen dat de ionen zich gedragen als volledig onafhankelijke deeltjes (Figuur 11). In sommige gevallen kunnen een positief en negatief ion elkaar daadwerkelijk raken, waardoor een gesolvateerde eenheid ontstaat die een ionenpaar wordt genoemd. De activiteit of de effectieve concentratie van een bepaald soort ion is dus minder dan aangegeven door de feitelijke concentratie. Ionen worden steeds wijder gescheiden naarmate de oplossing meer verdund wordt, en de resterende interionische attracties worden steeds minder. Dus in extreem verdunde oplossingen zijn de effectieve concentraties van de ionen (hun activiteiten) in wezen gelijk aan de werkelijke concentraties. Merk op dat de van’t Hoff-factoren voor de elektrolyten in Tabel 2 gelden voor 0,05 m-oplossingen, waarbij de concentratie van i voor NaCl 1,9 is, in tegenstelling tot een ideale waarde van 2.
Voorbeeld 11: het vriespunt van een oplossing van een elektrolyt
De ionenconcentratie in zeewater is ongeveer hetzelfde als die in een oplossing die 4,2 g NaCl opgelost in 125 g water bevat. Stel dat elk van de ionen in de NaCl-oplossing hetzelfde effect heeft op het vriespunt van water als een niet-elektrolytisch molecuul, en bepaal de vriestemperatuur van de oplossing (die ongeveer gelijk is aan de vriestemperatuur van zeewater).
Check Your Learning
Neem aan dat elk van de ionen in calciumchloride, CaCl2, heeft hetzelfde effect op het vriespunt van water als een niet-elektrolytisch molecuul. Bereken het vriespunt van een oplossing van 0,724 g CaCl2 in 175 g water.
Probeer het
- Vlees kan worden geclassificeerd als vers (niet bevroren), ook al wordt het bewaard bij −1 ° C. Waarom zou vlees bij deze temperatuur niet invriezen?
- Een organische verbinding heeft een samenstelling van 93,46% C en 6,54% H. Een oplossing van 0,090 g van deze verbinding in 1,10 g kamfer smelt bij 158,4 ° C. Het smeltpunt van pure kamfer is 178,4 ° C. Kf voor kamfer is 37,7 ° C / m. Wat is de moleculaire formule van de opgeloste stof? Laat uw berekeningen zien.
- Van een zout is bekend dat het een alkalimetaalfluoride is. Een snelle bepaling van het vriespunt geeft aan dat 4 g van het zout opgelost in 100 g water een oplossing oplevert die bevriest bij ongeveer -1,4 ° C. Wat is de formule van het zout? Laat uw berekeningen zien.
Verklarende woordenlijst
activiteit: effectieve concentratie van ionen in oplossing; het is lager dan de werkelijke concentratie, vanwege ionische interacties.
kookpuntverhoging: verhoging van het kookpunt van een vloeistof door toevoeging van een opgeloste stof
kookpuntverhogingsconstante: de evenredigheidsconstante in de vergelijking die de kookpuntverhoging relateert aan de molaliteit van de opgeloste stof; ook bekend als de ebullioscopische constante
colligatieve eigenschap: eigenschap van een oplossing die alleen afhangt van de concentratie van een opgeloste soort
crenatie: proces waarbij biologische cellen verschrompelen door verlies van water door osmose
vriespuntverlaging: verlaging van het vriespunt van een vloeistof door toevoeging van een opgeloste stof
vriespuntverlagingsconstante: (ook cryoscopische constante) evenredigheidsconstante in de vergelijking die betrekking heeft vriespuntverlaging tot molaliteit van opgeloste stof
hemolyse: breuk van rode bloedcellen door ophoping van overtollig water door osmose
hypertoon: van grotere osmotische druk
hypotoon : met minder osmotische druk
ionenpaar: gesolvateerd anion / kationpaar bij elkaar gehouden door matige elektrostatische aantrekking
isotoon: van gelijke osmotische druk
molaliteit (m) : een concentratie-eenheid gedefinieerd als de verhouding van het aantal mol opgeloste stof tot de massa van het oplosmiddel in kilogram
molfractie (X): de verhouding van de molaire hoeveelheid van een oplossingscomponent tot het totale aantal mol van alle oplossingscomponenten
osmose: diffusie van oplosmiddelmoleculen door een semipermeabel membraan
osmotische druk (Π ): tegengestelde druk die nodig is om bulkoverdracht van oplosmiddelmoleculen door een semipermeabel membraan te voorkomen
De wet van Raoult: de partiële druk die wordt uitgeoefend door een oplossingscomponent is gelijk aan het product van de molfractie van de component in de oplossing en zijn evenwicht dampspanning in zuivere toestand
semipermeabel membraan: een membraan dat selectief bepaalde ionen of moleculen doorlaat
van’t Hoff factor (i): de verhouding van het aantal mol van deeltjes in een oplossing tot het aantal mol formule-eenheden opgelost in de oplossing
- Een niet-elektrolyt getoond ter vergelijking. ↵

