Klinisch geval
Een 45-jarige vrouw met een 20-jarige geschiedenis van de ziekte van Crohn presenteert zich met koorts, koude rillingen en vermoeidheid gedurende 10 dagen. Kort voor het begin van de symptomen onderging de patiënte een ongecompliceerde colonoscopie, waarbij ze 17 biopsieën liet uitvoeren voor surveillance of poliepectomie. Tijdens colonoscopie was de ziekte van Crohn in remissie en werd er geen slijmvliesontsteking opgemerkt.
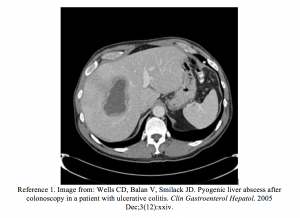
In de spoedafdeling waren de vitale functies van de patiënt HR 110, BP 120/80, RR 18, T 102.5. Ze had een milde gevoeligheid van de rechter bovenbuik. Laboratoriumstudies lieten een verhoogd aantal witte bloedcellen zien (15.000) en verhoogde ASAT en ALAT (120/137 U / L), met licht verhoogde alkalische fosfatase van 200 IE / L. Een computertomografie (CT) -scan van de buik onthulde meerdere gebieden met lage verzwakking in de rechter leverkwab, consistent met leverabcessen. Drainage van de abcessen werd gekweekt en er groeide Streptococcus anginosus. Herstel van alle laesies trad op nadat ze waren gedraineerd door interventionele radiologie, en de patiënt kreeg een 6 weken durende kuur met intraveneuze antibiotica.
Inleiding
Colonoscopie is een veelgebruikte procedure bij de diagnose en behandeling van een breed scala aan aandoeningen, waaronder kanker, inflammatoire darmaandoeningen, poliepen, bloedingen en stricturen. Volgens de American Cancer Society wordt screening van colonoscopie vanaf de leeftijd van 50 jaar om de 10 jaar aanbevolen. Bij hoogrisicopatiënten, zoals patiënten met inflammatoire darmaandoeningen, wordt colonoscopie vaker uitgevoerd. De procedure is nog steeds de meest effectieve manier om kleine pre-carcinomateuze poliepen te vinden en te verwijderen, en daardoor het risico op overlijden door colon- en endeldarmkanker te verkleinen.
In het algemeen is colonoscopie zeer veilig. Een systematische review uit 2008 van 12 onderzoeken met een totaal van 57.742 colonoscopieën die werden uitgevoerd voor screening op gemiddeld risico, toonde een algeheel aantal ernstige ongewenste voorvallen aan van slechts 2,8 per 1000 procedures en een mortaliteit van 0,007% .2 Het risico op colonoscopie is echter niet constant tussen de groepen, en sommige complicaties komen vaker voor dan andere. Oudere volwassenen hebben een verhoogd risico op ernstige complicaties in vergelijking met jongere patiënten. In een onderzoek met 53.220 coloscopieën hadden patiënten van 80 tot 84 jaar een significant hoger percentage ernstige complicaties dan patiënten van 66 tot 69 jaar. Het risico op ernstige complicaties was ook verhoogd bij patiënten met comorbide aandoeningen zoals een voorgeschiedenis van beroerte, COPD, atriumfibrilleren en hartfalen.
Pyogeen leverabces (PLA) is een zeldzame maar ernstige complicatie van colonoscopie . De meeste complicaties van colonoscopie zullen binnen 7 dagen optreden, maar PLA kan dagen of zelfs weken later aanwezig zijn, en de geschiedenis van recente colonoscopie wordt mogelijk niet eens uitgelokt, tenzij de clinicus op de hoogte is van deze entiteit.4-6 Vanwege de vertraagde aard van PLA, worden deze patiënten waarschijnlijk gediagnosticeerd op de afdeling spoedeisende hulp.
Andere late complicaties zoals post-poliepectomie elektrocoagulatiesyndroom en de meer algemene problemen van vertraagde bloeding, niet-specifieke buikpijn, reacties op kalmerende middelen , en perforatie is ook te zien in de ED. Daarentegen zullen gasexplosies of onmiddellijke bloeding zelden worden gezien in de ED, aangezien deze problemen zich doorgaans snel voordoen in de endoscopiesuite, waar ze opduikend worden aangepakt. ED-artsen moeten op de hoogte zijn van alle mogelijke complicaties en hun tijdsverloop en moeten de middelen hebben om de ongelukkige post-colonoscopiepatiënt die aan een ernstige complicatie lijdt, correct te diagnosticeren en te behandelen.
Complicaties
Pyogeen Leverabces
PLA is een gevaarlijke ziekte met een hoge morbiditeit en mortaliteit die voorkomt met een snelheid van 10 tot 20 gevallen per 100.000 ziekenhuisopnames.4-6 Met de vooruitgang in diagnostische technieken en interventies verbetert de mortaliteit.7 Patiënten lopen echter nog steeds groot gevaar, vooral als de diagnose wordt uitgesteld, zoals vaak het geval is, omdat patiënten zich niet-specifiek kunnen presenteren. Een retrospectieve studie van 63 patiënten met PLA toonde aan dat koorts vaak voorkwam (59%), maar andere tekenen en symptomen zoals pijn in het rechterbovenkwadrant en peritoneale symptomen waren aanwezig bij respectievelijk slechts 39% en 14 %.8 De diagnose in deze studie was vaak gemiddeld een week vertraagd vanaf het begin van de symptomen.
Colonoscopie is een zeldzame maar waarschijnlijk ook onvoldoende herkende versneller van PLA. Aangenomen wordt dat stille microperforaties tijdens de procedure leiden tot infectie die de lever via de portale circulatie kan zaaien. Evenzo kunnen andere intra-abdominale infecties, zoals diverticulitis, mogelijk PLA veroorzaken als het geïnfecteerde gebied wordt afgevoerd door de poortader.9 Hepatische klaring van bacteriën via het portaalnetwerk is een normaal verschijnsel bij gezonde patiënten, maar galwegobstructie, slechte perfusie en hoge bacteriële belasting (zoals in het geval van infectie of meerdere biopsieën tijdens colonoscopie die de bloedbaan zaaien) kunnen vatbaar maken voor proliferatie en abces vorming. De literatuur beschrijft ongeveer 34% van de PLA-gevallen als cryptogeen, maar een deel hiervan zijn mogelijk patiënten met een recente colonoscopie die niet werd erkend als risicofactor voor het ziekteproces.8
De meeste PLA-isolaten zijn polymicrobieel en bestaande uit normale darmflora. Bloedkweken zijn in 33-65% van de gevallen positief, maar abceskweken zijn bijna allemaal positief.10 De meest voorkomende geïsoleerde micro-organismen zijn Streptococcus-soorten (37%), Eserichia Coli (33%), Bacteroides-soorten (24%), Klebsiella pneumoniae (18%), en micro-aerofiele streptokokken (12%). 10-11 Strep anginosus, gevonden in het geval van deze patiënt, is een facultatief anaëroob grampositief coccus en een van de meest voorkomende organismen die in PLA worden aangetroffen.
Een snelle diagnose van PLA is van cruciaal belang, want zelfs als de diagnose en therapie verbeteren, blijft de mortaliteit op 10% .5,7 Infectieuze complicaties van colonoscopie in het algemeen zijn zeldzaam, maar opnieuw wordt het oorzakelijk verband waarschijnlijk ook onvoldoende erkend. Colonoscopie is betrokken bij ten minste enkele gevallen van PLA.12-14 Maar voorbijgaande systemische bacteriëmie, waargenomen bij 4% van de colonoscopieën, lijkt het risico op infectie op zich niet te verhogen.15 Integendeel, de infectie in PLA zou zich verspreiden via daadwerkelijke microperforaties.
Hoewel bekend is dat openhartige perforaties relatief zeldzaam zijn (minder dan 0,1% van de colonoscopieën), is de incidentie en pathofysiologie van microperforaties niet geheel bekend.16-17 Gewapend met kennis van deze klinische entiteit, kan een arts die een goede geschiedenis heeft en een hoge verdenkingsindex heeft, sneller PLA diagnosticeren bij een patiënt met een recente colonoscopie.
Infectie
Het is algemeen aanvaard dat voorbijgaande bacteriëmie na colonoscopie treedt op bij ongeveer 4% van de procedures, hoewel het bereik wordt gerapporteerd als 0-25%, en risicofactoren voor bacteriëmie niet zijn gedefinieerd.18 Hogere percentages bacteriëmie treden op tijdens routinematige dagelijkse activiteiten zoals tandenpoetsen en kauwen op voedsel. Hoewel tekenen of symptomen van systemische infectie bij patiënten met voorbijgaande bacteriëmie zeldzaam zijn, kunnen patiënten koorts, koude rillingen en klachten voelen die alles nabootsen, van infecties van de bovenste luchtwegen tot buikinfecties.18
Hoewel voorbijgaande bacteriëmie een geaccepteerd risico is op colonoscopie is er geen bewezen voordeel voor routinematige antibioticaprofylaxe, en de meeste patiënten zullen geen peri-procedure antibiotica hebben gebruikt.18 De huidige richtlijnen van de American Society for Gastroenterology (ASGE) komen overeen met de American Heart Association (AHA) en bevelen patiënten die routinematige coloscopie ondergaan.19
Het kan moeilijk zijn om symptomen van voorbijgaande bacteriëmie te onderscheiden van echte infectie.18 In het algemeen rechtvaardigen patiënten met infectieuze symptomen in de dagen na colonoscopie laboratoriumonderzoek, inclusief bloedkweken, en de index van verdenking op perforatie, abdominale beeldvorming. 20-21 Als de verdenking op perforatie laag is of de diagnose s is uitgesloten, IV-hydratatie en antibiotica kunnen worden gegeven als dit gerechtvaardigd is door de klinische toestand van de patiënt.
Bloeding
Bloeding na poliepectomie kan zowel onmiddellijk als vertraagd zijn. Onmiddellijke bloeding wordt geassocieerd met polypectomietechnieken die geen cauterisatie gebruiken of wanneer gemengde stroom wordt gebruikt voor de procedure. Vertraagde bloeding wordt vaker gezien bij de ED, aangezien onmiddellijke bloeding vaak wordt gedetecteerd op het moment van de procedure en wordt aangepakt door de endoscopist. Vertraagde bloeding kan tot 7 dagen na de procedure worden waargenomen. Aangenomen wordt dat het optreedt als gevolg van het afstoten van een dood weefsel dat een bloedvat bedekte of als gevolg van uitbreiding van de zone van thermische necrose naar niet-beschadigd weefsel, wat kan leiden tot bloeding als het een bloedvat betreft.19,22
Verschillende grote onderzoeken hebben bloeding gemeld bij 1 tot 6 per 1000 colonoscopieën (0,1% -0,6%) .22 Een onderzoek waarin meer dan 50.000 colonoscopieën werden geanalyseerd, toonde echter aan dat het percentage gastro-intestinale bloedingen significant verschilde, afhankelijk van of een polypectomie werd uitgevoerd. Bloeding na poliepectomie treedt op bij 1-2%, met hogere percentages die worden gezien bij het verwijderen van grotere poliepen. Het risico op bloeding na poliepectomie kan verhoogd zijn bij patiënten met trombocytopenie of coagulopathieën.23
Bekende risicofactoren voor bloeding na colonoscopie zijn onder meer de grootte van de poliepen, het aantal verwijderde poliepen, een voorgeschiedenis van recent gebruik van anticoagulantia of poliep histologie.22 Vreemd genoeg vonden meerdere, grote studies geen gebruik van aspirine geassocieerd met post-poliepectomie bloeding.24-26
Patiënten met vertraagde bloeding kunnen tekenen van bloeding of anemie vertonen, waaronder vermoeidheid, zwakte bleekheid, hevig bloeden of bloedstolsels bij het afvegen, tachycardie, pijn op de borst en kortademigheid.Patiënten kunnen hematochezia of melena beschrijven, afhankelijk van de locatie van de bloeding.
De eerste behandeling van een patiënt met een vermoedelijke bloeding omvat het aanpakken van de basisluchtwegen, ademhaling en circulatie met 2 IV’s met grote diameter, kristalloïde vloeistoffen en hartbewaking. Patiënten met ernstige lagere GI-bloeding kunnen snel decompenseren en moeten een actief type en scherm hebben voor het geval transfusie nodig is.
Beeldvorming is niet altijd nodig, en indien mogelijk moet de beslissing voor beeldvorming samen met de GI worden genomen raadpleeg bij voorkeur de arts die de colonoscopie heeft uitgevoerd. Herhaalde colonoscopie is vaak de diagnostische en therapeutische procedure bij uitstek. Het American College of Radiology geeft de hoogste beoordeling van geschiktheid voor colonoscopie, hoewel het ook CTA van de buik / bekken en Tc-99m RBC-scan buik / bekken omvat als mogelijke geschikte stappen bij de diagnose.27
Als de patiënt instabiel is en de uitvoerende endoscopist niet beschikbaar is, moet de ED-arts algemene interventionele radiologie (IR), GI en chirurgie raadplegen.
Perforatie
Colonoscopische perforatie (CP) is een van de meest ernstige en gevreesde complicaties van colonoscopie. Hoewel zeldzaam, resulteert CP in hoge morbiditeit en mortaliteit.28-32 Perforatie kan het gevolg zijn van mechanische krachten op de darmwand, barotrauma of elektrocauterisatie en kan leiden tot abcesvorming, fistelvorming, intra-abdominale sepsis, langdurig verblijf in het ziekenhuis en zelfs overlijden.
CP komt voor bij ongeveer 0,016% van de diagnostische colonoscopieën, maar kan worden gezien bij maximaal 5% van de therapeutische colonoscopieën.33-35 Afhankelijk van wat er daadwerkelijk is gedaan tijdens de colonoscopie, kan het risico op perforatie hoger zijn of lager dan het gemiddelde, dus het verkrijgen van het operatierapport of de geschiedenis van de endoscopist kan nuttig zijn bij het bepalen van het risico.
Risico op CP voor verschillende colonoscopische procedures: 1,36-37
-Screening colonoscopie: 0,01-0,1%
-Anastomotische vernauwing dilatatie: 0-6%
-Crohn ziekte strictuur dilatatie: 0-18%
-Stent plaatsing: 4%
-Colonische decompressiebuisplaatsing: 2%
-Colonische endoscopische mucosale resectie 0-5%
Afgezien van de gebeurtenissen tijdens de procedure, specifieke risicofactoren voor CP zijn onder meer gevorderde leeftijd, meervoudige comorbiditeit, diverticulose, obstructie, resectie van poliepen, poliepen die groter zijn dan 1 cm of die worden aangetroffen in de rechter dikke darm, verminderde mobiliteit van de dikke darm, bestaande zwakte in de dikke darmwand , eerdere onvolledige poging tot colonoscopie of onervarenheid van de endoscopie.20
Patiënten met CP kunnen plotselinge, verslechterende buikpijn vertonen, gevolgd door de ten onrechte geruststellende volledige pijnvermindering wanneer de perforatie het ontstoken orgaan decomprimeert. Naarmate GI-inhoud in het peritoneum blijft stromen, ontwikkelen zich verergerende pijn en peritoneale symptomen. De symptomen zullen echter variëren op basis van de locatie en grootte van de perforatie, de mate van fecale lekkage in het peritoneum en de leeftijd en comorbiditeit van de patiënt.
Met name kunnen perforaties ook retro-peritoneaal zijn, wat overeenkomt met de locatie van de opgaande en neergaande dikke darm en de hepatische en miltflexuren. Hoewel het meest voorkomende symptoom van een colonperforatie buikpijn is, kunnen oudere patiënten een afgestompte respons hebben. Andere symptomen zijn koorts, misselijkheid, braken, kortademigheid, pijn op de borst, scapulaire pijn en nekpijn. Met name retroperitoneale perforaties kunnen minimale of atypische symptomen hebben, en vitale functies kunnen tachycardie en koorts vertonen, maar kunnen ook normaal zijn.20
De eerste behandeling van een vermoedelijke perforatie omvat aandacht voor luchtweg, ademhaling, circulatie met 2 IV’s met grote boring, kristalloïde vloeistoffen en hartmonitor. Labs inclusief CBC, CMP, lipase en type en scherm moeten worden verkregen. De patiënt moet strikt NPO zijn met empirische IV-antibiotica. Statische beeldvorming met CT buik / bekken of abdominale röntgenfoto indien instabiel moet worden besteld naast een statistisch chirurgisch consult.21
Post-polypectomiesyndroom
Post-polypectomiesyndroom, ook bekend als post-polypectomie elektrocoagulatiesyndroom of transmuraal brandwondensyndroom, het gevolg van elektrocoagulatieschade aan de darmwand, waardoor een transmurale brandwond en focale peritonitis ontstaat zonder duidelijke perforatie.38 De gemelde incidentie varieert van 3 per 100.000 (0,003%) tot 1 op 1000 (0,1% ). Het postpolypectomiesyndroom werd gemeld bij 6 patiënten van de 16.318 colonoscopieën die tussen 1994 en 2002 werden uitgevoerd in een groot geïntegreerd gezondheidssysteem.39 Risicofactoren voor deze zeldzame complicatie zijn onbekend.
Patiënten met het postpolypectomiesyndroom zijn meestal aanwezig. binnen 12 uur na colonoscopie met koorts, tachycardie en buikpijn. De aanvang van de symptomen kan echter tot 5-7 dagen na de procedure worden vertraagd.40 Patiënten hebben vaak leukocytose en kunnen stijfheid en tachycardie vertonen, die allemaal colonperforatie nabootsen.41
In tegenstelling tot perforatie, waarvoor een spoedoperatie nodig kan zijn, worden patiënten met postpolypectomiesyndroom over het algemeen conservatief behandeld met intraveneuze vloeistoffen, pijnbeheersing en geleidelijke verbetering van het dieet, met of zonder antibiotica gericht op gram- negatieve en anaërobe pathogenen.42 Minder ernstige gevallen kunnen zelfs poliklinisch behandeld worden met orale antibiotica en heldere vloeistoffen gedurende 1-2 dagen.42-43
Aangezien deze patiënten mogelijk niet te onderscheiden zijn van patiënten met perforatie, elke patiënt die wordt verdacht van het post-polypectomiesyndroom, vereist laboratoriumonderzoek en beeldvorming. Bij het postpolypectomiesyndroom vertoont een CT-scan gewoonlijk focale verdikking van de colonwand met omringende vetstrenging zonder enige extramurale lucht, hoewel in milde gevallen CT negatief kan zijn.42 Ongeacht het beeldvormingsresultaat, zoals bij perforatie, bij het postpolypectomiesyndroom wordt vermoed, moet de patiënt een chirurgisch consult krijgen.
Pearls
- Colonoscopie is een veelgebruikte screeningstest bij patiënten ouder dan 50 jaar. Complicaties kunnen vroeg of vertraagd optreden. EM-artsen dienen zich bewust te zijn van de mogelijke complicaties en hun verwachte tijdlijn om een nauwkeurige diagnose te stellen en om te gaan met mogelijke complicaties.
- Complicaties zijn onder meer bloeding, perforatie, post-polypectomiesyndroom, infectie, gasexplosie en pyogeen leverabces.
- Geschiedenis over patiëntfactoren en de procedure zelf (onderliggende aandoeningen, medicatie, of poliepen werden verwijderd, of cauterisatie werd gebruikt, of er onmiddellijk bloedverlies was) kan de diagnose en behandeling in de spoedafdeling sturen.
- Pyogeen leverabces kan 1-2 weken na colonoscopie aanwezig zijn met pijn en koorts in het rechterbovenkwadrant.
- Een groot deel van het colon is retroperitoneaal. Retroperitoneale perforaties kunnen vage en atypische symptomen veroorzaken, dus de index van verdenking moet hoog zijn.
- Het postpolypectomiesyndroom kan een perforatie nabootsen en kan gewoonlijk worden onderscheiden door middel van beeldvorming.
Referenties / verder lezen:
- Wells CD, Balan V, Smilack JD. Pyogeen leverabces na colonoscopie bij een patiënt met colitis ulcerosa. Clin Gastroenterol Hepatol. 2005 december; 3 (12): xxiv.
- Whitlock, E.P., Lin, J.S., Liles, E. et al. Screening op colorectale kanker: een gerichte, bijgewerkte systematische review voor de Amerikaanse Preventive Services Task Force. Ann Intern Med. 2008; 149: 638–658.
- Warren JL, Klabunde CN, Mariotto AB, Meekins A, Topor M, Brown ML, Ransohoff. Bijwerkingen na poliklinische colonoscopie bij de Medicare-populatie. Ann Intern Med. 2009; 150 (12): 849.
- Johannsen EC, Sifri CD, Madoff LC. Pyogene leverabcessen.Infect Dis Clin North Am. 2000; 14: 547–63.
- Meddings L, Myers RP, Hubbard J, et al. Een populatie-gebaseerde studie van pyogene leverabcessen in de Verenigde Staten: incidentie, mortaliteit en temporele trends. Ben J Gastroenterol. 2010; 105: 117–24.
- Kaplan GG, Gregson DB, Laupland KB. Populatiegebaseerd onderzoek naar de epidemiologie van en de risicofactoren voor pyogeen leverabces. Clin Gastroenterol Hepatol. 2004; 2: 1032-8.
- Petri A, Höhn J, Hódi Z, Wolfárd A, Balogh A. Pyogeen leverabces – 20 jaar ervaring. Vergelijking van behandelresultaten in twee perioden. Langenbecks Arch Surg. 2002; 387: 27-31.
- Pang TC, Fung T, Samra J, Hugh TJ, Smith RC. Pyogeen leverabces: een audit van 10 jaar ervaring. Wereld J Gastroenterol. 2011; 17: 1622–30.
- Murarka S, Pranav F, Dandavate V. Verspreide streptococcus anginosus van sigmoïde diverticulitis. J Glob Infect Dis. 2011; 3: 79–81.
- Branum GD, Tyson GS, Branum MA, Meyers WC. Hepatisch abces. Veranderingen in etiologie, diagnose en beheer. Ann Surg. 1990 december 212 (6): 655-62.
- Gyorffy EJ, Frey CF, Silva J Jr, McGahan J. Pyogeen leverabces. Diagnostische en therapeutische strategieën. Ann Surg. 1987 Dec. 206 (6): 699-705.
- Bonenfant F, Rousseau É, Farand P. Streptococcus anginosuspyogeen leverabces na screening colonoscopie. The Canadian Journal of Infectious Diseases & Medical Microbiology. 2013; 24 (2): e45-e46.
- Ian G. Harnik. Pyogeen leverabces na maligne poliepectomie. Dig Dis Sci. 2007; 52: 3524-5.
- Paraskeva KD, Bury RW, Isaacs P. Streptococcus milleri leverabcessen: een ongebruikelijke complicatie na colonoscopische verwijdering van een aangetast visbot. Gastrointest Endosc. 2000; 51: 357-8.
- Laag DE, Shoenut JP, Kennedy JK, et al. Prospectieve beoordeling van het risico op bacteriëmie met colonoscopie en polypectomie. Dig Dis Sci. 1987; 32: 1239–43.
- Becker F, Nusko G, Welke J, Hahn EG, Mansmann U. Follow-up na colorectale polypectomie: een risico-batenanalyse van Duitse surveillance-aanbevelingen. Int J Colorectal Dis. 2007; 22: 929–39.
- Macrae FA, Tan KG, Williams CB. Op weg naar een veiligere colonoscopie: een rapport over de complicaties van 5000 diagnostische of therapeutische colonoscopieën. Darm. 1983; 24: 376–83.
- Nelson, D.B.Complicaties van infectieziekten van GI-endoscopie: deel II, exogene infecties. Gastrointest Endosc. 2003; 57: 695-711.
- Khashab, M.A., Chithadi, K.V., Acosta, R.D. et al. Antibiotische profylaxe voor GI-endoscopie. ASGE Standards of Practice Committee. Gastrointest Endosc. 2015; 81: 81-89.
- Lohsiriwat V. Colonoscopische perforatie: incidentie, risicofactoren, management en uitkomst. World Journal of Gastroenterology: WJG. 2010; 16 (4): 425-430.
- American College of Radiology ACR-geschiktheidscriteria: acuut (niet-gelokaliseerd)
- Ko, C.W. en Dominitz, J.A. Complicaties van colonoscopie: omvang en beheer. Gastrointest Endosc Clin N Am. 2010; 20: 659-671.
- Warren JL, Klabunde CN, Mariotto AB, et al. Bijwerkingen na poliklinische colonoscopie bij de Medicare-populatie. Ann Intern Med 2009; 150: 849-57.
- Hui, A.J., Wong, R.M., Ching, J.Y. et al. Risico op colonoscopische polypectomie-bloeding met anticoagulantia en plaatjesaggregatieremmers: analyse van 1657 gevallen. Gastrointest Endosc. 2004; 59: 44-48.
- Sawhney, M.S., Salfiti, N., Nelson, D.B. et al. Risicofactoren voor ernstige vertraagde bloeding na polypectomie. Endoscopie. 2008; 40: 115–119
- Yousfi, M., Gostout, C.J., Baron, T.H. et al. Postpolypectomie lagere gastro-intestinale bloeding: mogelijke rol van aspirine. Ben J Gastroenterol. 2004; 99: 1785–1789.
- American College of Radiology ACR-geschiktheidscriteria: radiologische behandeling van bloedingen in het onderste maagdarmkanaal. https://acsearch.acr.org/docs/69457/Narrative/ (geraadpleegd op 16 juli 2017).
- Lohsiriwat V, Sujarittanakarn S, Akaraviputh T, Lertakyamanee N, Lohsiriwat D, Kachinthorn U. Colonoscopische perforatie: een rapport van het endoscopie-trainingscentrum van de World Gastroenterology Organization in Thailand. Wereld J Gastroenterol. 2008; 14: 6722–6725.
- Iqbal CW, Cullinane DC, Schiller HJ, Sawyer MD, Zietlow SP, Farley DR. Chirurgische behandeling en resultaten van 165 colonoscopische perforaties van één instelling. Arch Surg. 2008; 143: 701-706; discussie 706-707.
- Teoh AY, Poon CM, Lee JF, Leong HT, Ng SS, Sung JJ, Lau JY. Resultaten en voorspellers van mortaliteit en stomavorming bij chirurgisch beheer van colonoscopische perforaties: een multicenter review. Arch Surg. 2009; 144: 9–13.
- Lüning TH, Keemers-Gels ME, Barendregt WB, Tan AC, Rosman C. Colonoscopische perforaties: een beoordeling van 30.366 patiënten. Surg Endosc. 2007; 21: 994–997.
- Mai CM, Wen CC, Wen SH, Hsu KF, Wu CC, Jao SW, Hsiao CW. Iatrogene colonperforatie door colonoscopie: een fatale complicatie voor patiënten met een hoog anesthetisch risico. Int J Colorectal Dis. April 2010; 25 (4): 449-54.
- Rathgaber SW, Wick TM. Colonoscopie voltooiing en complicaties in een gastro-enterologische praktijk in de gemeenschap Gastrointest Endosc. 2006; 64: 556-562.
- Damore LJ, Rantis PC, Vernava AM, Longo WE. Colonoscopische perforaties. Etiologie, diagnose en beheer. Dis Colon Rectum. 1996; 39: 1308–1314.
- Repici A, Pellicano R, Strangio G, Danese S, Fagoonee S, Malesci A. Endoscopische mucosale resectie voor vroege colorectale neoplasie: pathologische basis, procedures en resultaten. Dis Colon Rectum. 2009; 52: 1502-1515.
- Chukmaitov A, Bradley CJ, Dahman B, et al. Associatie van polypectomietechnieken, endoscopisch volume en type instelling met complicaties bij colonoscopie. Gastrointest Endosc. 2013; 77: 436.
- Fisher DA, Maple DT, et al. Complicaties van colonoscopie. ASGE Standards of Practice Committee Gastrointest Endosc. 2011; 74: 745. Buikpijn en koorts of vermoedelijk abdominaal abces; Variant 1: postoperatieve patiënt met koorts. https://acsearch.acr.org/docs/69356/Narrative/ (geraadpleegd op 17 juli 2017).
- Hirasawa K, Sato C, Makazu M, et al. Coagulatiesyndroom: vertraagde perforatie na colorectale endoscopische behandelingen. World Journal of Gastrointestinal Endoscopy. 2015; 7 (12): 1055-1061.
- Levin TR, Zhao W, Conell C, Seeff LC, Manninen DL, Shapiro JA, Schulman J. Complicaties van colonoscopie in een geïntegreerd zorgsysteem. Ann Intern Med. 2006; 145 (12): 880.
- Kim HW. Wat is het verschil tussen postpolypectomie-koorts en postpolypectomie-coagulatiesyndroom? Clin Endosc. 2014; 47 (3): 205–6.
- Stock C, Ihle P, Sieg A, Schubert I, Hoffmeister M, Brenner H Bijwerkingen die ziekenhuisopname vereisen binnen 30 dagen na poliklinische screening en niet-gescreende colonoscopieën. Gastrointest Endosc. 2013 maart; 77 (3): 419-29.
- Sethi A, Song LMWK. Bijwerkingen gerelateerd aan endoscopische mucosale resectie van het colon en polypectomie. Gastrointest Endosc Clin N Am. 2015; 25 (1): 55-69.
- Benson BC, Myers JJ, Laczek JT. Postpolypectomie elektrocoagulatiesyndroom: een nabootsing van colonperforatie. Case Rep Emerg Med. 2013; 2013 687931.