- De aanwezigheid van hoge concentraties antilichamen (titer > 1: 640) doet vermoeden dat een auto-immuunziekte Cadeau. In dit scenario raad ik aan om sera vervolgens te testen op antilichamen tegen dsDNA, Sm, RNP, Ro (SS-A), La (SS-B) en misschien Scl-70. De aanwezigheid van antilichamen tegen een van deze stoffen verhoogt de kans dat de patiënt SLE, MCTD, Sjögren’s of sclerodermie heeft aanzienlijk. Sommige laboratoria zullen automatisch op deze antilichamen testen wanneer de screening-ANA positief is. De aanwezigheid van deze antilichamen is echter geen diagnose van ziekte. Als er geen eerste diagnose kan worden gesteld, is het mijn gewoonte om de patiënt in de loop van de tijd zorgvuldig te observeren op de ontwikkeling van een ANA-geassocieerde ziekte, en de patiënt minstens twee keer per jaar te zien.
- De combinatie van lage titers van antilichaam (< 1:80) en geen of weinig tekenen of symptomen van ziekte voorspelt een veel kleinere kans op een auto-immuunziekte. Als gevolg hiervan hoeven deze patiënten met lage ANA-titers minder vaak opnieuw te worden geëvalueerd – jaarlijks tenzij klinische symptomen evolueren die wijzen op een auto-immuunziekte.
- Het is zeer onwaarschijnlijk dat een patiënt met een negatieve ANA een SLE, MCTD heeft. , Sjögren’s of sclerodermie. Als er echter nog steeds sterk klinisch bewijs is van een systemische auto-immuunziekte, kan men testen op de specifieke antilichamen tegen dubbelstrengs (ds) DNA, Sm, RNP, Ro, La of Scl-70, hoewel, naar mijn ervaring, ze zijn doorgaans negatief. Desalniettemin is het verstandig om dergelijke patiënten te zien waar er een hoge klinische verdenkingsindex is, tenminste jaarlijks – hoewel vaker indien klinisch geïndiceerd.
- Antinucleaire antilichamen produceren een breed scala aan kleurpatronen (homogeen, diffuus , perifeer, rand, gespikkeld, nucleolair, anticentromeer, etc.). Er is erkend dat het nucleaire kleuringspatroon een relatief lage gevoeligheid en specificiteit heeft voor verschillende auto-immuunziekten. De aanwezigheid van antilichamen gericht tegen specifieke nucleaire antigenen is meestal nuttiger. (Deze antilichamen omvatten de volgende: dsDNA, Sm, RNP, Ro, La of Scl-70.)
In de afgelopen jaren hebben onderzoekers en biotechbedrijven immunoassays ter vervanging van de IF ANA-test.4-23 De grondgedachte achter deze poging heeft betrekking op de prestatiekenmerken van de IF-techniek. Deze test is zeer arbeidsintensief en is onderhevig aan variatie door verschillende interpretaties door technici. Ook complicerende testen zijn het vervagen van het beeld zoals het wordt onderzocht met een fluorescentiemicroscoop. Bovendien gebruikt de IF-techniek seriële verdunningen van patiëntensera, wat resultaten zal opleveren die mogelijk niet lineair zijn. Tweevoudige variaties in titer zijn gebruikelijk bij dagelijkse tests op hetzelfde monster; viervoudige verschillen zouden ‘significant’ zijn. Daarentegen zijn immunoassays in vaste fase geautomatiseerd en in hoge mate reproduceerbaar. De resultaten zijn lineair en de techniek is minder arbeidsintensief en dus goedkoper uit te voeren.
Vanwege deze overwegingen zouden er economische besparingen moeten zijn in gebruikmakend van een vaste-fase-immunoassay voor het kwantificeren van een ANA. In een poging om vaste-fase ANA-immunoassays te ontwikkelen, heeft een aantal groepen dus alle antigenen die doorgaans worden getest in de meer specifieke ANA-immunoassays (bijv. DNA, Sm, RNP, Ro / SSA, La / SSB, nucleoproteïne, celextracten, enz.) In gepubliceerde rapporten is de correlatiecoëfficiënt tussen ANA-titers en deze vaste-fase-assays redelijk goed. Daarom hebben veel commerciële bedrijven hun ANA’s omgeschakeld. voor deze immunoassays in vaste fase.4-23 Zorgwekkend is echter de hoge frequentie / percentage fout-negatieve resultaten bij patiënten met bekende SLE en verwante ziekten, evenals de aanhoudende hoge frequentie van ‘vals-positieven’ (bijv. een positieve ANA in iemand zonder SLE) in deze studies.15-21 Er is verder werk nodig om de gevoeligheid en vooral de specificiteit van deze vaste fase immunoassays te verbeteren om ervoor te zorgen dat patiënten met SLE en aanverwante ziekten niet over het hoofd worden gezien door deze vaste fase immunoassays.
Antilichamen tegen DNA
Antilichamen tegen DNA kunnen primair worden onderverdeeld in die welke reageren met enkelstrengs (ss) DNA en die welke dsDNA herkennen.24-26
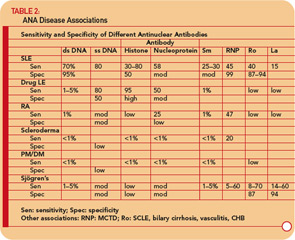
Anti- Antilichamen tegen ssDNA zijn gemeld bij SLE, reumatoïde artritis, geneesmiddelgerelateerde lupus, gezonde familieleden van patiënten met SLE en, minder vaak, bij andere reumatische aandoeningen. (Zie tabel 2, p. 17.) Anti-ssDNA heeft dus een beperkte bruikbaarheid voor de diagnose van SLE of andere reumatische aandoeningen. Anti-ssDNA correleert niet goed met ziekteactiviteit en is daarom niet bruikbaar voor ziektebeheer.
Antilichamen tegen dsDNA worden het vaakst gedetecteerd door middel van vaste-fase immunoassays, maar ook in sommige laboratoria door de crithidia IF-assay of af en toe de Farr radioimmunoassay.De meeste ziekenhuis- en commerciële labs doen er maar één. De Farr-assay heeft waarschijnlijk de hoogste specificiteit en laagste gevoeligheid van de drie assays voor de diagnose van SLE, terwijl solid-phase assays de hoogste sensitiviteit en laagste specificiteit hebben; de crithidia-test valt er tussenin. De Farr-test heeft ook het nadeel van het gebruik van radioactief materiaal, dat de meeste laboratoria vermijden, en de crithidia-test is zeer arbeidsintensief. Ik geef de voorkeur aan de ELISA-test voor dagelijks gebruik.
Anti-dsDNA is specifiek (95%) maar niet erg gevoelig (70%) voor SLE, waardoor ze erg nuttig zijn voor diagnose als ze positief zijn.9 (Zie tabel 2 , blz. 17.) Ze worden af en toe aangetroffen bij andere aandoeningen, waaronder reumatoïde artritis, juveniele artritis, door geneesmiddelen veroorzaakte lupus, auto-immuunhepatitis en zelfs bij normale personen.
Titers van anti-dsDNA-antilichamen fluctueren vaak met ziekteactiviteit, in het bijzonder lupus nefritis, en zijn daarom bij veel patiënten bruikbaar voor het volgen van het beloop van SLE. Als een patiënt een stijgende titer heeft, of een zeer hoge titer, maar klinisch rustig is, behandel ik de serologische afwijking niet, maar beschouw het als een waarschuwing dat de patiënt beter moet worden gevolgd en behandeld wanneer er klinisch iets gebeurt om een verandering in therapie. Sommige onderzoekers hebben deze serologische afwijkingen echter behandeld (vooral wanneer ze geassocieerd zijn met lage complementniveaus) en hebben verbeterde klinische resultaten gemeld. Omgekeerd gebruik ik een dalende titer bij iemand die beter wordt na een opflakkering tijdens de behandeling als richtlijn bij het verminderen van de behandeling (bijv. Corticosteroïden en / of immunosuppressiva).
De associatie tussen anti-dsDNA-antilichamen en andere ziekteverschijnselen van SLE zijn veel minder duidelijk. Er is bijvoorbeeld geen verband tussen de anti-dsDNA-titer en de ziekteactiviteit van neuropsychiatrische SLE.
Het is altijd een uitdaging om actieve lupusmanifestaties te onderscheiden van infectieuze complicaties of toxische effecten van medicijnen – en van niet-gerelateerde ziekte. De aanwezigheid van anti-dsDNA-antilichamen kan bij sommige patiënten behulpzaam zijn bij het maken van dit onderscheid.
Anti-Smith en anti-ribonucleoproteïne-antilichamen
Antilichamen tegen Smith (Sm) en anti-ribonucleoproteïne (anti-RNP) worden het vaakst gedetecteerd door middel van vaste-fase immunoassays.24,27
Anti-Sm-antilichamen worden aangetroffen bij slechts 10% tot 40% van de patiënten met SLE, maar zijn zeer zeldzaam bij patiënten met andere aandoeningen (dwz ze zijn niet gevoelig maar zijn zeer specifiek). Meting van anti-Sm-titers kan diagnostisch nuttig zijn, vooral in een tijd waarin anti-DNA-antilichamen niet detecteerbaar zijn. Gezien de relatief lage gevoeligheid van anti-Sm, sluit een negatieve waarde echter geenszins de diagnose van SLE uit.
Anti-RNP-antilichamen worden gevonden bij ongeveer 40% tot 60% van de patiënten met SLE, maar zijn niet specifiek voor SLE, omdat ze een bepalend kenmerk zijn van MCTD. Deze antilichamen kunnen ook voorkomen in lage titers en lage frequenties bij andere reumatische aandoeningen, waaronder RA en sclerodermie. (Zie tabel 2, p. 17.)
Noch de titer (niveaus) van anti-Sm- noch anti-RNP-antilichamen correleren met enige klinische activiteit.
Anti-Ro / SSA en anti-La / SSB-antilichamen
Antilichamen tegen Ro / SSA en La / SSB worden het vaakst gedetecteerd door middel van immunoassays in vaste fase.28,29 Anti-Ro / SSA en anti-La / SSB zijn gedetecteerd bij patiënten met het syndroom van Sjögren en bij SLE, maar ook bij patiënten met lichtgevoelige dermatitis, en bij 0,1% tot 0,5% van de gezonde volwassenen.
Anti-Ro / SSA-antilichamen worden aangetroffen bij ongeveer 50% van patiënten met SLE. (Zie tabel 2, p. 17.) Ze zijn in verband gebracht met lichtgevoeligheid, subacute cutane lupus, cutane vasculitis (palpabele purpura), interstitiële longziekte, neonatale lupus en een aangeboren hartblok. Anti-Ro / SSA-antilichamen worden aangetroffen bij ongeveer 75% van de patiënten met het primaire syndroom van Sjögren (zie tabel 2, p. 17), en hoge titers van deze antilichamen worden geassocieerd met een grotere incidentie van extra glandulaire kenmerken, met name purpura en vasculitis. Daarentegen zijn Ro / SSA-antilichamen aanwezig in slechts 10% tot 15% van de patiënten met het secundaire syndroom van Sjögren geassocieerd met reumatoïde artritis. Daarom ondersteunt de aanwezigheid van Ro / SSA- of anti-La / SSB-antilichamen bij patiënten met verdenking op het primaire syndroom van Sjögren de diagnose sterk.
Ongeveer 50% van de patiënten met SLE die anti-Ro-antilichamen hebben, heeft ook -La-antilichaam, een nauw verwant RNA-eiwitantigeen. Evenzo hebben de meeste patiënten met het syndroom van Sjögren ook anti-La (SSB) -antistoffen. Het is buitengewoon zeldzaam om patiënten te vinden met anti-La-antilichamen zonder anti-Ro-antilichamen.
Naar mijn mening zijn de indicaties voor het bestellen van een anti-Ro / SSA- en anti-La / SSB-antilichaamtest als volgt:
- Vrouwen met SLE die zwanger zijn of kunnen in de toekomst zwanger worden;
- Vrouwen met een voorgeschiedenis van het baren van een kind met hartblokkade of myocarditis;
- Patiënten met een voorgeschiedenis van onverklaarde lichtgevoelige huiduitslag;
- Patiënten met een sterk vermoeden van SLE, maar die een negatieve ANA-test hebben; of
- Patiënten met symptomen van xerostomie, keratoconjunctivitis sicca en / of speeksel- en traankliervergroting.
Antiribosomale P-proteïne-antilichamen
Anti- ribosomale P-proteïne-antilichamen zijn gedetecteerd bij 10% tot 20% van de patiënten met SLE in de Verenigde Staten en 40% tot 50% van de Aziatische patiënten met SLE, maar zelden bij andere reumatische aandoeningen.30 Antiribosomale P-proteïne-antilichamen kunnen sterk zijn specifiek voor met lupus geassocieerde psychose, hoewel niet alle onderzoeken dit hebben bevestigd. Depressie en nier- en leverbetrokkenheid bij patiënten met lupus zijn ook in verband gebracht met antiribosomale P-proteïne-antilichamen in enkele kleine onderzoeken.
Vanwege de lage gevoeligheid en slechte klinische correlatie zien veel onderzoekers, waaronder ikzelf, weinig klinische bruikbaarheid in deze test.
Anticentromere antilichamen
Anticentromere antilichamen (ACA’s) worden bijna uitsluitend gevonden bij patiënten met beperkte cutane systemische sclerose (lcSSc), vooral bij patiënten met CREST.31 ACA’s zijn waargenomen bij 57% van de patiënten met CREST, maar zijn ook gezien bij patiënten met andere aandoeningen, waaronder bij sommige patiënten met alleen het fenomeen van Raynaud. ACA’s worden typisch gedetecteerd door het karakteristieke IF-patroon op Hep-2-cellen.
Anti-Scl-70 (topoisomerase-1) -antilichamen
Ongeveer 15% tot 20% van de patiënten met sclerodermie hebben antilichamen tegen een eiwit van 70 kd (topoisomerase-1), dat later Scl-70.31 wordt genoemd. De gebruikelijke methode voor detectie is door middel van ELISA. De aanwezigheid van deze antilichamen lijkt het risico op longfibrose bij patiënten met sclerodermie te verhogen en is vrij specifiek voor de ziekte.
Samenvatting
Als men SLE vermoedt op basis van de geschiedenis, lichamelijk onderzoek en volledig bloedbeeld (bijv. leukopenie, trombocytopenie), vraag een ANA-test aan. Als het negatief is, is het hoogst onwaarschijnlijk dat de patiënt SLE heeft en kan de patiënt gerustgesteld worden. Als de titer < 1: 160 is, is SLE onwaarschijnlijk en kan de patiënt gerustgesteld worden dat SLE onwaarschijnlijk is, maar de patiënt moet periodiek worden gevolgd. Een titer van ≥1: 160 verhoogt de kans op SLE en gerelateerde aandoeningen. Het is echter belangrijk om te onthouden dat 85% van de mensen met een positieve ANA geen SLE heeft. Als de ANA positief is, moet men ook testen op antilichamen tegen dsDNA, Sm, RNP, Ro / SSA en La / SSB. De aanwezigheid van deze antilichamen verhoogt de kans dat de patiënt SLE en gerelateerde aandoeningen heeft aanzienlijk (zie Tabel 2, p. 17), en de patiënt moet dan ook beter gevolgd worden. De detectie van anticentromeer- en anti-Scl-70-antistoffen is zeer nuttig voor de diagnose van sclerodermie. De detectie van antilichamen tegen Ro / SSA en La / SSB zijn ook nuttig voor de diagnose van het syndroom van Sjögren.
De enige van deze tests die nuttig is om de activiteit te controleren, is het anti-dsDNA.
Erkenning: ik ben veel dank verschuldigd aan het werk van vele auteurs van UpToDate in Medicine, wiens werk een nuttig raamwerk bood voor de ontwikkeling van dit artikel, en aan Drs. Robert Shmerling, David Lee en Donald Bloch, met wie ik papers en hoofdstukken over hetzelfde onderwerp heb geschreven.
Dr. Schur is hoogleraar geneeskunde aan de Harvard Medical School en de afdeling reumatologie, immunologie en allergie op de afdeling geneeskunde van het Brigham and Women’s Hospital in Boston.
- Reichlin M.Meting en klinische betekenis van antinucleaire antilichamen. Actueel. Oktober 2008.
- American College of Rheumatology Ad Hoc Committee on Immunologic Testing Guidelines. Richtlijnen voor immunologisch laboratoriumonderzoek bij reumatische aandoeningen: een inleiding. Artritis Reum. 2002; 47: 429-433.
- Solomon DH, Kavanaugh AJ, Schur PH, et al. Op bewijzen gebaseerde richtlijnen voor het gebruik van immunologische tests: testen op antinucleaire antilichamen. Artritis Reum. 2002; 47: 434-444.
- Sinclair D, Saas M, Williams D, Hart M, Goswami R. Kan een ELISA immunofluorescentie vervangen voor de detectie van antinucleaire antilichamen? – Het routinematige gebruik van ELISA’s voor het screenen van nucleaire antilichamen. Clin Lab. 2007; 53: 183-191.
- Avaniss-Aghajani E, Berzon S, Sarkissian A. Klinische waarde van gemultiplexte op bolletjes gebaseerde immunoassays voor detectie van auto-antilichamen tegen nucleaire antigenen. Clin Vaccine Immunol. 2007; 14: 505-509.
- Copple SS, Martins TB, Masterson C, Joly E, Hill HR. Vergelijking van drie multiplex immunoassays voor detectie van antilichamen tegen extraheerbare nucleaire antilichamen met behulp van klinisch gedefinieerde sera. Ann N Y Acad Sci.2007; 1109: 464-472.
- Caramaschi P, Ruzzenente O, Pieropan S, et al. Bepaling van ANA-specificiteit met behulp van immunoassay met multiplex fluorescerende microsferen bij patiënten met ANA-positiviteit bij hoge titers na behandeling met infliximab: voorlopige resultaten. Rheumatol Int. 2007; 27: 649-654.
- Biagini RE, Parks CG, Smith JP, Sammons DL, Robertson SA. Analytische prestaties van de AtheNA MultiLyte ANA II-test in sera van lupuspatiënten met meerdere positieve ANA’s. Anal Bioanal Chem. 2007; 388: 613-618.
- Gonzalez C, Garcia-Berrocal B, Perez M, et al. Laboratoriumscreening van bindweefselaandoeningen door een nieuwe geautomatiseerde ENA-screeningstest (EliA Symphony) bij klinisch gedefinieerde patiënten. Clin Chim Acta. 2005; 359: 109-114.
- Eissfeller P, Sticherling M, Scholz D, et al. Vergelijking van verschillende testsystemen voor gelijktijdige detectie van auto-antilichamen bij bindweefselaandoeningen. Ann N Y Acad Sci. 2005; 1050: 327-339.
- Smith J, Onley D, Garey C, et al. Bepaling van ANA-specificiteit met behulp van het UltraPlex-platform. Ann N Y Acad Sci. 2005; 1050: 286-294.
- Martins TB, Burlingame R, von Muhlen CA, et al. Evaluatie van immunoassay met multiplex fluorescerende microsferen voor detectie van auto-antilichamen tegen nucleaire antigenen. Clin Diagn Lab Immunol. 2004; 11: 1054-1059.
- Bernardini S, Infantino M, Bellincampi L, et al. Screening van antinucleaire antilichamen: vergelijking tussen enzym-immunoassay op basis van nucleaire homogenaten, gezuiverde of recombinante antigenen en immunofluorescentietest. Clin Chem Lab Med. 2004; 42: 1155-1160.
- Nossent H, Rekvig OP. Antinucleaire antilichaamscreening in dit nieuwe millennium: vaarwel aan de microscoop? Scand J Rheumatol. 2001; 30: 123-126; discussie 127-128.
- Lopez-Hoyos M, Rodriguez-Valverde V, Martinez-Taboada V. Prestaties van antinucleaire antilichaam bindweefselziekte-screening. Ann N Y Acad Sci. 2007; 1109: 322-329.
- Ghillani P, Rouquette AM, Desgruelles C, et al. Evaluatie van de LIAISON ANA-screentest voor het testen van antinucleaire antilichamen bij auto-immuunziekten. Ann N Y Acad Sci. 2007; 1109: 407-413.
- Bonilla E, Francis L, Allam F, et al. Immunofluorescentiemicroscopie is superieur aan fluorescerende korrels voor de detectie van antinucleaire antilichaamreactiviteit bij patiënten met systemische lupus erythematosus. Clin Immunol. 2007; 124: 18-21.
- Nifli AP, Notas G, Mamoulaki M, et al. Vergelijking van een multiplex, op parels gebaseerde fluorescentietest en immunofluorescentiemethoden voor de detectie van ANA- en ANCA-auto-antilichamen in menselijk serum. J Immunol Methods. 2006; 311: 189-197.
- Shovman O, Gilburd B, Zandman-Goddard G, et al. Gemultiplexte AtheNA multi-lyte immunoassay voor ANA-screening bij auto-immuunziekten. Auto-immuniteit. 2005; 38: 105-109.
- Ulvestad E. Prestatiekenmerken en klinische bruikbaarheid van een hybride ELISA voor detectie van ANA. Apmis. 2001; 109: 217-222.
- Olaussen E, Rekvig OP. Screeningtests voor antinucleaire antilichamen (ANA): Selectief gebruik van centrale nucleaire antigenen als een rationele basis voor screening door ELISA. J Autoimmun. 1999; 13: 95-102.
- Homburger HA, Cahen YD, Griffiths J, Jacob GL. Detectie van antinucleaire antilichamen: vergelijkende evaluatie van enzym-immunoassay en indirecte immunofluorescentiemethoden. Arch Pathol Lab Med. 1998; 122: 993-999.
- Gniewek RA, Stites DP, McHugh TM, Hilton JF, Nakagawa M. Vergelijking van testmethoden voor antinucleaire antilichamen: immunofluorescentietest versus enzymimmunoassay. Clin Diagn Lab Immunol. 1997; 4: 185-188.
- Reichlin M. Antilichamen tegen DNA, SM en RNP. Actueel. Oktober 2008.
- Hahn BH. Antilichamen tegen DNA. New Engl J Med. 1998; 338: 1359.
- Kavanaugh AF, Solomon DH, het American College of Rheumatology Ad Hoc Committee on Immunologic Testing Guidelines. Richtlijnen voor immunologische laboratoriumtesten bij reumatische aandoeningen: Anti-DNA-antilichaamtesten. Artritis Reum. 2002; 47: 546-555.
- Benito-Garcia E, Schur PH, Lahita R. Richtlijnen voor immunologische laboratoriumtesten bij reumatische aandoeningen: Anti-Sm- en anti-RNP-antilichaamtesten. Artritis Reum. 2004; 51: 1030-1044.
- Reichlin M. Klinische betekenis van anti-Ro / SSA- en anti-La / SSB-antilichamen. Actueel. Oktober 2008.
- Reveille JD, Sherrer YRS, Solomon DH, Schur P, Kavanaugh A. Bewezen richtlijnen voor het gebruik van immunologische laboratoriumtests: Anti-Ro (SS-A) en La (SS- B): Een rapport van de ACR Ad Hoc Committee on Immunological Testing Guidelines. Ingediend voor publicatie.
- Reichlin M. Antiribosomale P-proteïne-antilichamen. Actueel. Oktober 2008.
- Denton CP. Classificatie van sclerodermie. Actueel. Oktober 2008.