Kwaadaardige intravasculaire ontsteking
Sepsis wordt ook wel een proces van kwaadaardige intravasculaire ontsteking genoemd . Normaal gesproken zorgt een krachtige, complexe, immunologische cascade voor een snelle beschermende reactie op de invasie van micro-organismen bij mensen. Door een gebrekkige immunologische afweer kan een infectie ontstaan; een buitensporige of slecht gereguleerde reactie kan echter schade toebrengen aan de gastheer door onaangepaste afgifte van inheems gegenereerde ontstekingsverbindingen (zie de afbeelding hieronder).
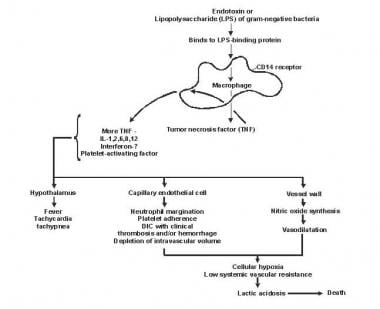 Pathogenese van sepsis en falen van meerdere organen.
Pathogenese van sepsis en falen van meerdere organen. Lipide A en andere bacteriële producten geven cytokines en andere immuunmodulatoren vrij die de klinische manifestaties van sepsis mediëren. Interleukinen, tumornecrosefactor (TNF) -α, interferon-gamma (IFN-γ) en andere kolonie-stimulerende factoren worden snel geproduceerd binnen enkele minuten of uren na interacties van monocyten en macrofagen met lipide A.
Ontstekingsmediatorafgifte wordt een zelfstimulerend proces en afgifte van andere dergelijke mediatoren, waaronder interleukine (IL) -1, plaatjesactiverende factor, IL-2, IL-6, IL-8, IL-10 , en stikstofmonoxide (NO), verhoogt de cytokineniveaus verder. Dit leidt tot voortdurende activering van polymorfonucleaire leukocyten (PMN’s), macrofagen en lymfocyten; pro-inflammatoire mediatoren rekruteren meer van deze cellen. Al deze processen creëren een toestand van destructieve immunologische dissonantie.
Sepsis wordt beschreven als een autodestructief proces dat verlenging van de normale pathofysiologische respons op infectie mogelijk maakt met anderszins normale weefsels en resultaten in MODS. Orgaandisfunctie of orgaanfalen kunnen het eerste klinische teken van sepsis zijn en geen enkel orgaansysteem is immuun voor de gevolgen van de inflammatoire excessen van sepsis. De mortaliteit neemt toe naarmate het orgaanfalen toeneemt.
Hoewel het niet onder controle is, zijn er, zodra MODS zich ontwikkelt, systemisch bewijs van zowel pro-inflammatoire als ontstekingsremmende opregulatie, wat suggereert dat de homeostase van de verdediging van de gastheer mislukt is de laatste weg van sepsis naar MODS, in plaats van eenvoudig door hypotensie geïnduceerd eindorgaanletsel, zoals kan optreden bij hemorragische shock. Overleving van ernstige sepsis met MODS wordt gewoonlijk geassocieerd met een algemene vermindering van zowel de pro-inflammatoire als de ontstekingsremmende respons.
Onlangs is een nieuwe hypothese ontstaan dat overleving na ernstige sepsis een gegeneraliseerde neerwaartse regulering van de immuunrespons van het lichaam, energetische functies en bijbehorende orgaanprestaties. Aldus kan MODS door de adaptieve reactie van de gastheer op een overweldigende ontsteking, de ontsteking laten verdwijnen zonder permanente schade aan het eindorgaan te veroorzaken. Zoals hieronder wordt besproken, vertonen alle organen een gegeneraliseerde hyporesponsiviteit die duidelijk abnormaal is in gezondheid, maar die een overlevingsstrategie kan aangeven bij ernstige sepsis.
Disfunctie van orgaansystemen
Bloedsomloopstoornis
Significante verstoring van de autoregulatie van de bloedsomloop is typerend voor sepsis. Vasoactieve mediatoren veroorzaken vasodilatatie en verhogen de microvasculaire permeabiliteit op de plaats van infectie. NO speelt een centrale rol bij de vasodilatatie van septische shock. Er kan ook een verminderde secretie van vasopressine optreden, waardoor de vasodilatatie kan voortduren.
Veranderingen in zowel systolische als diastolische ventriculaire prestaties treden op bij sepsis. Door het gebruik van het Frank-Starling-mechanisme wordt het hartminuutvolume vaak verhoogd om de bloeddruk op peil te houden in aanwezigheid van systemische vasodilatatie. Patiënten met een reeds bestaande hartziekte zijn niet in staat hun hartminuutvolume op de juiste manier te verhogen.
Regionaal verstoort sepsis de normale verdeling van de systemische bloedstroom naar orgaansystemen. Bijgevolg krijgen kernorganen mogelijk niet de juiste zuurstoftoevoer, en het resultaat is wat bekend staat als regionale hypoperfusie.
Microcirculatie is het belangrijkste doelorgaan voor letsel bij sepsis, aangezien vasculair endotheel is universeel beïnvloed door de circulerende ontstekingsmediatoren. Hoewel het onduidelijk is of microcirculatoire afwijkingen de oorzaak of een onschuldige omstander zijn van het eindorgaanletsel, wordt een duidelijke microvasculaire disfunctie gezien. Er wordt een afname van het aantal geperfundeerde capillairen waargenomen, hoewel bij toepassing van vaatverwijdende therapieën volledige microvasculaire rekrutering optreedt. Mitochondriale disfunctie komt ook voor en wordt vaak geassocieerd met verminderde mitochondriale transmembraanpotentiaalgradiënten, die nodig zijn om oxidatieve fosforylering aan te sturen. Het eindresultaat is een schijnbaar onvermogen van eindorganen om maximaal zuurstof te onttrekken.
Het debat gaat verder over de vraag of dit falen van het energiemetabolisme een adaptief cytoprotectief mechanisme is dat lijkt op winterslaap of een weerspiegeling is van de primaire mitochondriale pathologie. Dit zijn gebieden van actief onderzoek, maar worden momenteel niet vertaald in duidelijke klinische praktijkrichtlijnen. Verhoogde capillaire endotheliale permeabiliteit leidt tot wijdverspreid eiwitrijk weefseloedeem.
Septische shock en SIRS worden gekenmerkt door reversibele myocardiale depressie, die resistent kan blijken te zijn tegen catecholamine en vochttoediening. Circulerende ‘myocard-depressieve factor’ – die waarschijnlijk de synergetische effecten vertegenwoordigt van TNF-α, IL-1β, andere cytokines en NO – is betrokken bij pathogenese. De twee kenmerken van deze acute stress-myocarddepressie zijn een verminderde adrenerge reactievermogen en diastolische disfunctie die leiden tot relatieve catecholamine-resistentie en kleine in plaats van verwijde harten. Macrovasculaire myocardischemie en hypoperfusie dragen onwaarschijnlijk bij.
Bij ernstige sepsis en septische shock veroorzaken microcirculatoire disfunctie en mitochondriale depressie regionale weefselschade, en regionale dysoxie houdt daarom aan. Deze aandoening wordt microcirculatoir en mitochondriaal distress-syndroom (MMDS) genoemd. Sepsis-geïnduceerde inflammatoire autoregulatoire disfunctie blijft bestaan en de zuurstofbehoefte wordt niet geëvenaard door de toevoer, wat leidt tot MODS.
Herverdeling van het intravasculaire vloeistofvolume als gevolg van verminderde arteriële vasculaire tonus, verminderde veneuze terugkeer van veneuze di latie en afgifte van myocard-depressieve stoffen veroorzaakt hypotensie.
Pulmonale disfunctie
Endotheelletsel in het longvatenstelsel leidt tot verstoorde capillaire bloedstroom en verbeterde microvasculaire permeabiliteit, resulterend in interstitieel en alveolair oedeem. Het opsluiten van neutrofielen in de pulmonale microcirculatie initieert en versterkt de beschadiging van de alveolaire capillaire membranen. Acuut longletsel en acuut respiratory distress syndrome (ARDS) zijn frequente manifestaties van deze effecten. Sepsis en longontsteking zijn inderdaad de meest voorkomende oorzaken van ARDS.
Gastro-intestinale stoornissen
Het maagdarmkanaal (GI) kan helpen de verwonding van sepsis te verspreiden. Overgroei van bacteriën in het bovenste deel van het maagdarmkanaal kan in de longen worden opgezogen, waardoor nosocomiale of aspiratiepneumonie ontstaat. De normale barrièrefunctie van de darmen kan worden aangetast, waardoor translocatie van bacteriën, endotoxinen en normale spijsverteringsproteasen naar de systemische circulatie mogelijk wordt en de septische respons wordt verlengd.
Septische shock kan veroorzaken paralytische ileus die kan leiden tot een vertraging bij het instellen van enterale voeding. Overmatige NO-productie wordt verondersteld de veroorzaker te zijn van door sepsis geïnduceerde ileus. Het optimale niveau van voedingsinname wordt verstoord bij hoge eiwit- en caloriebehoeften. Narcotica en spierverslappers kunnen de motiliteit van het maagdarmkanaal verder verslechteren.
Leverdisfunctie
Als gevolg van de rol die de lever speelt bij de verdediging van de gastheer kunnen de abnormale synthetische functies die worden veroorzaakt door leverdisfunctie, bijdragen aan zowel het ontstaan als de progressie van sepsis. Het reticulo-endotheliale systeem van de lever fungeert als een eerste verdedigingslinie bij het opruimen van bacteriën en hun producten; leverfunctiestoornissen leiden tot een overloop van deze producten naar de systemische circulatie.
Leverfalen (‘geschokte lever’) kan zich manifesteren door verhogingen van leverenzymen en bilirubine, stollingsstoornissen en het niet uitscheiden van gifstoffen zoals ammoniak, wat leidt tot verergering van encefalopathie.
Nierfunctiestoornis
Acuut nierletsel (AKI) gaat vaak gepaard met sepsis.Verschillende etiologieën voor AKI zijn gemeld, en men denkt doorgaans dat de oorzaak multifactorieel is. Het mechanisme van AKI is complex, maar omvat waarschijnlijk een afname van het effectieve intravasculaire volume als gevolg van systemische hypotensie, directe renale vasoconstrictie, afgifte van cytokines, en activering van neutrofielen door endotoxinen en andere peptiden, die bijdragen aan nierbeschadiging. Toch laten de meeste dierstudies zien dat de renale bloedstroom bij sepsis toeneemt, niet afneemt, hoewel dit gepaard gaat met een verminderde tubulaire functie en een gebrek aan significant histologisch bewijs van bulair letsel.
Stoornis van het centrale zenuwstelsel
Betrokkenheid van het centrale zenuwstelsel (CZS) bij sepsis veroorzaakt encefalopathie en perifere neuropathie. De pathogenese is slecht gedefinieerd, maar houdt waarschijnlijk verband met systemische hypotensie, wat kan leiden tot hypoperfusie van de hersenen.
Coagulopathie
Subklinische coagulopathie, gesignaleerd door een lichte verhoging van de trombinetijd (TT) of geactiveerde partiële tromboplastinetijd (aPTT) of een matige vermindering van het aantal bloedplaatjes komt zeer vaak voor; er kan zich echter ook openlijk verspreide intravasculaire coagulatie (DIC) ontwikkelen. Protease-geactiveerde receptoren (PAR’s), vooral PAR 1, vormen de moleculaire link tussen coagulatie en ontsteking; PAR1 oefent cytoprotectieve effecten uit wanneer het wordt gestimuleerd door geactiveerd proteïne C of een lage dosis trombine, maar oefent een verstorend effect uit op de endotheelcelbarrièrefunctie wanneer het wordt geactiveerd door een hoge dosis trombine.
Mechanismen van orgaandisfunctie en letsel
De precieze mechanismen van celbeschadiging en resulterende orgaandisfunctie bij sepsis worden niet volledig begrepen. MODS wordt geassocieerd met wijdverspreide endotheel- en parenchymcelbeschadiging, waarvan sommige verklaard kunnen worden door de volgende 4 voorgestelde mechanismen.
Hypoxische hypoxie
De laesie van de septische bloedsomloop verstoort de zuurstofvoorziening van het weefsel, verandert de metabolische regulering van de zuurstofafgifte in het weefsel en draagt bij tot orgaanstoornissen. Microvasculaire en endotheliale afwijkingen dragen bij aan het septische microcirculatiedefect bij sepsis. De reactieve zuurstofspecies, lytische enzymen en vasoactieve stoffen (bijv. NO en endotheliale groeifactoren) leiden tot microcirculatoire schade, die wordt verergerd door het onvermogen van de erytrocyten om door de septische microcirculatie te navigeren.
Directe cytotoxiciteit
Endotoxine, TNF-α en NO kunnen schade aan het mitochondriale elektronentransport veroorzaken, wat leidt tot een verstoord energiemetabolisme. Dit wordt cytopathische of histotoxische anoxie genoemd, een onvermogen om zuurstof te gebruiken, zelfs als deze aanwezig is.
Apoptose
Apoptose ( geprogrammeerde celdood) is het belangrijkste mechanisme waarmee disfunctionele cellen normaal gesproken worden geëlimineerd. De pro-inflammatoire cytokinen kunnen apoptose in geactiveerde macrofagen en neutrofielen vertragen, maar andere weefsels (bijv. Darmepitheel) kunnen versnelde apoptose ondergaan. Daarom speelt verstoring van apoptose een cruciale rol bij de weefselschade van sepsis.
Immunosuppressie
De interactie tussen pro-inflammatoire en ontstekingsremmende mediatoren kunnen tot een onbalans tussen hen leiden. Een ontstekingsreactie of een immuundeficiëntie kan overheersen, of beide kunnen aanwezig zijn.
Gastheerreactie en andere factoren die de uitkomst beïnvloeden
Klinische kenmerken die verband houden met de ernst van sepsis omvatten de reactie van de gastheer op infectie, de plaats en het type infectie, de timing en het type antimicrobiële therapie, het aanstootgevende organisme, de ontwikkeling van shock, de onderliggende ziekte, de gezondheidstoestand van de patiënt op de lange termijn en het aantal mislukte orgels. Factoren die leiden tot sepsis en septische shock zijn mogelijk niet essentieel bij het bepalen van het uiteindelijke resultaat.
De gastheerreactie op sepsis wordt gekenmerkt door zowel pro-inflammatoire reacties als ontstekingsremmende immunosuppressieve reacties. De richting, omvang en duur van deze reacties worden bepaald door zowel gastheerfactoren (bijv. Genetische kenmerken, leeftijd, naast elkaar bestaande ziekten, medicatie) als pathogene factoren (bijv. Microbiële belasting, virulentie).
Ontstekingsreacties worden geïnitieerd door interactie tussen pathogeen-geassocieerde moleculaire patronen uitgedrukt door pathogenen en patroonherkenningsreceptoren uitgedrukt door gastheercellen aan het celoppervlak (tolachtige receptoren en C-type lectine-receptoren), in het endosoom (TLR’s) of in het cytoplasma (retinoïnezuur-induceerbare gen 1-achtige receptoren en nucleotide-bindende oligomerisatiedomein-achtige receptoren).
Het gevolg van overdreven ontsteking is collaterale weefselschade en necrotische celdood, wat resulteert in het vrijkomen van schade-geassocieerde moleculaire patronen, de zogenaamde gevaarmoleculen die in ieder geval de ontsteking in stand houden gedeeltelijk door in te werken op dezelfde patroonherkenningsreceptoren die worden geactiveerd door pathogenen.