US Pharm. 2018; 43 (7): 22-26.
SAMENVATTING: Statines zijn een klasse van medicijnen die veel worden gebruikt voor primaire en secundaire preventie van cardiovasculaire voorvallen. Met zes generiek beschikbare statines, kan de selectie van een geschikt middel worden bepaald op basis van geneesmiddelspecifieke factoren, waaronder doseringsoverwegingen, geneesmiddelinteracties en bijwerkingen. Er kunnen geïndividualiseerde zorgplannen voor patiënten worden ontwikkeld op basis van gegevens uit belangrijke klinische onderzoeken, verschillen in richtlijnen en huidige behandelaanbevelingen voor twee belangrijke bijwerkingen die verband houden met het gebruik van statines.
De hoeksteen van de behandeling van dyslipidemie is het gebruik van 3-hydroxy-3-methylglutaryl-co-enzym A-reductaseremmers, beter bekend als statines. Met een verscheidenheid aan generieke opties op de markt en sterk bewijs dat het gebruik ervan ondersteunt, zijn statines enkele van de meest voorgeschreven medicijnen ter wereld.1 Veelvuldig gebruik van deze middelen heeft echter geleid tot voortdurend onderzoek van hun veiligheid en voortdurende discussie over hun rol in therapie. Dit artikel, dat zich richt op generieke statines, belicht het debat over de rol van statines in therapie, bespreekt het juiste gebruik en onderzoekt bewijsmateriaal rond twee belangrijke bijwerkingen.
Van de zeven verschillende statines op de markt, zes zijn generiek verkrijgbaar (TABEL 1). 2-7 Drie beschikbare merkformuleringen zijn pitavastatine (Livalo), simvastatine orale suspensie (FloLipid) en lovastatine met verlengde afgifte (Altoprev) .8-10 De rol van merkgeneesmiddelen bij therapie is beperkt gezien de brede beschikbaarheid van generieke opties.
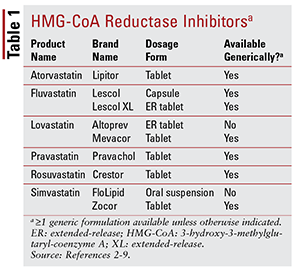
Atorvastatine en simvastatine zijn ook algemeen beschikbaar in verschillende combinatieproducten. Deze omvatten de combinatie van atorvastatine en amlodipine, een calciumkanaalblokker (CCB) geïndiceerd voor hypertensie, en de combinatie van simvastatine en ezetimibe, een intestinale cholesterolabsorptieremmer die ook geïndiceerd is voor hypercholesterolemie.11,12 Gecoformuleerde statine en niacineproducten (niacine / lovastatine en niacine / simvastatine) werden in 2016 van de markt gehaald op basis van een gebrek aan bewijs dat het toevoegen van niacine bij met statines behandelde patiënten de cardiovasculaire (CV) resultaten verder verlaagt dan wat wordt gezien met statines alleen.13
AANBEVELINGEN VOOR DE BEHANDELING
Van statines is herhaaldelijk bewezen dat ze effectief zijn voor het verlagen van LDL-cholesterol (LDL-C) en triglycerideniveaus terwijl het HDL-cholesterol (HDL-C) niveaus verhoogt.14 Bovendien is aangetoond dat ze zinvol verbeteren. patiëntgerichte uitkomsten, zoals grote CV events (CVE’s), bij zowel primaire als secundaire preventie. 15-19
Verschillende veelbesproken behandelrichtlijnen bespreken de rol van statines bij de behandeling van hy perlipidemie. Deze omvatten de richtlijn van de American College of Cardiology / American Heart Association (ACC / AHA) uit 2013 en de richtlijn van de American Academy of Clinical Endocrinology (AACE) uit 2017.14,20 Beide richtlijnen suggereren dat na implementatie van levensstijlwijzigingen, waaronder stoppen met roken, een trainingsregime, en na een hart-gezond dieet, statines zijn eerstelijns therapie voor zowel primaire als secundaire preventie van CV ziekte (HVZ) .14,20 De richtlijnen verschillen echter in hoe te bepalen welke statines geschikt zijn voor welke patiënten.
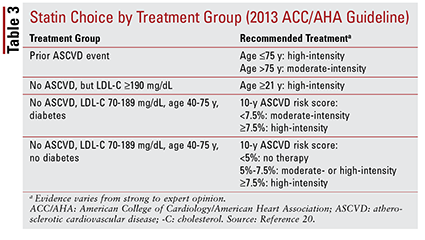
De ACC / AHA-richtlijn uit 2013 introduceerde vier behandelingsgroepen waarop statinetherapie zou moeten worden gericht:
1. Patiënten met eerdere atherosclerotische HVZ (ASCVD), inclusief die met een eerdere gebeurtenis (dwz acute coronaire syndromen, voorgeschiedenis van myocardinfarct, stabiele of instabiele angina, coronaire of andere arteriële revascularisatie, beroerte, voorbijgaande ischemische aanval of perifere arteriële aandoening van atherosclerotische oorsprong).
2. Patiënten zonder voorgeschiedenis van een ASCVD-voorval met een LDL-C-spiegel van 190 mg / dL of hoger. Leeftijd is geen basis voor uitsluiting van dit criterium.
3. Patiënten van 40 tot 75 jaar met diabetes maar zonder voorgeschiedenis van een ASCVD-gebeurtenis en een LDL-C-spiegel tussen 70 en 189 mg / dL.
4. Patiënten van 40 tot 75 jaar zonder diabetes die geen voorgeschiedenis hebben van een ASCVD-gebeurtenis en een LDL-C-spiegel tussen 70 en 189 mg / dL.20
De ACC / AHA-richtlijn introduceerde ook het idee om statines te groeperen naar intensiteit (dwz hun verwachte LDL-C-verlagende vermogen) (TABEL 2) .20 Op basis van de behandelgroep (zoals hierboven gedefinieerd) beveelt de richtlijn specifieke statine-intensiteiten aan voor bepaalde klinische situaties (TABEL 3) .20 Meerdere behandelgroepen vereisen de berekening van een ASCVD-risicoscore met behulp van een ASCVD-risicoschatter. Deze online tool houdt rekening met de leeftijd, het geslacht, het ras, de systolische bloeddruk, het totaal cholesterol, HDL-C en medische voorgeschiedenis van de patiënt die significant is voor de behandeling van hypertensie, diabetes of roken.21 Zodra alle gegevens zijn ingevoerd, worden de 10 -jaarlijks risico op het ervaren van een ASCVD-gebeurtenis wordt berekend.
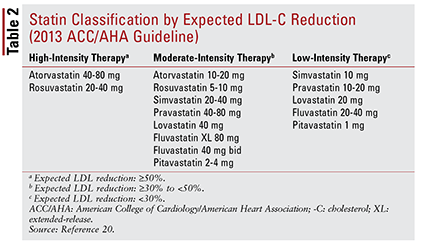
Deze aanbevelingen zijn niet automatisch van toepassing op bepaalde subgroepen van patiënten. Zo dient het gebruik van statines bij oudere volwassenen voorzichtig te worden benaderd. Hoewel statinegebruik voor secundaire preventie bij oudere patiënten significant voordeel oplevert, is het gebruik ervan voor primaire preventie onduidelijk.22-24 Bovendien is gevonden dat patiënten met hartfalen niet dezelfde voordelen ondervinden van statinetherapie als patiënten zonder hartfalen.25 Gebaseerd Op basis van deze bevindingen omvatten de behandelingsaanbevelingen het beperken van de start van statines met hoge intensiteit tot patiënten jonger dan 75 jaar en mogelijk het vermijden van statines bij patiënten met hartfalen.20 Over het algemeen is de beslissing om statines te gebruiken in deze groepen niet eenduidig en zou een lopend gesprek tussen zorgverlener en patiënt over mogelijke risico’s en voordelen van therapie.20
In tegenstelling tot de ACC / AHA-aanbeveling van 2013 om therapie te starten volgens de classificatie van de behandelingsgroep, beveelt de AACE-richtlijn uit 2017 aan dat individuele patiënten worden behandeld op basis van laboratoriumbevindingen.14 Volgens deze richtlijn wordt het patiëntenrisico bepaald door een aantal belangrijke, aanvullende, a en niet-traditionele risicofactoren. Individuen worden vervolgens ingedeeld in een van de vijf risicogroepen, elk met een overeenkomstig LDL-C- en niet-HDL-C-doel (TABEL 4). Op basis van de huidige niveaus en geïndividualiseerde doelen, moeten statines alleen of in combinatie met andere middelen worden gestart op basis van het verwachte LDL-C- of niet-HDL-C-verlagende vermogen.14

Combinatiebehandeling met toevoeging van een tweede middel aan lopende statinetherapie blijft een enigszins controversieel onderwerp. Terwijl eerdere onderzoeken en richtlijnen de toevoeging van andere middelen aan statinetherapie tot een minimum hebben beperkt, ondersteunen recente onderzoeken en consensusverklaringen – waaronder een van de ACC / AHA – het gebruik van ezetimibe, evolocumab of alirocumab, waarvan de laatste twee proproteïne-convertase-subtilisine zijn. / kexin type 9-remmers, als aanvullende therapie voor secundaire preventie.20,26-31 Dat gezegd hebbende, statines blijven universele eerstelijnsbehandeling bij zowel primaire als secundaire preventie; de definitieve rol van andere specifieke middelen blijft onduidelijk.
STATIN SELECTIE
De keuze van statinetherapie begint met de voorkeursbehandeling van de clinicus, of dat de ACC / AHA-methode van statinebehandeling is groepen of de AACE-methode van LDL-C of niet-HDL-C doelen. Van daaruit moet rekening worden gehouden met de eigenschappen van elke statine om de beste optie voor de individuele patiënt te bepalen. Niet alle statines zijn gelijk, en er zijn verschillende belangrijke verschillen die de selectie van de patiënt kunnen beïnvloeden, waaronder doseringsoverwegingen, geneesmiddelinteracties en bijwerkingen (AE’s).
Dosering
Hoewel de meeste statines mogelijk zonder rekening te houden met maaltijden, dient lovastatine met onmiddellijke afgifte (IR) bij het avondeten te worden ingenomen vanwege de verhoogde biologische beschikbaarheid.4 Het tegenovergestelde geldt echter voor lovastatine met verlengde afgifte, dat niet met voedsel mag worden ingenomen vanwege de verminderde biologische beschikbaarheid. .8 Verder, hoewel alle statines eenmaal daags kunnen worden gedoseerd, kunnen IR-fluvastatine en lovastatine tweemaal daags moeten worden toegediend.3,4 Ten slotte, terwijl atorvastatine, pravastatine en rosuvastatine op elk moment van de dag kunnen worden toegediend, kunnen fluvastatine, lovastatine en simvastatine dient ’s avonds te worden ingenomen.3,4,7 Met name simvastatine bleek een significant andere werkzaamheid te hebben als het’ s avonds werd ingenomen dan ’s ochtends.32
Geneesmiddelinteracties
Elke statine heeft verschillende bezorgdheid over geneesmiddel-geneesmiddel- en geneesmiddel-voedselinteracties vanwege de specifieke routes waardoor elk wordt gemetaboliseerd (TABEL 5). Er zijn te veel geneesmiddelinteracties om elk in detail te bespreken; daarom worden er hieronder slechts een paar beschreven.
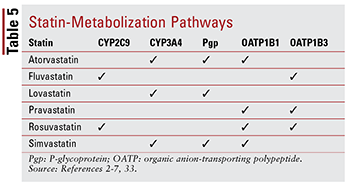
Fibraten: hoewel de combinatie Van een fibraat en een statine is niet aangetoond dat ze de klinische uitkomsten op betekenisvolle wijze veranderen, patiënten kunnen nog steeds gemfibrozil, fenofibraat of fenofibrinezuur krijgen samen met een statine om ernstig ongecontroleerde hypertriglyceridemie aan te pakken.14,20,26,33 Omdat beide klassen zijn geassocieerd met spiergerelateerde toxiciteit, verhoogt combinatietherapie dit risico significant in vergelijking met beide behandelingen alleen.33 Deze additieve toxiciteit wordt vaker gezien bij gemfibrozil dan bij andere fibraten.33 Daarom is het gebruik van gemfibrozil gecontra-indiceerd met simvastatine en moet het worden vermeden met andere statines.7,20 Als een statine en een fibraat samen worden gebruikt, heeft fenofibraat of fenofibrinezuur de voorkeur.20,33 Als gemfibrozil moet worden gebruikt, moet fluvastatine – of, met zorgvuldige controle, atorvastatine of rosuvastatine (maximaal 10 mg per dag ) – is de agent bij uitstek.33
Amiodaron: dit anti-aritmicum geïndiceerd voor ventrikelfibrilleren is een bekende remmer van P-glycoproteïne (Pgp) en het CYP450-enzymsysteem, met name CYP3A4 en, in mindere mate, CYP2C9.33,34 Als een resultaat, zijn er maximale aanbevolen doseringen voor lovastatine (maximaal 40 mg per dag) en simvastatine (maximaal 20 mg per dag) bij gebruik met amiodaron.4,7,33 Hoewel atorvastatine wordt gemetaboliseerd via CYP3A4, is er geen dosisaanpassing nodig (vergelijkbaar met andere statines) omdat gegevens geen ernstige bijwerkingen suggereren wanneer atorvastatine en amiodaron gelijktijdig worden gebruikt.2,33
CCB’s: van zowel dihydropyridine (amlodipine) als nondihydropyridine CCB’s (diltiazem, verapamil) is aangetoond dat ze betekenisvolle geneesmiddelinteracties hebben met statines . Net als amiodaron, remmen amlodipine, diltiazem en verapamil CYP3A4.33,35-37 Amlodipine heeft ook een remmend effect op Pgp.33,35 Op basis van in de literatuur gerapporteerde bijwerkingen wordt een maximale dagelijkse dosering van 20 mg lovastatine aanbevolen wanneer gebruikt met amlodipine, diltiazem of verapamil.4,33 Het wordt ook aanbevolen om simvastatine niet meer dan 20 mg te gebruiken bij gebruik met amlodipine, maar een lagere dosis van 10 mg dient te worden toegediend bij gebruik met diltiazem en verapamil.7,33 Geen specifieke dosering aanbevelingen zijn er met atorvastatine, hoewel voorzichtigheid geboden is wanneer het wordt toegediend met een van de niet-dihydropyridine CCB’s.2,33
Bijwerkingen op het geneesmiddel
Statines worden over het algemeen goed verdragen; het aantal stopzettingen blijft echter hoog.38 Het staken van de statinetherapie en het niet hervatten van de statinetherapie na het optreden van bijwerkingen zijn geassocieerd met een verhoogd aantal CVE’s.39 De zorgen van patiënten over de veiligheid van statines in het licht van twee belangrijke statinegerelateerde bijwerkingen: myotoxiciteit en nieuwe diabetes – kan leiden tot stopzetting van statines.
Myotoxiciteit: Statines worden al lang in verband gebracht met spiergerelateerde toxiciteit, waaronder myalgie (spierpijn zonder verhoogde creatinekinase), myopathie (algemene term voor ziekte) en myositis (spierontsteking), waarvan de laatste twee significante CK-verhogingen met zich meebrengen.40,41 Alle statines delen een waarschuwing voor de zeldzame maar ernstige bijwerking van rabdomyolyse.2-7 Vaak wordt echter myotoxiciteit toegeschreven aan statines vanwege het nocebo-effect; dat wil zeggen, een persoon gelooft dat een medicijn schade zal veroorzaken en vervolgens veroorzaakt het medicijn de verwachte schade.42,43 Daarom moeten apothekers, om het beste resultaat te garanderen, goed thuis zijn in deze vaak gemelde bijwerking en het juiste beheer ervan.
Het is onjuist om aan te nemen dat alle meldingen van spiersymptomen het gevolg zijn van het nocebo-effect; goed doorlichten van de medische geschiedenis van de patiënt (PMH), beschrijving van de pijn en associatie met statinetherapie is noodzakelijk.44 Ten eerste stelt een onderzoek van PMH op CK-verhogingen en andere mogelijke oorzaken van spierpijn of spierzwakte de arts in staat alternatieve onderliggende pathofysiologie of correcte factoren die het statinemetabolisme kunnen veranderen. Veelvoorkomende oorzaken zijn onder meer ouderdom, geneesmiddelinteracties, verminderde nier- of leverfunctie, verhoogde fysieke activiteit en vitamine D-tekort.20,41
Vervolgens moet de arts de presentatie van de patiënt vergelijken met vaak voorkomende statine-geïnduceerde symptomen. . Door statine geïnduceerde spiertoxiciteit presenteert zich meestal als pijn, gevoeligheid, krampen en zwakte, meestal in de beenspieren.20,41 Deze symptomen zijn doorgaans erger na inspanning en verdwijnen niet zonder stopzetting van het aanstootgevende middel.41
De laatste stap is om te bepalen of er een causaal verband bestaat tussen symptomen en statinegebruik. Wanneer wordt vermoed dat een statine de oorzaak is van milde tot matige symptomen, wordt tijdelijke stopzetting aanbevolen. Als de symptomen na ongeveer 2 weken niet verdwijnen, is de statine waarschijnlijk niet de oorzaak en moet opnieuw worden gestart met de oorspronkelijke dosis. Als de symptomen echter verdwijnen, moet een nieuw onderzoek met dezelfde statine met dezelfde of een lagere dosis worden uitgevoerd. Als vergelijkbare symptomen optreden, moet worden aangenomen dat de statine de oorzaak is en moet deze worden stopgezet. Zodra de symptomen zijn verdwenen, moet een lage dosis van een alternatieve statine worden gestart en getitreerd tot de maximaal getolereerde dosis.20,41 Acceptatie door de patiënt en begrip van dit proces zijn belangrijk omdat het nocebo-effect anders kan leiden tot verdere waargenomen reacties.
Er bestaan verschillende andere strategieën om deze symptomen te beheersen en te voorkomen. Ten eerste kan de arts, omdat de kans op symptomen groter is, ervoor kiezen om de meest lipofiele statines (lovastatine en simvastatine) te vermijden ten gunste van meer hydrofiele statines (fluvastatine, pravastatine en rosuvastatine) .44 Simvastatine 80 mg mag nooit als nieuw worden gestart. therapie bij elke patiënt vanwege een ongewoon hoge frequentie van statine-geassocieerde spiersymptomen.7,45 Alternatieve therapieën, zoals co-enzym Q10, hebben geen consistent voordeel aangetoond, maar kunnen worden overwogen bij patiënten met psychologisch geïnduceerde symptomen.41,44,46 Ten slotte kan een dosering met een verlengde interval, waarbij statinegeneesmiddelen meerdere keren per week in plaats van eenmaal daags worden toegediend, worden overwogen. Deze benadering verbetert de therapietrouw en lipidenprofielen bij patiënten met eerdere statine-intolerantie.47-49
Nieuw begonnen diabetes: een belangrijke bijwerking die verband houdt met het gebruik van statines is nieuw begonnen diabetes. Van statines is aangetoond dat ze het risico op diabetesontwikkeling verhogen, hoewel er verschillende belangrijke kanttekeningen zijn.50 Ten eerste, hoewel dit als een soort klasse-effect kan worden beschouwd, is het werkelijke risico van elke specifieke statine nog steeds onbekend.51,52 In de grootste meta -analyse tot op heden, pravastatine had het laagste risico, simvastatine en atorvastatine hadden een matig risico en rosuvastatine had het hoogste risico op het veroorzaken van nieuw ontstane diabetes.53 Geen van deze bevindingen was echter statistisch significant.53 Bovendien was de bevinding dat diabetes Het risico neemt toe naarmate de dosis statine stijgt, is inconsistent.54
Door statine geïnduceerde diabetes komt het meest voor bij personen die al een hoog risico lopen om diabetes te ontwikkelen.50,54 Dit omvat oudere patiënten en patiënten met prediabetes of metabole syndroom.50,55 Een consistente bevinding is dat, voor elk nieuw geval van diabetes veroorzaakt door statines, meerdere CVE’s kunnen worden voorkomen bij patiënten met een hoger risico.50 Daarom zouden apothekers een xious statinegebruikers met een matig of hoog risico op CV complicaties dat het risico op het ontwikkelen van diabetes meer dan gecompenseerd wordt door de CV risico-reductie voordelen. De risico-batenverhouding is echter onduidelijk bij patiënten met een zeer laag risico op CVE’s.50
CONCLUSIE
Hoewel statinetherapie niet zonder risico’s is, zijn de voordelen bij het verminderen van CV uitkomsten maakte het tot de hoeksteen van CVE-preventie. Beschikbare richtlijnen lopen sterk uiteen, maar de enige constante is dat statines bij bijna elke patiënt eerstelijnsbehandeling moeten zijn voor primaire en secundaire preventie. De wijdverspreide generieke beschikbaarheid van statines heeft deze middelen steeds toegankelijker gemaakt. Door te begrijpen dat niet alle statines hetzelfde zijn, kan de apotheker helpen zorgen voor het best mogelijke resultaat voor elke patiënt.
1. IMS Institute for Healthcare Informatics. Medicijngebruik en -uitgaven in de VS: een overzicht van 2015 en vooruitzichten voor 2020. https://morningconsult.com/wp-content/uploads/2016/04/IMS-Institute-US-Drug-Spending-2015.pdf. Toegang tot 18 maart 2018.
2. Lipitor (atorvastatine) bijsluiter. New York, NY: Pfizer, Inc; Juni 2017.
3. Lescol / Lescol XL (fluvastatine) bijsluiter. East Hanover, NJ: Novartis Pharmaceuticals Corp; Augustus 2017.
4. Bijsluiter van Mevacor (lovastatine). Whitehouse Station, NJ: Merck & Co, Inc; Februari 2014.
5. Pravachol (pravastatine) bijsluiter. Princeton, NJ: Bristol-Myers Squibb Company; Juli 2016.
6. Crestor (rosuvastatine) bijsluiter. Wilmington, DE: AstraZeneca Pharmaceuticals LP; Augustus 2017.
7. Zocor (simvastatine) bijsluiter. Whitehouse Station, NJ: Merck & Co, Inc; Februari 2015.
8. Altoprev (lovastatin) bijsluiter. Zug, Zwitserland: Covis Pharma; April 2017.
9. FloLipid (simvastatine) bijsluiter. Brooksville, FL: Salerno Pharmaceuticals LP; Juli 2017.
10. Livalo (pitavastatine) bijsluiter. Montgomery, AL: Kowa Pharmaceuticals America, Inc; November 2016.
11. Caduet (amlodipine / atorvastatine) bijsluiter. New York, NY: Pfizer Inc; Oktober 2017.
12. Vytorin (ezetimibe / simvastatine) bijsluiter. Whitehouse Station, NJ: Merck & Co, Inc; Februari 2018.
13. AbbVie Inc .; intrekking van goedkeuring van nieuwe medicijnaanvragen voor Advicor en Simcor. www.federalregister.gov/documents/2016/04/18/2016-08894/abbvie-inc-withdrawal-of-approval-of-new-drug-applications-for-advicor-and-simcor. Toegang tot 18 maart 2018.
14. Jellinger PS, Handelsman Y, Rosenblit PD, et al. Richtlijnen van de American Association of Clinical Endocrinologists en American College of Endocrinology voor het beheer van dyslipidemie en de preventie van hart- en vaatziekten. Endocr Pract. 2017; 23 (suppl 2): 1-87.
15. LaRosa JC, Grundy SM, Waters DD, et al. Intensieve lipideverlaging met atorvastatine bij patiënten met stabiele coronaire aandoeningen. N Engl J Med. 2005; 352: 1425-1435.
16. Ridker PM, Danielson E, Fonseca FA, et al. Rosuvastatine ter voorkoming van vasculaire voorvallen bij mannen en vrouwen met verhoogd C-reactief proteïne. N Engl J Med. 2008; 359: 2195-2207.
17. Mihaylova B, Emberson J, Blackwell L, et al. De effecten van het verlagen van LDL-cholesterol met statinetherapie bij mensen met een laag risico op vaatziekten: meta-analyse van individuele gegevens uit 27 gerandomiseerde onderzoeken. Lancet. 2012; 380: 581-590.
18. Baigent C, Landray MJ, Reith C, et al. De effecten van het verlagen van LDL-cholesterol met simvastatine plus ezetimibe bij patiënten met chronische nierziekte (Study of Heart and Renal Protection): een gerandomiseerde, placebogecontroleerde studie. Lancet. 2011; 377: 2181-2192.
19. Cannon CP, Braunwald E, McCabe CH, et al.Intensieve versus matige lipideverlaging met statines na acute coronaire syndromen. N Engl J Med. 2004; 350: 1495-1504.
20. Stone NJ, Robinson JG, Lichtenstein AH, et al. 2013 ACC / AHA-richtlijn voor de behandeling van cholesterol in het bloed om het atherosclerotische cardiovasculaire risico bij volwassenen te verminderen: een rapport van de American College of Cardiology / American Heart Association Task Force on Practice Guidelines. Circulatie. 2014; 129 (25 suppl 2): S1-S45.
21. American College of Cardiology. ASCVD-risicoschatter Plus. http://tools.acc.org/ASCVD-Risk-Estimator. Toegang tot 18 maart 2018.
22. Wenger NK, Lewis SJ, Herrington DM, et al. Resultaten van het gebruik van hoge of lage doses atorvastatine bij patiënten van 65 jaar of ouder met stabiele coronaire hartziekte. Ann Intern Med. 2007; 147: 1-9.
23. Shepherd J, Blauw GJ, Murphy MB, et al. Pravastatine bij oudere personen met risico op vaatziekte (PROSPER): een gerandomiseerde gecontroleerde studie. Lancet. 2002; 360: 1623-1630.
24. Teng M, Lin L, Zhao YJ, et al. Statines voor primaire preventie van hart- en vaatziekten bij oudere patiënten: systematische review en meta-analyse. Drugs veroudering. 2015; 32: 649-661.
25. Kjekshus J, Apetrei E, Barrios V, et al. Rosuvastatine bij oudere patiënten met systolisch hartfalen. N Engl J Med. 2007; 357: 2248-2261.
26. Ginsberg HN, Elam MB, Lovato LC, et al. Effecten van combinatielipidetherapie bij diabetes mellitus type 2. N Engl J Med. 2010; 362: 1563-1574.
27. Kastelein JJ, Akdim F, Stroes ES, et al. Simvastatine met of zonder ezetimibe bij familiaire hypercholesterolemie. N Engl J Med. 2008; 358: 1431-1443.
28. Cannon CP, Blazing MA, Giugliano RP, et al. Ezetimibe toegevoegd aan statinetherapie na acute coronaire syndromen. N Engl J Med. 2015; 372: 2387-2397.
29. Sabatine MS, Giugliano RP, Keech AC, et al. Evolocumab en klinische resultaten bij patiënten met hart- en vaatziekten. N Engl J Med. 2017; 376: 1713-1722.
30. Lloyd-Jones DM, Morris PB, Ballantyne CM, et al. Gerichte update 2017 van de ACC Expert Consensus Decision Pathway uit 2016 over de rol van niet-statinetherapieën voor LDL-cholesterolverlaging bij het beheer van het risico op atherosclerotische cardiovasculaire ziekten: een rapport van de American College of Cardiology Task Force over Expert Consensus Decision Pathways. J Am Coll Cardiol. 2017; 70: 1785-1822.
31. ODYSSEY Resultaten: resultaten suggereren dat het gebruik van PCSK9-remmer CV events vermindert, LDL-C bij ACS-patiënten. American College of Cardiology. www.acc.org/latest-in-cardiology/articles/2018/03/05/15/53/sat-9am-odyssey-outcomes-cv-outcomes-with-alirocumab-after-acs-acc-2018. Toegang tot 20 juni 2018.
32. Wallace A, Chinn D, Rubin G.Simvastatine ’s ochtends gebruiken in vergelijking met’ s avonds: gerandomiseerde gecontroleerde studie. BMJ. 2003; 327: 788.
33. Wiggins BS, Saseen JJ, pagina RL, et al. Aanbevelingen voor het beheer van klinisch significante geneesmiddelinteracties met statines en geselecteerde middelen die worden gebruikt bij patiënten met hart- en vaatziekten: een wetenschappelijke verklaring van de American Heart Association. Circulatie. 2016; 134: e468-e495.
34. Pacerone (amiodaron) bijsluiter. Maple Grove, MN: Upsher-Smith Laboratories LLC; Juli 2017.
35. Bijsluiter van Norvasc (amlodipine). New York, NY: Pfizer Inc; Oktober 2017.
36. Cardizem (diltiazem) bijsluiter. Bridgewater, NJ: Valeant Pharmaceuticals; November 2016.
37. Calan (verapamil) bijsluiter. New York, NY: Pfizer Inc; September 2017.
38. Riaz H, Khan AR, Khan MS, et al. Meta-analyse van placebogecontroleerde gerandomiseerde gecontroleerde onderzoeken naar de prevalentie van statine-intolerantie. Ben J Cardiol. 2017; 120: 774-781.
39. Zhang H, Plutzky J, Shubina M, Turchin A. Vervolg statinevoorschriften na bijwerkingen en uitkomsten voor de patiënt: een cohortonderzoek. Ann Intern Med. 2017; 167: 221-227.
40. Tomaszewski M, Stepien KM, Tomaszewska J, Czuczwar SJ. Door statine geïnduceerde myopathieën. Pharmacol Rep. 2011; 63: 859-866.
41. Stroes ES, Thompson PD, Corsini A, et al. Statine-geassocieerde spiersymptomen: impact op statinetherapie — Verklaring van het consensuspanel van de European Atherosclerosis Society over beoordeling, etiologie en management. Eur Heart J. 2015; 36: 1012-1022.
42. Gupta A, Thompson D, Whitehouse A, et al. Bijwerkingen geassocieerd met niet-geblindeerde, maar niet met geblindeerde, statinetherapie in de Anglo-Scandinavian Cardiac Outcomes Trial – Lipid-Lowering Arm (ASCOT-LLA): een gerandomiseerde dubbelblinde, placebo-gecontroleerde studie en de niet-gerandomiseerde niet-blinde extensie fase. Lancet. 2017; 389: 2473-2481.
43. Pedro-Botet J, Rubiés-Prat J. Met statine geassocieerde spiersymptomen: pas op voor het nocebo-effect. Lancet. 2017; 389: 2445-2446.
44. Laufs U, Filipiak KJ, Gouni-Berthold I, et al. Praktische aspecten bij de behandeling van statine-geassocieerde spiersymptomen (SAMS). Atheroscler Suppl. 2017; 26: 45-55.
45. FDA Drug Safety Communication: nieuwe beperkingen, contra-indicaties en dosisbeperkingen voor Zocor (simvastatine) om het risico op spierletsel te verminderen. www.fda.gov/Drugs/DrugSafety/ucm256581.htm. Toegang tot 18 maart 2018.
46.Banach M, Serban C, Sahebkar A, et al. Effecten van co-enzym Q10 op statine-geïnduceerde myopathie: een meta-analyse van gerandomiseerde gecontroleerde onderzoeken. Mayo Clin Proc. 2015; 90: 24-34.
47. Goldberg AS, DeGorter MK, Ban MR, et al. Werkzaamheid en plasmaconcentraties van het geneesmiddel bij niet-dagelijkse dosering van rosuvastatine. Kan J Cardiol. 2013; 29: 915-919.
48. Matalka MS, Ravnan MC, Deedwania PC. Is een alternatieve dagelijkse dosis atorvastatine effectief bij de behandeling van patiënten met hyperlipidemie? De alternatieve dag versus dagelijkse dosering van atorvastatinestudie (ADDAS). Am Heart J. 2002; 144: 674-677.
49. Copher HR, Stewart RD. Dagelijkse dosering versus dosering van simvastatine om de dag bij patiënten met hypercholesterolemie. Farmacotherapie. 2002; 22: 1110-1116.
50. Rochlani Y, Kattoor AJ, Pothineni NV, et al. Balanceren tussen primaire preventie en statine-geïnduceerde diabetes mellituspreventie. Ben J Cardiol. 2017; 120: 1122-1128.
51. Corrao G, Ibrahim B, Nicotra F, et al. Statines en het risico op diabetes: bewijs uit een grote populatie-gebaseerde cohortstudie. Diabetes Zorg. 2014; 37: 2225-2232.
52. Lim S, Oh PC, Sakuma I, Koh KK. Hoe de cardiorenometabole voordelen en risico’s van statines in evenwicht te brengen Atherosclerose. 2014; 235: 644-648.
53. EP van Navarese, Buffon A, Andreotti F, et al. Meta-analyse van de impact van verschillende soorten en doses statines op nieuw opkomende diabetes mellitus. Ben J Cardiol. 2013; 111: 1123-1130.
54. Crandall JP, Mather K, Rajpathak SN, et al. Statinegebruik en risico op het ontwikkelen van diabetes: resultaten van het Diabetes Preventieprogramma. BMJ Open Diabetes Res Care. 2017; 5: e000438.
55. Ganda OP. Door statine geïnduceerde diabetes: incidentie, mechanismen en implicaties. F1000Res. 2016; 5.