US Pharm. 2013; 38 (11) (Supliment oncologic): 3-6.
REZUMAT: Anemia este o complicație frecventă la pacienții bolnavi de cancer. Poate fi cauzată fie de tumora în sine, fie de regimul tehoterapeutic utilizat. Severitatea și prevalența condiției variază în funcție de o serie de factori. Tratamentul vizează creșterea capacității de transport a oxigenului din sânge, reducerea oboselii și îmbunătățirea calității generale a vieții pacientului. Au fost recomandați agenți de stimulare a eritropoiezei, suplimentarea cu fier și transfuzii de celule roșii în diferite condiții. Deși acestea s-au dovedit benefice la unii pacienți, modalitatea terapeutică optimă nu este încă stabilită.
Anemia este o cauză majoră de morbiditate la pacienții cu cancer, legată de performanțe fizice slabe, prognostic și rezultate terapeutice.1. OMS), anemia este definită ca un nivel de hemoglobină (Hb) de < 12 g / dL la femeile care nu sunt gravide și < 13 g / dL la bărbați ≥15 ani.2
Epidemiologie
Anemia este una dintre cele mai frecvente manifestări la pacienții bolnavi de cancer. De fapt, s-a demonstrat că 30% până la 90% dintre toți pacienții cu cancer sunt anemici, cifră care depinde de tipul de cancer și de definiția anemiei utilizate.3 Incidența și severitatea anemiei depind de o serie de factori, care sunt listate în TABELUL 1.4,5

Etiologie
Principala cauză a anemiei la pacienții cu cancer este dublă: cancerul în sine și terapia utilizată pentru gestionarea cancerului. Celulele canceroase care se infiltrează în măduva osoasă pot suprima direct hematopoieza și pot provoca anemie. Mai mult, celulele canceroase eliberează citokine care pot duce la sechestrarea fierului, reducând producția de celule roșii din sânge (globule roșii). Tumorile pot duce la pierderi cronice de sânge de la locul tumorii, ducând la anemie progresivă din cancer și organdamaj.6
Această problemă este agravată de pierderi de sânge, deficiențe nutriționale, hemoliză, tulburări endocrine, boli ereditare, insuficiență renală sau prezența citokinelor inflamatorii asociate cu cancerele și bolile cronice.4,6 Pacienții cu cancer tind să-și piardă pofta de mâncare, ducând la deficiențe nutriționale. La pacienții cu tumori gastrointestinale (GI), malabsorbția nutrienților duce, de asemenea, la deficiențe. Hemoliza rezultă din anticorpi imun-mediați sau schimbări ale capacității de coagulare. Ca urmare, anemia este o comorbiditate frecventă la pacienții diagnosticați recent cu cancer. Aproape jumătate dintre pacienții diagnosticați cu cancer ginecologic și o treime dintre pacienții diagnosticați cu limfom non-Hodgkin au anemie la diagnostic.
Mai mult, mielosupresia este unul dintre efectele secundare ale chimioterapiei și un factor semnificativ care contribuie la anemie. . Radioterapia la nivelul scheletului provoacă, de asemenea, toxicitate hematologică și, prin urmare, anemie. funcție, amețeli și insuficiență cardiacă.7,8
Diagnostic
Amploarea problemei anemiei la pacienții cu cancer este amplificată prin măsuri de diagnostic suboptimale, lipsa unei definiții standard și faptul că cauza este adesea multifactorială. 6,9 Trebuie luată o istorie detaliată care să înregistreze durata și timpul până la debutul simptomelor, prezența afecțiunilor comorbide, istoricul familial și istoricul expunerii la medicamente antineoplazice și radiații. Trebuie efectuat un examen fizic pentru a verifica sincopa, dispneea de exercițiu, cefaleea, vertijul, durerea toracică, oboseala, menstruația anormală la femele și palorul.6
Rețeaua Națională de Cancer Comprehensive recomandă efectuarea aCBC pentru pacienții cu un Hb < 11 g / dL sau o reducere a numărului de Hb de 2 g / dL. Acest lucru este util pentru a determina dacă citopeniile sunt prezente. Se recomandă, de asemenea, o analiză vizuală a frotiului de sânge periferic pentru a confirma dimensiunea, forma și culoarea eritrocitelor.6
Fiziopatologie
Anemia este rezultatul unei combinații de eritrocite circulante scăzute , volum redus de celule ambalate și niveluri reduse de Hb.6 Acest lucru poate apărea prin diferite mecanisme fiziopatologice, inclusiv pierderea excesivă de sânge, distrugerea crescută a globulelor roșii și diminuarea eritropoiezei. fierul este esențial pentru eritropoieză. Eritropoietina controlează tematurarea, diferențierea și supraviețuirea celulelor eritroide în timpul acestui proces. fier disponibil forerythropoiesis.Metabolismul alterat al fierului este cauzat în primul rând de hepcidină, o proteină care scade absorbția fierului în intestine, precum și eliberarea de fier de către macrofage. Producția de hepcidină este crescută de citokinele eliberate din tumori, scăzând astfel cantitatea de fier care circulă. De asemenea, sa demonstrat că producția de citokine, cum ar fi interleukina (IL) -6, este crescută de anumite regimuri chimioterapeutice.5 Ciclurile repetate de chimioterapie pot agrava reducerea cumulativă a eritropoiezei.
celulele țesutului corpului devin hipoxice, rezultând o serie de răspunsuri fiziologice pe măsură ce organismul încearcă să câștige sau să mențină oxigenarea țesuturilor.
Se crede că utilizarea normală a pacienților cu cancer cu fier poate fi întreruptă de o interacțiune între celulele tumorale și propriul sistem imunitar al gazdei. Această interacțiune conduce la reglarea în sus a citokinelor inflamatorii specifice, cum ar fi IL-1, gammainterferon și factorul de necroză tumorală alfa (TNF-α), care a scăzut diferențierea precursorilor eritroizi în măduva osoasă, interferează cu utilizarea normală a fierului și inhibă hipoxia normală. producția de motoritropoietină. Agenții chimioterapeutici nefrotoxici pot agrava problema provocând insuficiență renală.
În anemia cronică, tumorile au eliberat factorul inductor al ananemiei, o moleculă care reduce durata de viață a eritrocitelor. Acest lucru agravează anemia până la punctul în care eritropoiesul nu compensează supraviețuirea inferioară a globulelor eritrocitare.12
Factorii de risc pentru anemia în cancer
Au fost identificați următorii factori de risc pentru anemia în cancer9:
- Chimioterapia mielosupresivă sau radioterapia
- Niveluri scăzute de Hb (10-12 g / dL) la inițierea chimioterapiei citotoxice
- Administrarea de platină- care conține regimuri, ceea ce crește, de asemenea, necesitatea sprijinului transfuzional.
Tratamentul
Pe lângă o îmbunătățire generală a calității vieții pacientului, tratamentul anemiei este esențial Anemia compromite livrarea unor cantități suficiente de oxigen către toate celulele, inclusiv celulele tumorale.7 Deoarece oxigenarea redusă a țesuturilor este asociată cu o sensibilitate redusă a tumorilor la radiații și alte forme de chimioterapie, eficacitatea acestor tratamente este redusă în anemie.13,14
Scopul terapiei ar trebui să fie creșterea oxigen-carryinei g capacitatea sângelui și tratarea cauzei de bază. Condițiile subiacente, cum ar fi deficiențele nutriționale, sunt mai ușor de tratat decât altele, cum ar fi pierderea de sânge ocultă. Există diverse opțiuni disponibile pentru gestionarea pacienților cu cancer cu anemie. Acestea includ15:
- Terapie suplimentară adecvată cu acid folic și / sau vitamina B12 pentru corectarea deficiențelor nutriționale
- Agenți de stimulare a eritropoiezei (ESA)
- Suplimentare cu fier
- Transfuziile de sânge, care sunt indicate pentru pacienții cu pierderi acute de sânge severe. Pentru pacienții a căror anemie este cronică, sunt preferați agenții eritropoietici. dezvoltat în mod tradițional pentru gestionarea anemiei la pacienții cu insuficiență renală cronică. Au demonstrat eficacitate și limitări similare atunci când au fost utilizate doze incomparabile la pacienții cu cancer cu anemie. 5 ASE sunt indicate pentru gestionarea pacienților ale căror niveluri endogene de EPO sunt extrem de scăzute, deoarece modul de acțiune al ESA și efectele imunologice și hematologice sunt similare cu cele ale EPO endogenă. efectuate pe rHuEPO au arătat că îmbunătățește nivelurile și calitatea vieții pacienților și scade cerințele de transfuzie.15,16 S-a propus ca ASE să îmbunătățească și funcția cognitivă a pacienților care primesc chimioterapie.17
efectuat de Societatea Americană a Cancerului a arătat că beneficiul clinic optim al tratamentului eritropoietic al anemiei induse de chimioterapie poate fi obținut prin intervenție timpurie.18 Există în mod clar un beneficiu al utilizării ESA; cu toate acestea, toate celelalte cauze ale anemiei trebuie investigate și corectate înainte de utilizarea ESAtherapy.
Darbepoetin și rHuEPO sunt ambele indicate pentru tratamentul anemiei la pacienții cu tumori maligne nonmieloide în whomanemia este legată de chimioterapie.5 Societatea Americană de Hematologie (ASH) și Societatea Americană de Oncologie Clinică (ASCO) recomandă inițierea tratamentului atunci când nivelurile de Hb scad sub 10 g / d. Doza trebuie redusă dacă există o creștere minimă de 1 g / dL în Hblevels cu 2 săptămâni.19 Scopul terapiei ar trebui să fie toraise Hb la concentrația cea mai mică pentru a evita transfuzia. Dacă creșterea minimă de 1 până la 2 g / dL de Hb nu se realizează după 6 până la 8 săptămâni de tratament, terapia ESA trebuie oprită.18 Deși este dificil să se prevadă răspunsul pacientului la aceste terapii cu datele actuale, s-a demonstrat că aproximativ 50% până la 60% dintre pacienți demonstrează o creștere de 2 g / dl a Hb atunci când este tratat cu rHuEPO.9 Terapia ESA trebuie întreruptă la finalizarea tratamentului cursul de chimioterapie.20,21
Doza recomandată pentru darbepoetină alfa este de 2,25 mcg / kg ca o injecție subcutanată săptămânală (SC). Dacă nivelurile de Hb nu cresc cu cel puțin 1 g / dL după 6 săptămâni, doza trebuie crescută la 4,5 mcg / kg. Dacă nivelurile de Hb cresc mai mult de 1 g / dL într-o perioadă de 2 săptămâni sau dacă Hb depășește 12 g / dL, doza de darbepoetină trebuie redusă cu 40% .20 Darbepoetina trebuie oprită dacă nivelurile de Hb cresc peste 13 g / dL. 9
Doza recomandată de rHuEPO este de 40.000 U administrată SC o dată pe săptămână sau 150 U / kg administrată SC de trei ori pe săptămână la pacienții internați ai căror niveluri de Hb sunt sub 10 g / dL. Doza de rHuEPO ar trebui redusă cu 25% dacă nivelul de Hb crește > 1 g / dL în orice perioadă de 2 săptămâni sau atinge nivelul necesar pentru a evita transfuzia RBC.21
ASE sunt ambalate într-un flacon care nu trebuie agitat, deoarece se vor denatura.20,21. Conținutul flaconului nu trebuie diluat sau combinat.
Riscurile terapiei ESA ar trebui, de asemenea, să fie luat in considerare. Se consideră că ASE cresc acțiunile cardiovasculare adverse, măresc riscul de tromboembolism venos, scurtează timpul de progresie a totumului și reduc supraviețuirea la pacienții cu cancer anemic prin mecanisme diferite.22,23 Din acest motiv, utilizarea ESAsis este descurajată la pacienții cu cancer care nu suferă tratament cu chimioterapie sau radioterapie.24 Toate ESA-urile vin cu o avertizare cutie neagră cu privire la creșterea riscului de deces, infarct miocardic, accident vascular cerebral, tromboembolism venos, tromboză a accesului vascular și progresie și recurență a tumorii.20,21 Programul oncologic ESA APPRISE a fost creat de FDA să consilieze pacienții, îngrijitorii și profesioniștii din domeniul sănătății cu privire la utilizarea în condiții de siguranță a ESA.25
Suplimentarea cu fier: Suplimentarea cu fier, de preferință parenterală, este indicată la pacienții cu nivel scăzut de oferritină (< 30 ng / mL), saturația transferinei (TSAT < 15%) și scăzută (< 26 pg / celulă ) reticulocit Hb conten t (CHr). Două tipuri de irondeficiență au fost recunoscute la pacienții cu cancer anemic:
- Deficitul de fier absolut (SIDA) care apare cu sângerări cronice datorate, de exemplu, leziunilor GI sau ginecologice, pierderii de sânge din operații, nutrițional deficiențe și anemie a bolilor cronice (DCA). Este definit ca un nivel seric de feritină de < 30 mcg / L și TSAT scăzut de < 15% .1
- Deficitul funcțional de fier (FID) care apare după utilizarea continuă a eritropoietinei. Este cea mai frecventă cauză a unui răspuns inadecvat la terapia ESA, în special la pacienții cu insuficiență renală. Prin urmare, majoritatea pacienților tratați cu ESA vor necesita în cele din urmă suplimentarea cu fier.6
Suplimentarea cu fier a fost introdusă atunci când terapia ESA singură a demonstrat rate scăzute de răspuns la pacienții tratați cu chimioterapie.1. Eficacitatea unei combinații de IV s-a testat terapia cu fier și ESA și s-a stabilit rolul fierului în deficiența funcțională a fierului.1 În timp ce dovezile actuale susțin utilizarea suplimentului de fier IV pentru a îmbunătăți răspunsurile hemoglobinei la pacienții anemici cu cancer, sunt necesare studii prospective privind eficacitatea pe termen lung și siguranța fierului IV. Mai mult, trebuie stabilite regimuri de dozare optime.5
Fierul poate fi administrat oral sau ca formulări parenterale de dextran de fier cu greutate moleculară mică (LMW), fericgluconat și zaharoză de fier. Fierul administrat parenteral are un răspuns mai înalt în comparație cu fierul oral.6 Prin urmare, acesta din urmă este rar utilizat la pacienții cu cancer cu anemie și nu este discutat în acest articol. Dozele de testare sunt recomandate pentru dextranul de fier. Pacienților care au prezentat sensibilități anterioare la fierul dextran sau alte preparate din fier IV sau celor care au alergii multiple la medicamente trebuie să li se administreze și o doză de testare. TABELUL 2 prezintă regimul de dozare pentru suplimentarea cu fier IV.6
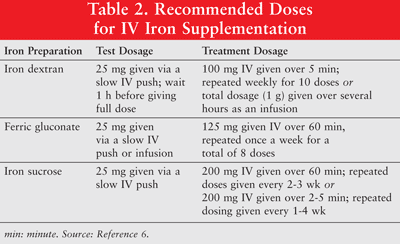
Fierul parenteral este asociat cu hipotensiune, greață, vărsături și / sau diaree, durere, hipertensiune, dispnee, prurit, cefalee și amețeli. Mai mult, poate fi incomod pentru administrare și costisitoare.9 Deoarece dextranul cu fier cu greutate moleculară mare (HMW) este asociat cu o incidență mai mare a evenimentelor adverse față de dextranul de fier LMW, acesta din urmă este preferat în general.6
Roșu Transfuzie de celule sanguine: globulele roșii sunt produsul sanguin preferat pentru transfuzii pentru corectarea anemiei în cazurile de anemie acută după hemoragie. Unii pacienți pot necesita o perfuzie care este negativă pentru citomegalovirus.Scopul utilizării unei transfuzii RBC este tratarea sau prevenirea unei deficiențe a capacității de transport a oxigenului sângelui, iar transfuzia nu este de obicei indicată dacă nivelul pacientului Hblevel este ≥10 g / dL.6
Transfuziile RBC oferă avantajul unei creșteri rapide a nivelurilor de Hb și hematocrit imediat după perfuzie. Se estimează că o transfuzie de 300 ml (1 unitate) de eritrocite pure va avea ca rezultat o creștere medie de 1 g / dL de Hb sau 3% de hematocrit la un alt adult normal care nu are pierderi simultane de sânge. Acest lucru duce la o ameliorare rapidă generală a oboselii. Dacă pacientul necesită perfuzii repetate, riscul reacțiilor adverse poate fi redus la minimum prin utilizarea sângelui care reduce leucocitele și premedicația cu anantihistamină sau acetaminofen.6
Transfuzia RBC nu este lipsită de riscuri, inclusiv potențialul pentru infecțioase transmise prin transfuzie. alte riscuri ale transfuziei includ insuficiența cardiacă congestivă, evenimente trombotice crescute și supraîncărcarea cu fier.6 Este util să rețineți, totuși, că pacienții care necesită perfuzii RBC în timpul perioadei corespunzătoare tratamentului cu chimioterapie sunt puțin probabil să experimentați supraîncărcarea cu fier.6
Perspective de viitor
În prezent sunt urmărite noi strategii de gestionare a anemiei la pacienții cu cancer. Deși nu există înlocuitor pentru sângele uman, cercetătorii sunt în curs de dezvoltare a produselor care au capacitatea de transport a oxigenului a globulelor roșii. În conductă sunt purtători de oxigen și perfluorocarburi pe bază de Hb.5
Concluzie
Una peste alta, abordarea optimă a anemiei ca problemă importantă în oncologie încă nu a fost stabilită. Lipsa de consistență între furnizorii de servicii medicale, o definiție clară a anemiei în cancer și criteriile de diagnostic contribuie la această problemă.
1. Steinmetz HT. Rolul fierului intravenos în tratamentul anemiei la pacienții cu cancer. Ther Adv Hematol. 2012; 3: 177-191.
2. deBenoist B, McLean E, Egli I și colab. Prevalența mondială a anemiei 1993-2005: Baza de date globală a OMS asupra anemiei. Geneva, Elveția: Organizația Mondială a Sănătății; 2008.
3. Knight K, Wade S, Balducci L. Prevalența și rezultatele anemiei în cancer: o revizuire sistematică a literaturii. Sunt J Med. 2004; 116 (supl. 7A): 11S-26S.
4. Schwartz RN. Anemia la pacienții cu cancer: incidența, cauzele, impactul, gestionarea și utilizarea ghidurilor de tratament și a protocolelor. Am J Health Syst Pharm. 2007; 64 (3 supl 2): S5-S13; test S28-S30.
5. Calabrich A, Katz A. Managementul anemiei la pacienții cu cancer. Viitorul Oncol. 2011; 7: 507-517.
6. Rodgers GM, Becker P, Blinder M și colab. Anemie indusă de cancer și chimioterapie. J Natl Compr Canc Netw. 2012; 10: 628-653.
7. Groopman JE, Itri LM. Anemia indusă de chimioterapie la adulți: incidență și tratament. J Natl Cancer Inst. 1999; 91: 1616-1634.
8. Ludwig H, Strasser K. Simptomatologia anemiei. Semin Oncol. 2001; 28: 7-14.
9. Gillespie TW. Anemie în cancer. Asistenta medicala pentru cancer. 2003; 26: 119-128.
10. Koeller JM. Ghiduri clinice pentru tratamentul anemiei legate de cancer. Farmacoterapie. 1998; 18: 156-169.
11. Cazzola M, Mercuriali F, Brugnara C. Utilizarea eritropoietinei umane recombinante în afara uremiei. Sânge. 1997; 89: 424-867.
12. Nowrousian MR, Kasper C, Oberhoff C și colab. Fiziopatologia anemiei legate de cancer. În: Smith JF, Boogaerts MA, Ehmer B, eds. Eritropoietina în tratamentul de susținere a cancerului. New York, NY: Marcel Dekker; 1997: 13-34.
13. Vaupel P, Dunst J, Engert A și colab. Efectele eritropoietinei umane recombinante (rHuEPO) asupra controlului tumorii la pacienții cu anemie indusă de cancer. Onkologie. 2005; 28: 216-221.
14. Zhao KL, Liu G, Jiang GL și colab. Asocierea nivelului de hemoglobină cu morbiditatea și mortalitatea pacienților cu carcinom esofagian avansat local supus radioterapiei – o analiză secundară a trei studii clinice consecutive de fază III. Clin Oncol (R Coll Radiol). 2006; 18: 621-627.
15. Glaspy JA. Dezvoltarea agenților eritropoietici în oncologie. Expert Opin Emerg Drugs. 2005; 10: 553-567.
16. Adamson JW, Spivak JL. Baza fiziologică pentru utilizarea farmacologică a eritropoietinei umane recombinate în chirurgie și în tratamentul cancerului. Interventie chirurgicala. 1994; 115: 7-15.
17. Ferrario E, Ferrari L, Bidoli P și colab. Tratamentul anemiei legate de cancer cu epoetină alfa: o revizuire. Cancer Treat Rev. 2004; 30: 563-575.
18. Lyman GH, Glaspy J. Există beneficii clinice cu intervenția eritropoietică timpurie pentru anemia indusă de chimioterapie? Revizuire sistematică. Cancer. 2006; 106: 223-233.
19. Rizzo JD, Brouwers M, Hurley P și colab. AmericanSociety of Clinical Oncology / American Society of Hematology clinical practice guide update despre utilizarea epoetinei și darbepoetinei la pacienții adulți cu cancer. J Clin Oncol. 2010; 28: 4996-5010.
20. Aranesp (darbepoetin alfa) informații de prescriere.Thousand Oaks, CA: Amgen Inc; Mai 2012.
21. Procrit (epoetin alfa) informații de prescriere. Horsham, PA: Janssen Products, LP; Iulie 2012.
22. Beutel G, Ganser A. Riscuri și beneficii ale agenților de stimulare a eritropoiezei în gestionarea cancerului. Semin Hematol. 2007; 44: 157-165.
23. Fenner MH, Ganser A. Eritropoietina în anemia legată de cancer. Curr Opin Oncol. 2008; 20: 685-689.
24. Smith RE Jr, Aapro MS, Ludwig H și colab. Darbepoetinalfa pentru tratamentul anemiei la pacienții cu cancer activ care nu primesc chimioterapie sau radioterapie: rezultatele unui studiu de fază III, multicentric, randomizat, dublu-orb, controlat cu placebo. J Clin Oncol. 2008; 26: 1040-1050.
25. Programul de oncologie ESA APPRISE. Amgen și Janssen Products, LP. www.esa-apprise.com. Accesat la 13 octombrie 2013.