Reducerea presiunii vaporilor
După cum este descris în capitolul privind lichidele și solidele, presiunea de vapori de echilibru a unui lichid este presiunea exercitată de gazul său fază în care vaporizarea și condensarea se produc la rate egale:
\ text {liquid} \ rightleftharpoons \ text {gas}
Dizolvarea unei substanțe nevolatile într-un lichid volatil rezultă o scădere a presiunii de vapori a lichidului. Acest fenomen poate fi raționalizat luând în considerare efectul moleculelor de solut adăugat asupra proceselor de vaporizare și condensare ale lichidului. Pentru vaporizare, moleculele de solvent trebuie să fie prezente la suprafața soluției. Prezența solutului scade suprafața disponibilă pentru moleculele de solvent și, prin urmare, reduce rata de vaporizare a solventului. Deoarece rata condensului nu este afectată de prezența solutului, rezultatul net este că echilibrul vaporizare-condensare se realizează cu mai puține molecule de solvent în faza de vapori (adică la o presiune mai mică a vaporilor) (Figura 1). În timp ce această interpretare cinetică este utilă, nu ia în considerare mai multe aspecte importante ale naturii coligative a scăderii presiunii vaporilor. O explicație mai riguroasă implică proprietatea entropiei, un subiect de discuție într-un capitol de text ulterior despre termodinamică. Pentru a înțelege scăderea presiunii de vapori a unui lichid, este adecvat să rețineți că entropia mai mare a unei soluții în comparație cu solventul și solutul său separat servește la stabilizarea eficientă a moleculelor de solvent și la împiedicarea vaporizării lor. Rezultă o presiune de vapori mai mică și un punct de fierbere corespunzător mai mare, așa cum este descris în secțiunea următoare a acestui modul.
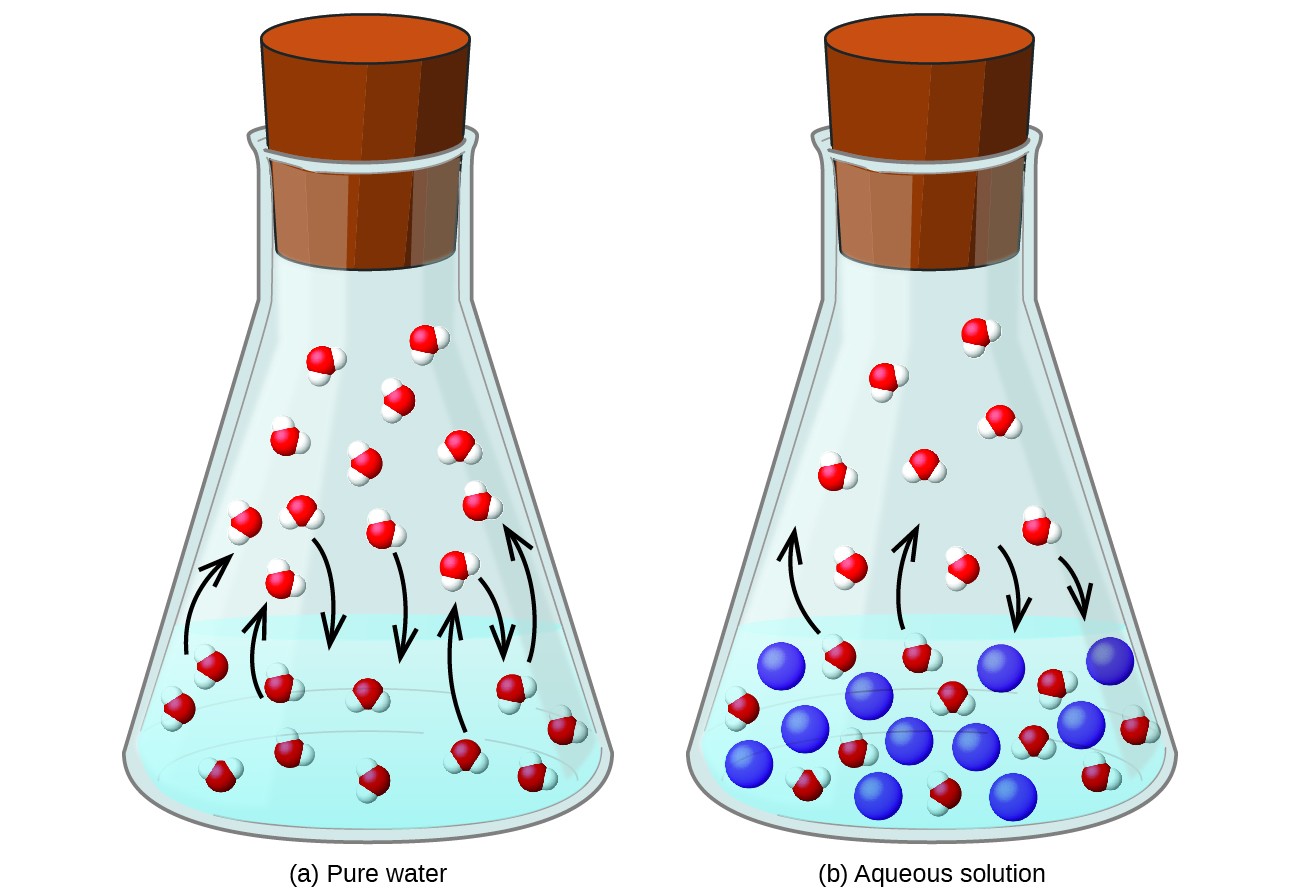
Figura 1. Prezența substanțelor dizolvate nevolatile scade presiunea de vapori a unei soluții prin împiedicarea evaporării moleculelor de solvent.
Relația dintre presiunile de vapori ale componentelor soluției și concentrațiile de aceste componente sunt descrise de legea lui Raoult: presiunea parțială exercitată de orice component al unei soluții ideale este egală cu presiunea de vapori a componentului pur înmulțit cu fracția sa molară din soluție.
{P} _ {\ text {A}} = {X} _ {\ text {A}} {P} _ {\ text {A}} ^ {\ star}
Amintind că presiunea totală a unui amestec gazos este egală cu suma presiunilor parțiale pentru toate componentele sale (legea Dalton a presiunilor parțiale), presiunea totală a vaporilor exercitată de o soluție care conține i componenți este
{ P} _ {\ text {solution}} = \ sum _ {i} {P} _ {i} = \ sum _ {i} {X} _ {i} {P} _ {i} ^ {\ star}
O substanță nevolatilă este una a cărei presiune de vapori este neglijabilă (P ^ {\ star} ≈ 0), astfel încât presiunea de vapori de deasupra unei soluții care conține numai substanțe dizolvate nevolatile se datorează numai solventului:
{P} _ {\ text {solution}} = {X} _ {\ text {solvent}} {P} _ {\ text {solvent}} ^ {\ star}
Distilarea soluțiilor
Distilarea este o tehnică de separare a componentelor amestecurilor care se aplică pe scară largă atât în laborator, cât și în medii industriale. Este utilizat pentru rafinarea petrolului, pentru izolarea produselor de fermentare și pentru purificarea apei. Această tehnică de separare implică încălzirea controlată a unui amestec de probă pentru vaporizarea selectivă, condensarea și colectarea unuia sau mai multor componente de interes. Un aparat tipic pentru distilări la nivel de laborator este prezentat în Figura 2.

Figura 2. Un tipic unitatea de distilare de laborator este prezentată în (a) o fotografie și (b) o diagramă schematică a componentelor. (credit a: modificare a lucrării de „Rifleman82” / Wikimedia commons; credit b: modificare a lucrării de „Slashme” / Wikipedia)
Rafinăriile de petrol folosesc distilarea fracționată pe scară largă pentru a separa componente ale țițeiului. Uleiul brut este încălzit la temperaturi ridicate la baza unei coloane fracționante înalte, vaporizând multe dintre componentele care se ridică în coloană. Deoarece componentele vaporizate ajung în zone adecvate de răcire în timpul ascensiunii, ele se condensează și sunt colectate. Lichidele colectate sunt amestecuri mai simple de hidrocarburi și alți compuși petrolieri care au o compoziție adecvată pentru diferite aplicații (de exemplu, motorină, kerosen, benzină), așa cum este descris în Figura 3.

Figura 3. Petrolul brut este un amestec complex care este separat prin distilare fracționată la scară largă pentru a izola diverse amestecuri mai simple.
Înălțimea punctului de fierbere
După cum este descris în capitolul privind lichidele și solidele, punctul de fierbere al unui lichid este temperatura la care presiunea sa de vapori este egală cu presiunea atmosferică ambientală.Întrucât presiunea de vapori a unei soluții este redusă datorită prezenței substanțelor dizolvate nevolatile, este logic că punctul de fierbere al soluției va fi ulterior crescut. În comparație cu solventul pur, o soluție, prin urmare, va necesita o temperatură mai mare pentru a obține orice presiune de vapori dată, inclusiv una echivalentă cu cea a atmosferei înconjurătoare. Creșterea punctului de fierbere observată atunci când dizolvatul nonvolatil este dizolvat într-un solvent, ΔTb, se numește creșterea punctului de fierbere și este direct proporțională cu concentrația molară a speciilor dizolvate:
\ Delta {T} _ {\ text {b}} = {K} _ {\ text {b}} m
unde Kb este constanta de înălțime a punctului de fierbere sau constanta ebullioscopică și m este concentrația molară (molalitatea) tuturor speciilor dizolvate.
Constantele de ridicare ale punctului de fierbere sunt proprietăți caracteristice care depind de identitatea solventului. Valorile Kb pentru mai mulți solvenți sunt enumerate în Tabelul 1.
Măsura în care presiunea vaporilor unui solvent este redusă și punctul de fierbere este crescut depinde de numărul total de particule dizolvate prezente într-o cantitate dată de solvent, nu pe masa sau dimensiunea sau identitățile chimice ale particulelor. O soluție apoasă de 1 m de zaharoză (342 g / mol) și o soluție apoasă de 1 m de etilen glicol (62 g / mol) vor prezenta același punct de fierbere deoarece fiecare soluție are un mol de particule dizolvate (molecule) per kilogram de solvent .
Exemplul 6: Punctul de fierbere al unei soluții de iod
Găsiți punctul de fierbere al unei soluții de 92,1 g de iod, I2, în 800,0 g de cloroform, CHCl3 , presupunând că iodul este nevolatil și că soluția este ideală.
Verificați învățarea dvs.
Care este punctul de fierbere al unei soluții de 1,0 g de glicerină, C3H5 (OH) 3, în 47,8 g de apă? Asumați o soluție ideală.
Depresia punctului de îngheț

Figura 4. Sare de rocă ( NaCl), clorură de calciu (CaCl2) sau un amestec al celor două sunt utilizate pentru a topi gheața. (credit: modificarea lucrării de către Eddie Welker)
Soluțiile înghețează la temperaturi mai scăzute decât lichidele pure. Acest fenomen este exploatat în schemele de „dezghețare” care utilizează sare (Figura 4), clorură de calciu sau uree pentru a topi gheață pe drumuri și trotuare și în utilizarea etilen glicolului ca „antigel” în radiatoarele auto. Apa de mare îngheață la o temperatură mai scăzută decât apa dulce și, prin urmare, oceanele arctice și antarctice rămân înghețate chiar și la temperaturi sub 0 ° C (la fel ca și fluidele corpului peștilor și ale altor animale marine cu sânge rece care trăiesc în aceste oceane) p>
Scăderea punctului de îngheț al unei soluții diluate comparativ cu cel al solventului pur, ΔTf, se numește depresiunea punctului de îngheț și este direct proporțională cu concentrația molară a dizolvatului
\ Delta {T} _ {\ text {f}} = {K} _ {\ text {f}} m
unde m este concentrația molară a solutului din solventul și Kf se numesc constanta de depresie a punctului de îngheț (sau constantă crioscopică). La fel ca și pentru constantele de ridicare ale punctului de fierbere, acestea sunt proprietăți caracteristice ale căror valori depind de identitatea chimică a solventului. Valorile Kf pentru mai mulți solvenți sunt enumerate în tabelul 1.
Proprietăți coligative și degivrare
Clorura de sodiu și analogii grupului 2 ai clorurii de calciu și magneziu sunt adesea folosite pentru de-gheață drumurile și trotuarele, datorită faptului că o soluție a oricăreia dintre aceste săruri va avea un punct de îngheț mai mic de 0 ° C, punctul de îngheț al apei pure. Sărurile metalice din grupa 2 sunt frecvent amestecate cu clorura de sodiu mai ieftină și mai ușor disponibilă („sare de rocă”) pentru utilizare pe drumuri, deoarece tind să fie oarecum mai puțin corozive decât NaCl și oferă o depresiune mai mare a punctului de îngheț , deoarece se disociază pentru a produce trei particule pe unitate de formulă, mai degrabă decât două particule precum clorura de sodiu.
Deoarece acești compuși ionici tind să grăbească coroziunea metalului, nu ar fi o alegere înțeleaptă de utilizat în antigel pentru radiatorul din mașină sau pentru a dezgheța un avion înainte de decolare.Pentru aceste aplicații, sunt adesea utilizați compuși covalenți, cum ar fi etilena sau propilen glicolul. Glicolii utilizați în lichidul radiatorului nu numai că scad punctul de îngheț al lichidului, ci ridică punctul de fierbere, făcând fluidul util atât iarna, cât și vara. Glicolii încălziți sunt adesea pulverizați pe suprafața avioanelor înainte de decolare în condiții meteorologice nefavorabile iarna pentru a îndepărta gheața care s-a format deja și pentru a preveni formarea mai multor gheață, care ar fi deosebit de periculoasă dacă s-ar forma pe suprafețele de control ale aeronavei (Figura 5).

Figura 5. Depresiunea punctului de îngheț este exploatată pentru a îndepărta gheața de pe (a) căile rutiere și (b) suprafețele de control ale aeronavelor.
Diagrama fazei pentru o soluție
Efectele coligative asupra presiunii vaporilor, a punctului de fierbere și a punctului de îngheț descrise în secțiunea anterioară sunt sintetizate în mod convenabil prin compararea diagramelor de fază pentru un lichid pur și o soluție derivată din acel lichid. Diagramele de fază pentru apă și o soluție apoasă sunt prezentate în Figura 6.
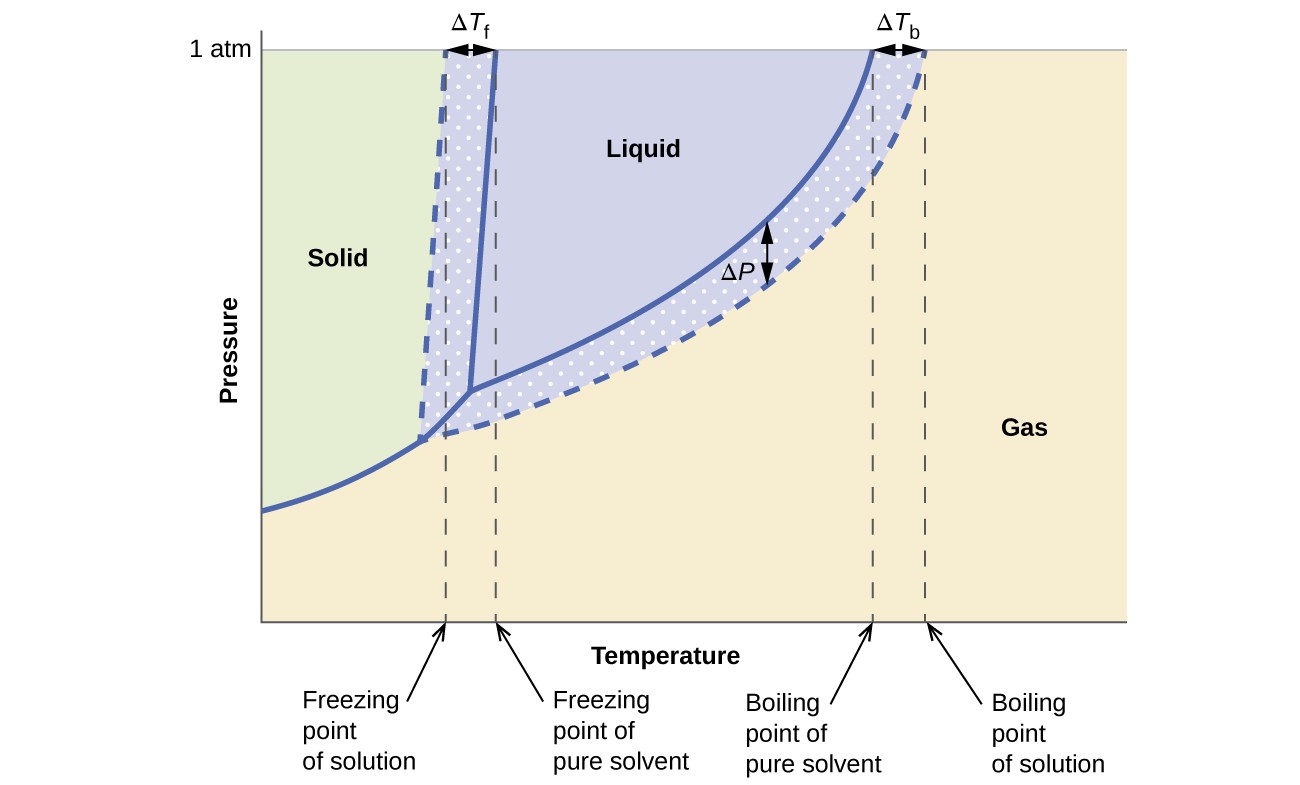
Figura 6. Aceste faze diagramele arată apă (curbe solide) și o soluție apoasă de nonelectrolit (curbe punctate).
Curba lichid-vapori pentru soluție este situată sub curba corespunzătoare pentru solvent, reprezentând vaporii scăderea presiunii, ΔP, care rezultă din dizolvarea solutului nevolatil. În consecință, la orice presiune dată, punctul de fierbere al soluției este observat la o temperatură mai mare decât cea pentru solventul pur, reflectând înălțimea punctului de fierbere, ΔTb, asociat cu prezența solutului nevolatil. Curba solid-lichid pentru soluție este deplasată la stânga de cea pentru solventul pur, reprezentând depresiunea punctului de îngheț, ΔTb, care însoțește formarea soluției. În cele din urmă, observați că curbele solid-gaz pentru solvent și soluția acestuia sunt identice. Acesta este cazul multor soluții care cuprind solvenți lichizi și substanțe dizolvate nevolatile. La fel ca și pentru vaporizare, atunci când o astfel de soluție este înghețată, de fapt sunt doar moleculele de solvent care suferă tranziția lichid-solid, formând solventul solid pur care exclude speciile dizolvate. Prin urmare, fazele solide și gazoase sunt compuse numai cu solvent, astfel încât tranzițiile dintre aceste faze nu sunt supuse efectelor coligative.
Osmoza și presiunea osmotică a soluțiilor
O serie de iar materialele sintetice prezintă permeabilitate selectivă, ceea ce înseamnă că numai moleculele sau ionii cu o anumită dimensiune, formă, polaritate, sarcină și așa mai departe, sunt capabili să treacă prin (permeabă) materialul. Membranele celulare biologice oferă exemple elegante de permeație selectivă în natură, în timp ce tuburile de dializă utilizate pentru îndepărtarea deșeurilor metabolice din sânge sunt un exemplu tehnologic mai simplist. Indiferent de modul în care pot fi fabricate, aceste materiale sunt denumite în general membrane semipermeabile.
Luați în considerare aparatul ilustrat în Figura 7, în care probele de solvent pur și o soluție sunt separate de o membrană care doar solvent moleculele pot pătrunde. Moleculele de solvent se vor difuza peste membrană în ambele direcții. Deoarece concentrația solventului este mai mare în solventul pur decât soluția, aceste molecule se vor difuza de la partea solventului a membranei la partea soluției într-un ritm mai rapid decât în direcția inversă. Rezultatul este un transfer net de molecule de solvent din solventul pur în soluție. Transferul determinat de difuzie a moleculelor de solvent printr-o membrană semipermeabilă este un proces cunoscut sub numele de osmoză.
Figura 7. (a) O soluție și un solvent pur sunt inițial separate de o membrană osmotică. (b) Transferul net al moleculelor de solvent în soluție are loc până când presiunea sa osmotică produce rate egale de transfer în ambele direcții.
Când osmoza este efectuată într-un aparat ca cel prezentat în Figura 7 , volumul soluției crește pe măsură ce se diluează prin acumularea de solvent. Acest lucru face ca nivelul soluției să crească, crescând presiunea hidrostatică a acesteia (datorită greutății coloanei de soluție din tub) și rezultând un transfer mai rapid al moleculelor de solvent înapoi la partea solventului pur. Când presiunea atinge o valoare care produce o rată de transfer inversă a solventului egală cu rata de osmoză, transferul masiv de solvent încetează. Această presiune se numește presiunea osmotică (Π) a soluției. Presiunea osmotică a unei soluții diluate este legată de molaritatea sa dizolvată, M și temperatura absolută, T, conform ecuației
\ Pi = MRT
unde R este constanta gazului universal.
Dacă o soluție este plasată într-un aparat precum cel prezentat în Figura 8, aplicarea unei presiuni mai mari decât presiunea osmotică a soluției inversează osmoza și împinge moleculele de solvent din soluție în solventul pur. Această tehnică de osmoză inversă este utilizată pentru desalinizarea pe scară largă a apei de mare și la scări mai mici pentru a produce apă de la robinet de înaltă puritate pentru băut.
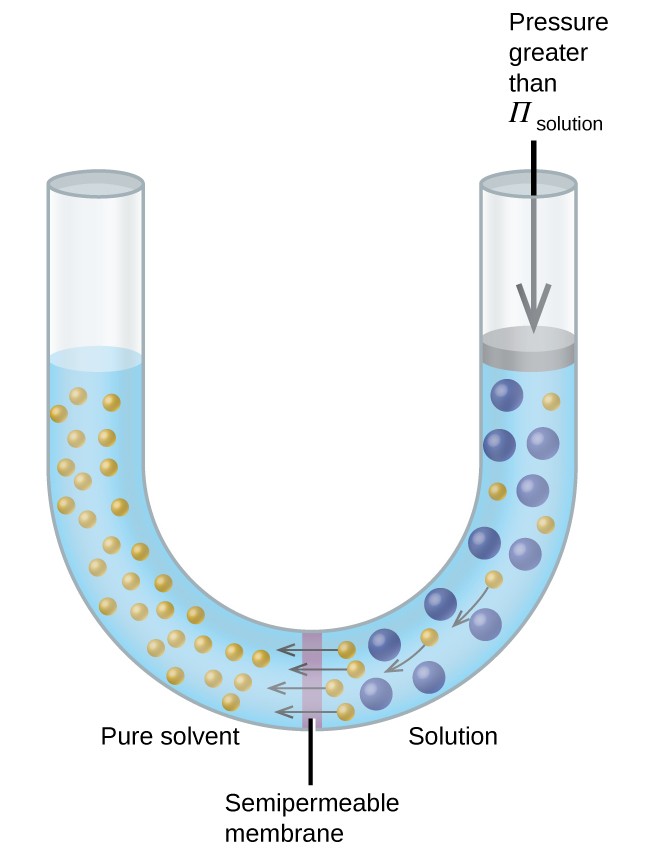
Figura 8. Aplicarea unei presiuni mai mari decât presiunea osmotică a unei soluții va osmoză inversă. Moleculele de solvent din soluție sunt împinse în solventul pur.
Purificarea apei prin osmoză inversă
În procesul de osmoză, difuzia servește la deplasarea apei printr-o membrană semipermeabilă dintr-o soluție mai puțin concentrată la o soluție mai concentrată. Presiunea osmotică este cantitatea de presiune care trebuie aplicată soluției mai concentrate pentru a determina oprirea osmozei. Dacă se aplică o presiune mai mare, apa va trece de la soluția mai concentrată la o soluție mai puțin concentrată (mai pură). Aceasta se numește osmoza inversă. Osmoza inversă (RO) este utilizată pentru purificarea apei în multe aplicații, de la instalațiile de desalinizare din orașele de coastă, până la mașinile de purificare a apei din magazinele alimentare (Figura 9) și unitățile de uz casnic cu osmoză inversă mai mici. Cu o pompă acționată manual, unitățile mici RO pot fi utilizate în țările lumii a treia, în zonele de dezastru și în bărcile de salvare. Forțele noastre militare au o varietate de unități RO acționate de generatoare care pot fi transportate în vehicule către locații îndepărtate.

Figura 9. Sistemele de osmoză inversă pentru purificarea apei potabile sunt prezentate aici pe (a) cântare mici și (b) mari. (credit a: modificare a lucrării de Jerry Kirkhart; credit b: modificare a lucrării de Willard J. Lathrop)
Exemple de osmoză sunt evidente în multe sisteme biologice, deoarece celulele sunt înconjurat de membrane semipermeabile. Morcovii și țelina care au devenit șchiopătați deoarece au pierdut apă pot fi din nou crocante prin plasarea lor în apă. Apa se mută în celulele de morcov sau țelină prin osmoză. Un castravete plasat într-o soluție concentrată de sare pierde apă prin osmoză și absoarbe puțină sare pentru a deveni murat. Osmoza poate afecta și celulele animale. Concentrațiile de soluție sunt deosebit de importante atunci când soluțiile sunt injectate în organism. Solutele din fluidele celulelor corpului și serul sanguin conferă acestor soluții o presiune osmotică de aproximativ 7,7 atm. Soluțiile injectate în organism trebuie să aibă aceeași presiune osmotică ca serul sanguin; adică ar trebui să fie izotonice cu ser de sânge. Dacă o soluție mai puțin concentrată, o soluție hipotonică, este injectată în cantitate suficientă pentru a dilua serul din sânge, apa din serul diluat trece în celulele sanguine prin osmoză, determinând celulele să se extindă și să se rupă. Acest proces se numește hemoliză. Când se injectează o soluție mai concentrată, o soluție hipertonică, celulele pierd apă în soluția mai concentrată, se strâmbă și, eventual, mor într-un proces numit crenare. Aceste efecte sunt ilustrate în Figura 10.
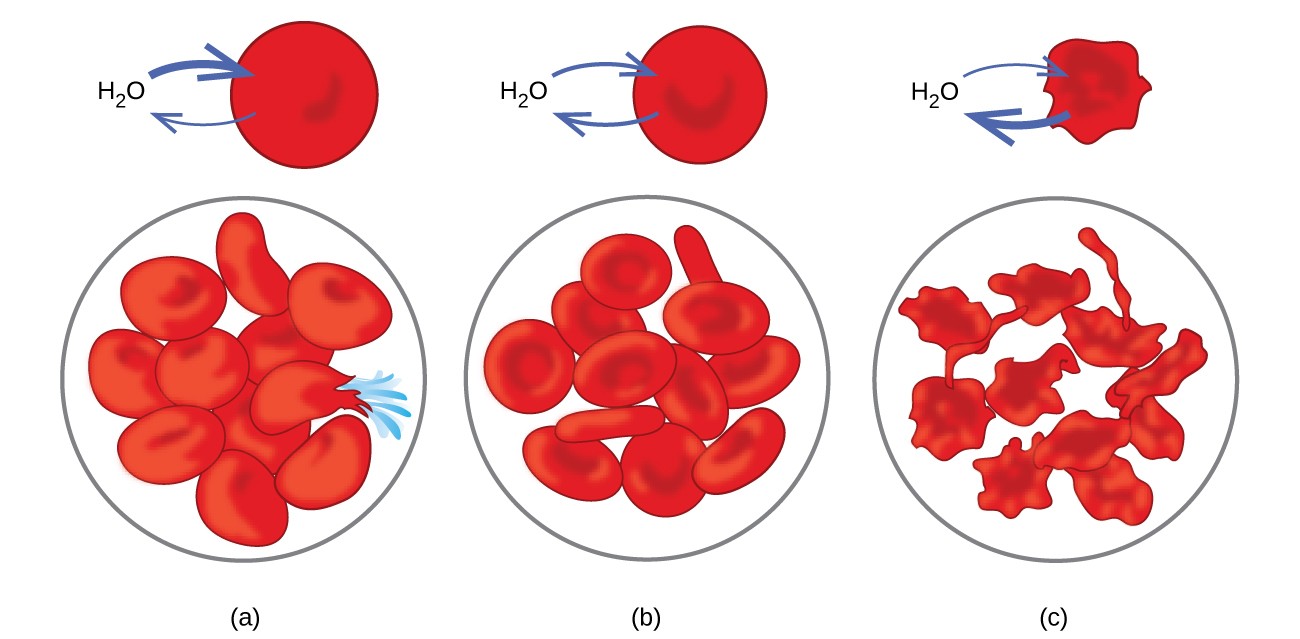
Figura 10. Membranele globulelor roșii sunt permeabile la apă și (a) se va umfla și, eventual, se va rupe într-o soluție hipotonică; (b) menține volumul și forma normale într-o soluție izotonică; și (c) se strâmbă și, eventual, mor într-o soluție hipertonică. (credit a / b / c: modificări ale lucrării de „LadyofHats” / Wikimedia commons)
Determinarea maselor molare
Presiunea osmotică și modificările punctului de îngheț, fierbere punct și presiunea de vapori sunt direct proporționale cu concentrația solutului prezent. Prin urmare, putem utiliza o măsurare a uneia dintre aceste proprietăți pentru a determina masa molară a solutului din măsurători.
Proprietățile colective ale electroliților
După cum sa menționat anterior în acest modul, proprietățile coligative ale unei soluții depind doar de numărul, nu de identitatea, a speciilor dizolvate dizolvate. Termenii de concentrație din ecuațiile pentru diferite proprietăți coligative (depresie a punctului de îngheț) , creșterea punctului de fierbere, presiunea osmotică) se referă la toate speciile de substanțe dizolvate prezente în soluție. Pentru soluțiile luate în considerare până acum în acest capitol, substanțele dizolvate au fost nonelectroliți care se dizolvă fizic fără disociere sau orice alt proces însoțitor. le care se dizolvă produce o moleculă dizolvată dizolvată. Dizolvarea unui electroyte, totuși, nu este atât de simplă, așa cum este ilustrat de cele două exemple comune de mai jos:
Având în vedere primul dintre aceste exemple și presupunând disocierea completă, o soluție apoasă de NaCl de 1,0 m conține 2,0 moli de ioni (1,0 mol Na + și 1.0 mol Cl−) pentru fiecare kilogram de apă, iar depresiunea punctului său de îngheț este de așteptat să fie
Când această soluție este de fapt preparată și se măsoară depresiunea punctului de îngheț, se obține totuși o valoare de 3,4 ° C. Se observă discrepanțe similare pentru alți compuși ionici, iar diferențele dintre valorile proprietăților coligative măsurate și așteptate devin de obicei mai semnificative pe măsură ce concentrațiile de solut cresc. Aceste observații sugerează că ionii de clorură de sodiu (și alți electroliți puternici) nu sunt complet disociați în soluție.
Pentru a explica acest lucru și a evita erorile care însoțesc presupunerea disocierii totale, un parametru măsurat experimental numit în se folosește onoarea chimistului german câștigător al Premiului Nobel Jacobus Henricus van’t Hoff. Factorul van’t Hoff (i) este definit ca raportul dintre particulele dizolvate în soluție și numărul de unități de formulă dizolvate:
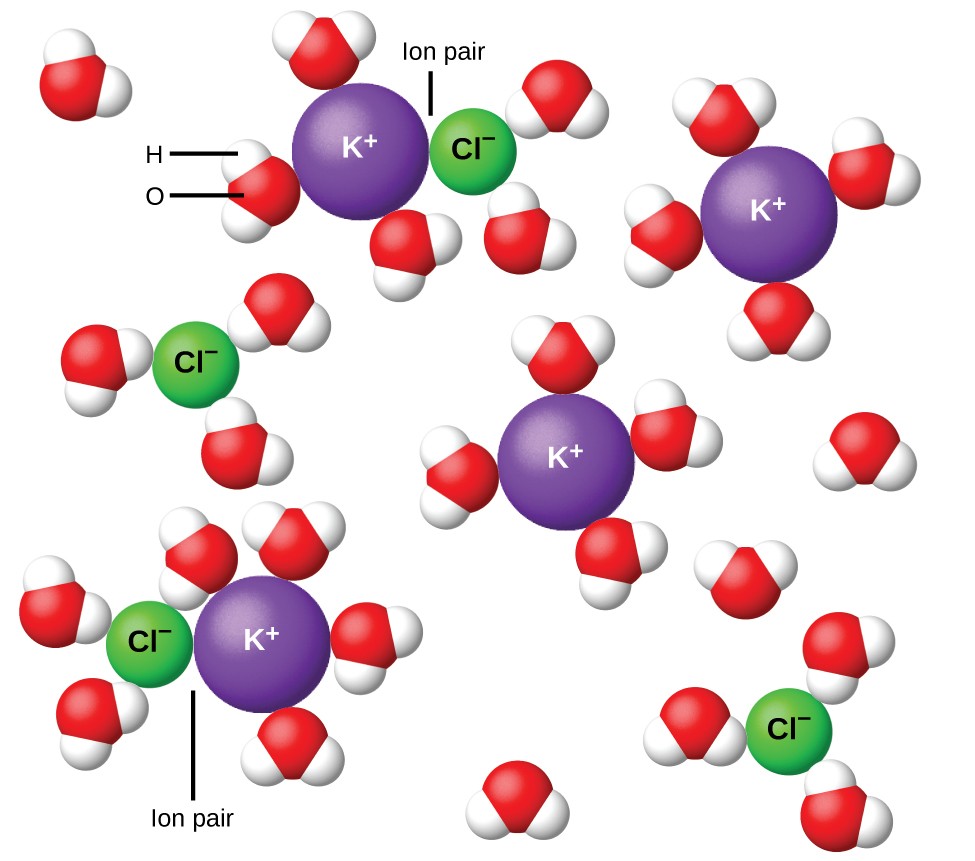
Figura 11. Ionii se separă din ce în ce mai mult cu cât soluția este mai diluată, iar atracțiile interionice reziduale devin mai puține.
În 1923, chimiștii Peter Debye și Erich Hückel au propus o teorie pentru a explica aparenta ionizare incompletă a electroliților puternici. Ei au sugerat că, deși atracția interionică într-o soluție apoasă este foarte mult redusă prin solvarea ionilor și acțiunea izolatoare a solventului polar, aceasta nu este complet anulată. Atracțiile reziduale împiedică ionii să se comporte ca particule total independente (Figura 11). În unele cazuri, un ion pozitiv și negativ poate atinge efectiv, dând o unitate solvatată numită pereche de ioni. Astfel, activitatea sau concentrația efectivă a oricărui tip particular de ion este mai mică decât cea indicată de concentrația reală. Ionii se separă din ce în ce mai mult cu cât soluția este mai diluată, iar atracțiile interionice reziduale devin din ce în ce mai puține. Astfel, în soluții extrem de diluate, concentrațiile efective ale ionilor (activitățile lor) sunt în esență egale cu concentrațiile reale. Rețineți că factorii van’t Hoff pentru electroliții din tabelul 2 sunt pentru soluții de 0,05 m, la o concentrație a cărei valoare pentru i pentru NaCl este 1,9, spre deosebire de o valoare ideală de 2.
Exemplul 11: Punctul de îngheț al unei soluții a unui electrolit
Concentrația ionilor în apa de mare este aproximativ aceeași cu cea dintr-o soluție conținând 4,2 g NaCl dizolvat în 125 g apă. Să presupunem că fiecare dintre ionii din soluția de NaCl are același efect asupra punctului de îngheț al apei ca o moleculă nonelectrolitică și determinați temperatura de congelare a soluției (care este aproximativ egală cu temperatura de îngheț a apei de mare).
Verificați învățarea dvs.
Să presupunem că fiecare dintre ionii din clorura de calciu, CaCl2, are același efect asupra punctului de îngheț al apei ca o moleculă nonelectrolitică. Calculați punctul de îngheț al unei soluții de 0,724 g de CaCl2 în 175 g de apă.
Încercați-o
- Carnea poate fi clasificată ca proaspătă (neînghetată), chiar dacă este stocată la -1 ° C. De ce nu ar îngheța carnea la această temperatură?
- Un compus organic are o compoziție de 93,46% C și 6,54% H în masă. O soluție de 0,090 g din acest compus în 1,10 g camfor se topește la 158,4 ° C. Punctul de topire al camforului pur este de 178,4 ° C. Kf pentru camfor este de 37,7 ° C / m. Care este formula moleculară a solutului? Arată calculele tale.
- O sare este cunoscută ca fiind o fluorură de metal alcalin. O determinare rapidă aproximativă a punctului de îngheț indică faptul că 4 g de sare dizolvată în 100 g de apă produce o soluție care îngheață la aproximativ -1,4 ° C. Care este formula sării? Afișați calculele dvs.
Glosar
Activitate: concentrația efectivă a ionilor în soluție; este mai mică decât concentrația reală, datorită interacțiunilor ionice.
cota punctului de fierbere: elevația punctului de fierbere al unui lichid prin adăugarea unui solut
constantă a cotei de fierbere: constantă de proporționalitate în ecuația care leagă elevarea punctului de fierbere de molalitatea dizolvată; cunoscută și sub numele de constantă ebullioscopică
proprietate coligativă: proprietate a unei soluții care depinde doar de concentrația unei specii dizolvate
crenare: proces prin care celulele biologice se înrăutățesc din cauza pierderii de apă prin osmoză
depresiunea punctului de îngheț: scăderea punctului de îngheț al unui lichid prin adăugarea unui solut
constanta depresiunii punctului de îngheț: (de asemenea, constantă crioscopică) constantă de proporționalitate în ecuația depresie a punctului de îngheț pentru a rezolva molalitatea
hemoliză: ruperea globulelor roșii din cauza acumulării de apă în exces prin osmoză
hipertonică: de presiune osmotică mai mare
hipotonă : de presiune osmotică mai mică
pereche de ioni: pereche anion / cation solvatată ținută împreună prin atracție electrostatică moderată
izotonică: de presiune osmotică egală
molalitate (m) : o unitate de concentrație definită ca raportul dintre numărul de moli de dizolvat și masa solventului în kilograme
fracție molară (X): raportul dintre cantitatea molară a unei componente a soluției și numărul total de moli al tuturor componentelor soluției
osmoza: difuzia moleculelor de solvent printr-o membrană semipermeabilă
presiunea osmotică (Π ): presiune opusă necesară pentru a preveni transferul în vrac al moleculelor de solvent printr-o membrană semipermeabilă
Legea lui Raoult: presiunea parțială exercitată de o componentă a soluției este egală cu produsul fracției molare a componentului în soluție și echilibrul acesteia presiunea vaporilor în stare pură
membrană semipermeabilă: o membrană care permite selectiv trecerea anumitor ioni sau molecule
nu factorul Hoff (i): raportul dintre numărul de moli de particule într-o soluție la numărul de moli de unități de formulă dizolvate în soluție
- Un nonelectrolit prezentat pentru comparație. ↵

