Caz clinic
O femeie de 45 de ani cu o istorie de 20 de ani a bolii Crohn a prezentat cu febră, frisoane și oboseală timp de 10 zile. Cu puțin timp înainte de apariția simptomelor, pacientul a suferit o colonoscopie necomplicată în timpul căreia i s-au efectuat 17 biopsii pentru supraveghere sau polipectomie. În timpul colonoscopiei, boala Crohn a fost în remisie și nu s-a observat nicio inflamație a mucoasei.
În DE, semnele vitale ale pacientului erau HR 110, BP 120/80, RR 18, T 102.5. Avea o sensibilitate ușoară a abdomenului superior drept. Studiile de laborator au evidențiat un număr crescut de celule albe din sânge (15.000) și valori crescute ale AST și ALT (120/137 U / L), cu fosfatază alcalină ușor crescută de 200 UI / L. O tomografie computerizată (CT) a abdomenului a relevat multiple zone de atenuare scăzută în lobul hepatic drept, în concordanță cu abcesele hepatice. Drenajul abceselor a fost cultivat și a crescut Streptococcus anginosus. Rezolvarea tuturor leziunilor a avut loc după ce au fost drenate prin radiologie intervențională, iar pacientului i s-a administrat un curs de 6 săptămâni de antibiotice intravenoase.
Introducere
Colonoscopia este o procedură frecvent efectuată în diagnosticul și tratamentul unei game largi de afecțiuni, inclusiv cancer, boli inflamatorii intestinale, polipi, sângerări și stricturi. Potrivit Societății Americane a Cancerului, colonoscopia de screening este recomandată la fiecare 10 ani, începând cu vârsta de 50 de ani. Procedura este în continuare cea mai eficientă modalitate de a găsi și a elimina polipii precanceroși mici și, prin urmare, de a reduce riscul de deces cauzat de cancerul de colon și rect.
În general, colonoscopia este foarte sigură. O revizuire sistematică din 2008 a 12 studii în total 57742 de colonoscopii efectuate pentru screening-ul de risc mediu a arătat o rată generală a evenimentelor adverse grave de doar 2,8 la 1000 de proceduri și o mortalitate de 0,007% .2 Cu toate acestea, riscul de colonoscopie nu este constant între grupuri și unele complicații sunt mai frecvente decât altele. Adulții în vârstă prezintă un risc crescut de complicații grave în comparație cu pacienții mai tineri. Într-un studiu de 53,220 colonoscopii, pacienții cu vârste cuprinse între 80 și 84 de ani au avut o rată semnificativ mai mare de complicații grave, comparativ cu pacienții cu vârsta cuprinsă între 66 și 69 de ani. Riscul de complicații grave a fost, de asemenea, crescut la pacienții cu afecțiuni comorbide, cum ar fi antecedente de accident vascular cerebral, BPOC, fibrilație atrială și insuficiență cardiacă.
Abcesul hepatic piogen (PLA) este o complicație rară, dar gravă a colonoscopiei . Cele mai multe complicații ale colonoscopiei vor apărea în termen de 7 zile, dar PLA poate prezenta zile sau chiar săptămâni mai târziu, iar istoria colonoscopiei recente nu poate fi nici măcar provocată, cu excepția cazului în care clinicianul este conștient de această entitate.4-6 Din cauza naturii întârziate de PLA, este probabil ca acești pacienți să fie diagnosticați în secția de urgență.
Alte complicații tardive, cum ar fi sindromul de electrocoagulare post-polipectomie și problemele mai frecvente de hemoragie întârziată, durere abdominală nespecifică, reacții la agenții de sedare , și perforația poate fi văzută și în ED. În schimb, explozia de gaze sau sângerările imediate vor fi rareori observate în DE, deoarece aceste probleme apar de obicei rapid în suita de endoscopie, unde sunt abordate în mod urgent. Medicii ED trebuie să fie conștienți de toate complicațiile posibile și de evoluția lor și să aibă instrumentele necesare pentru a diagnostica și trata corect pacientul nefericit post-colonoscopie care suferă o complicație gravă. Abcesul ficatului
PLA este o boală periculoasă, cu morbiditate și mortalitate ridicată, care apare la o rată de 10 până la 20 de cazuri la 100.000 de internări în spital.4-6 Având în vedere tehnicile și intervențiile de diagnostic, mortalitatea se îmbunătățește.7 Cu toate acestea, pacienții sunt încă în pericol grav, mai ales dacă diagnosticul este întârziat, așa cum se întâmplă adesea, deoarece pacienții pot prezenta nespecific. Un studiu retrospectiv pe 63 de pacienți cu PLA a arătat că febra era frecventă (59%), dar alte semne și simptome, cum ar fi durerea cadranului superior drept și semnele peritoneale, au fost prezente doar în 39% și, respectiv, 14%. deseori întârzia o medie de o săptămână de la apariția simptomelor.
Colonoscopia este un precipitant rar, dar, de asemenea, probabil sub-recunoscut al PLA. Se crede că micro-perforațiile silențioase în timpul procedurii conduc la infecții care pot însămânța ficatul prin circulația portalului. În mod similar, alte infecții intraabdominale, cum ar fi diverticulita, pot provoca PLA dacă zona infectată este drenată de vena portă.9 Clearance-ul hepatic al bacteriilor prin intermediul rețelei portal este un fenomen normal la pacienții sănătoși, dar obstrucția biliară, perfuzia slabă și încărcătura bacteriană ridicată (ca în cazul infecției sau a mai multor biopsii în timpul însămânțării circulației sanguine prin colonoscopie) pot predispune la proliferare și abces. formare. Literatura de specialitate descrie aproximativ 34% din cazurile de PLA ca fiind criptogene, dar o parte din acestea pot fi pacienți cu colonoscopie recentă care nu a fost recunoscută ca factor de risc pentru procesul bolii.8
Majoritatea izolatelor de PLA sunt polimicrobiene și alcătuit din floră enterică normală. Hemoculturile sunt pozitive în 33-65% din cazuri, dar culturile de abces sunt aproape toate pozitive.10 Cele mai frecvent izolate microorganisme sunt speciile Streptococcus (37%), Eserichia Coli (33%), speciile Bacteroides (24%), Klebsiella pneumoniae (18%) și Streptococi microaerofili (12%). 10-11 Strep anginosus, găsit în cazul acestui pacient, este un coccus Gram pozitiv anaerob facultativ și unul dintre cele mai frecvente organisme găsite în PLA.
Diagnosticul prompt al PLA este critic, deoarece chiar și pe măsură ce diagnosticul și terapia se îmbunătățesc, mortalitatea rămâne la 10% .5,7 Complicațiile infecțioase ale colonoscopiei în general sunt rare, dar, din nou, relația cauzală este probabil, de asemenea, puțin recunoscută. Colonoscopia a fost implicată în cel puțin câteva cazuri de PLA.12-14 Dar bacteremia sistemică tranzitorie, observată la 4% din colonoscopii, nu pare să crească riscul de infecție în sine.15 Mai degrabă, se crede că infecția în PLA se răspândește prin microperforări propriu-zise.
Deși se știe că perforațiile sincere sunt relativ rare (mai puțin de 0,1% din colonoscopii), incidența și fiziopatologia microperforărilor nu sunt pe deplin cunoscute.16-17 Înarmat cu cunoștințe despre acest aspect clinic o entitate, un clinician care are un istoric bun și are un indice ridicat de suspiciune poate diagnostica mai rapid PLA la un pacient cu colonoscopie recentă.
Infecție
Este de obicei acceptat faptul că bacteremia tranzitorie după colonoscopie apare în aproximativ 4% din proceduri, deși intervalul este raportat ca 0-25%, iar factorii de risc pentru bacteremie nu sunt definiți.18 Ratele mai mari de bacteremie apar în timpul activităților zilnice de rutină, cum ar fi periajul dinților și mestecarea alimentelor. Deși semnele sau simptomele infecției sistemice la pacienții cu bacteremie tranzitorie sunt rare, pacienții pot simți febră, frisoane și plângeri care imită totul, de la infecțiile respiratorii superioare la cele abdominale.18
Deși bacteremia tranzitorie este un risc acceptat de colonoscopie , nu există niciun beneficiu dovedit pentru profilaxia de rutină a antibioticelor, iar majoritatea pacienților nu vor fi luat antibiotice peri-procedură.18 Ghidurile actuale ale Societății Americane de Gastroenterologie (ASGE) sunt de acord cu American Heart Association (AHA) și recomandă împotriva profilaxiei antibiotice pentru pacienții supuși colonoscopiei de rutină.19
Poate fi dificil să se diferențieze simptomele bacteriemiei tranzitorii de infecția adevărată.18 În general, pacienții cu simptome infecțioase în zilele următoare colonoscopiei justifică studii de laborator, inclusiv hemoculturi și în indicele suspiciunii de perforație, imagistica abdominală.20-21 Dacă suspiciunea de perforație este scăzută sau diagnosticul s este exclusă, hidratarea IV și antibioticele pot fi administrate dacă se justifică prin starea clinică a pacientului.
Sângerarea
Sângerarea post-polipectomie poate fi imediată sau întârziată. Sângerarea imediată este asociată cu tehnici de polipectomie care nu utilizează cauterizare sau atunci când curentul amestecat este utilizat pentru procedură. Sângerarea întârziată este mai frecvent observată în DE, deoarece sângerarea imediată este adesea detectată la momentul procedurii și adresată de către endoscop. Sângerarea întârziată poate fi observată până la 7 zile după procedură. Se crede că se întâmplă din cauza scăderii unei escare care acoperea un vas de sânge sau din cauza extinderii zonei de necroză termică la țesutul nevătămat, care ar putea duce la sângerare dacă implică un vas de sânge.19,22
Câteva studii de amploare au raportat hemoragie în 1 până la 6 la 1000 colonoscopii (0,1% -0,6%) .22 Cu toate acestea, un studiu care a analizat peste 50.000 de colonoscopii a constatat că rata hemoragiei GI a fost semnificativ diferită în funcție de efectuarea polipectomiei. Sângerarea post-polipectomie apare la 1-2%, cu rate mai mari observate cu îndepărtarea polipilor mai mari. Riscul de sângerare post-polipectomie poate fi crescut la pacienții cu trombocitopenie sau coagulopatii.23
Factorii de risc cunoscuți pentru sângerarea post-colonoscopie includ dimensiunea polipului, numărul de polipi îndepărtați, antecedente de utilizare recentă a anticoagulantelor sau polipul histologie.22 În mod ciudat, studiile multiple și ample nu au găsit utilizarea aspirinei asociată cu sângerări post-polipectomii.24-26
Pacienții cu hemoragie întârziată pot prezenta orice semne de sângerare sau anemie, inclusiv oboseală, slăbiciune , paloare, sângerări grave sau cheaguri la ștergere, tahicardie, dureri în piept și dificultăți de respirație.Pacienții pot descrie hematochezia sau melena, în funcție de localizarea sângerării.
Tratamentul inițial al unui pacient cu suspiciune de hemoragie include abordarea căilor respiratorii de bază, respirație și circulație cu 2 IV-urile cu foraj mare, fluide cristalide și monitorizarea cardiacă. Pacienții cu sângerări GI mai scăzute se pot descompensa rapid și ar trebui să aibă un tip și un ecran activ în cazul în care este necesară transfuzia.
Imagistica nu este întotdeauna necesară și, dacă este posibil, decizia privind imagistica trebuie luată împreună cu IG consultați, de preferință, medicul care a efectuat colonoscopia. Repetarea colonoscopiei este adesea procedura de diagnostic și terapeutică la alegere. Colegiul American de Radiologie acordă cea mai mare evaluare a adecvării colonoscopiei, deși include, de asemenea, CTA a abdomenului / bazinului și a scanării RBC Tc-99m a abdomenului / bazinului ca posibile etape adecvate în diagnostic.27
Dacă pacientul este instabil și endoscopistul performant este indisponibil, medicul ED ar trebui să consulte radiologia intervențională generală (IR), GI și chirurgia.
Perforare
Perforarea colonoscopică (CP) este una dintre cele mai grave și temute complicații ale colonoscopiei. Deși rar, CP are ca rezultat morbiditate și mortalitate ridicate.28-32 Perforarea poate rezulta din forțe mecanice împotriva peretelui intestinal, barotraumatism sau electrocauterizare și poate duce la formarea de abcese, formarea fistulelor, sepsis intraabdominal, ședere prelungită la spital și chiar moartea.
CP apare în aproximativ 0,016% din colonoscopiile diagnostice, dar poate fi observată în până la 5% din colonoscopiile terapeutice.33-35 În funcție de ceea ce s-a făcut efectiv în timpul colonoscopiei, riscul de perforație poate fi mai mare sau mai mic decât media, astfel încât obținerea raportului operativ sau a istoricului de la endoscopist poate fi utilă pentru determinarea riscului.
Riscul CP pentru proceduri colonoscopice variate: 1,36-37
-Colonoscopie de screening: 0,01-0,1%
-Dilatarea stricturii anastomotice: 0-6%
-Dilatarea stricturii bolii Crohn: 0-18%
-Stent plasare: 4%
-Placarea tubului de decompresie colonică: 2%
-Rezecție endoscopică a mucoasei colonice 0-5%
În afară de evenimentele din timpul procedura, factorii de risc specifici pentru CP includ vârsta avansată, comorbidități multiple, diverticuloză, obstrucție, rezecția polipilor, polipi cu dimensiuni mai mari de 1cm sau cei găsiți în colonul drept, mobilitate redusă a colonului, slăbiciune existentă în peretele colonic , încercare incompletă anterioară de colonoscopie sau lipsă de experiență endoscopistă 20
Pacienții cu CP pot prezenta dureri abdominale bruste și agravante, urmate de o disipare completă a durerii fals liniștitoare pe măsură ce perforația decomprimă organul inflamat. Pe măsură ce conținutul GI continuă să se revărseze în peritoneu, se dezvoltă agravarea durerii și simptome peritoneale. Cu toate acestea, simptomele vor varia în funcție de localizarea și dimensiunea perforației, de gradul de infiltrare fecală în peritoneu și de vârsta și comorbiditățile pacientului.
În special, perforațiile pot fi și retro-peritoneale, corespunzătoare localizarea colonului ascendent și descendent și a flexurilor hepatice și splenice. Deși cel mai frecvent simptom al unei perforații colonice este durerea abdominală, pacienții vârstnici pot avea un răspuns tocit. Alte simptome includ febră, greață, vărsături, dispnee, dureri în piept, dureri scapulare și dureri în gât. Perforările retroperitoneale, în special, pot avea simptome minime sau atipice, iar semnele vitale pot prezenta tahicardie și febră, dar ar putea fi, de asemenea, normale.20
Managementul inițial al unei perforații suspectate include atenția asupra căilor respiratorii, respirație, circulație cu 2 IV cu alezaj mare, lichide cristalide și monitor cardiac. Ar trebui obținute laboratoare, inclusiv CBC, CMP, lipază și tipul și obținerea ecranului. Pacientul trebuie să fie strict NPO cu antibiotice empirice IV. Imagistica statistică cu CT abdomen / pelvis sau radiografie abdominală, dacă este instabilă, trebuie comandată alături de o consultație chirurgicală statistică21.
Sindromul post-polipectomie
Sindromul post-polipectomie, cunoscut și ca sindromul de electrocoagulare post-polipectomie sau sindromul de arsură transmurală, rezultă din leziunea electrocoagulării peretelui intestinal, creând o arsură transmurală și peritonită focală fără perforație sinceră.38 Incidența raportată variază de la 3 la 100.000 (0,003%) la 1 din 1000 (0,1%) ). Sindromul post-polipectomie a fost raportat la 6 pacienți din 16.318 colonoscopii efectuate între 1994 și 2002 într-un sistem integrat de sănătate mare.39 Nu se cunosc factorii de risc pentru această complicație mai puțin frecventă.
Pacienții cu sindrom post-polipectomie prezenți de obicei în 12 ore de la colonoscopie cu febră, tahicardie și dureri abdominale. Cu toate acestea, debutul simptomelor poate fi întârziat cu până la 5-7 zile după procedură.40 Pacienții prezintă adesea leucocitoză și pot prezenta rigiditate și tahicardie, toate acestea imitând perforația colonică.41
Cu toate acestea, spre deosebire de perforație, care poate necesita o intervenție chirurgicală emergentă, pacienții cu sindrom post-polipectomie sunt, în general, tratați în mod conservator cu fluide intravenoase, controlul durerii și avansarea treptată a dietei, cu sau fără antibiotice orientate către gram- agenți patogeni negativi și anaerobi.42 Cazurile mai puțin severe pot fi gestionate chiar și în ambulatoriu cu antibiotice orale și lichide limpezi timp de 1-2 zile.42-43
Deoarece acești pacienți nu pot fi distincți de pacienții cu perforație, orice pacient suspectat de sindrom post-polipectomie justifică laboratoare și imagistică. În sindromul post-polipectomie, scanarea CT va prezenta de obicei îngroșarea focală a peretelui colonic cu blocarea grăsimii înconjurătoare fără aer extramural, deși în cazurile ușoare CT poate fi negativă.42 Indiferent de rezultatul imagistic, ca și în cazul perforării, dacă sindromul post-polipectomie este suspectat, pacientul ar trebui să aibă un consult chirurgical.
Perle
- Colonoscopia este un test de screening utilizat pe scară largă la pacienții cu vârsta peste 50 de ani. Complicațiile pot fi precoce sau întârziate. Medicii EM ar trebui să fie conștienți de posibilele complicații și de calendarul lor preconizat, pentru a diagnostica și gestiona cu precizie orice posibilă complicație prezentatoare.
- Complicațiile includ hemoragie, perforație, sindrom post-polipectomie, infecție, explozie de gaze și abces hepatic piogen.
- Istoricul despre factorii pacienților și procedura în sine (afecțiuni subiacente, medicamente, dacă polipii au fost eliminați, dacă s-a utilizat cauter, dacă a existat sângerare imediată) pot ghida diagnosticul și gestionarea în DE.
- Abcesul hepatic piogen poate apărea la 1-2 săptămâni după colonoscopie, cu durere și febră în cadranul superior drept.
- O mare parte din colon este retroperitoneal. Perforațiile retroperitoneale pot provoca simptome vagi și atipice, de aceea indicele de suspiciune trebuie să fie ridicat.
- Sindromul post-polipectomie poate imita perforația și poate fi diferențiat de obicei prin imagistică.
Referințe / Lecturi suplimentare:
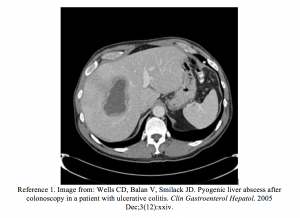
- Wells CD, Balan V, Smilack JD. Abces hepatic piogen după colonoscopie la un pacient cu colită ulcerativă. Clin Gastroenterol Hepatol. 2005 Dec; 3 (12): xxiv.
- Whitlock, E.P., Lin, J.S., Liles, E. și colab. Depistarea cancerului colorectal: o revizuire sistematică, actualizată și actualizată pentru Task Force Servicii Preventive din SUA. Ann Intern Med. 2008; 149: 638-658.
- Warren JL, Klabunde CN, Mariotto AB, Meekins A, Topor M, Brown ML, Ransohoff. Evenimente adverse după colonoscopie ambulatorie la populația Medicare. Ann Intern Med. 2009; 150 (12): 849.
- Johannsen EC, Sifri CD, Madoff LC. Abcese hepatice piogene.Infect Dis Clin North Am. 2000; 14: 547–63.
- Meddings L, Myers RP, Hubbard J și colab. Un studiu bazat pe populație al abceselor hepatice piogene în Statele Unite: incidență, mortalitate și tendințe temporale. Sunt J Gastroenterol. 2010; 105: 117–24.
- Kaplan GG, Gregson DB, Laupland KB. Studiu pe bază de populație a epidemiologiei și a factorilor de risc pentru abcesul hepatic piogen. Clin Gastroenterol Hepatol. 2004; 2: 1032-8.
- Petri A, Höhn J, Hódi Z, Wolfárd A, Balogh A. Abces hepatic pyogenic – 20 de ani de experiență. Compararea rezultatelor tratamentului în două perioade. Langenbecks Arch Surg. 2002; 387: 27–31.
- Pang TC, Fung T, Samra J, Hugh TJ, Smith RC. Abces hepatic piogen: un audit de 10 ani de experiență. World J Gastroenterol. 2011; 17: 1622-30.
- Murarka S, Pranav F, Dandavate V. Streptococcus anginosus diseminat din diverticulita sigmoidă. J Glob Infect Dis. 2011; 3: 79–81.
- Branum GD, Tyson GS, Branum MA, Meyers WC. Abces hepatic. Modificări în etiologie, diagnostic și management. Ann Surg. 212 decembrie 1990 (6): 655-62.
- Gyorffy EJ, Frey CF, Silva J Jr, McGahan J. Abces hepatic pyogenic. Strategii de diagnostic și terapeutice. Ann Surg. 1987 decembrie 206 (6): 699-705.
- Bonenfant F, Rousseau É, Farand P. Streptococcus abces hepatic anginosuspyogen după o colonoscopie de screening. Jurnalul canadian de boli infecțioase & Microbiologie medicală. 2013; 24 (2): e45-e46.
- Ian G. Harnik. Abces hepatic piogen care se prezintă după polipectomie malignă.Dig Dis Sci. 2007; 52: 3524–5.
- Paraskeva KD, Bury RW, Isaacs P.Streptococcus milleri abcese hepatice: o complicație neobișnuită după îndepărtarea colonoscopică a unui os de pește afectat. Gastrointest Endosc. 2000; 51: 357-8.
- Low DE, Shoenut JP, Kennedy JK și colab. Evaluarea prospectivă a riscului de bacteremie cu colonoscopie și polipectomie. Dig Dis Sci. 1987; 32: 1239–43.
- Becker F, Nusko G, Welke J, Hahn EG, Mansmann U. Urmărire după polipectomie colorectală: O analiză beneficiu-risc a recomandărilor germane de supraveghere. Int J Discul colorectal. 2007; 22: 929-39.
- Macrae FA, Tan KG, Williams CB. Către o colonoscopie mai sigură: un raport despre complicațiile a 5000 de colonoscopii diagnostice sau terapeutice. Intestin. 1983; 24: 376–83.
- Nelson, D.B.Complicații ale bolii infecțioase ale endoscopiei GI: partea II, infecții exogene. Gastrointest Endosc. 2003; 57: 695–711.
- Khashab, M.A., Chithadi, K.V., Acosta, R.D. și colab. Profilaxie antibiotică pentru endoscopie GI. Comitetul pentru standarde de practică ASGE. Gastrointest Endosc. 2015; 81: 81-89.
- Lohsiriwat V. Perforare colonoscopică: Incidență, factori de risc, management și rezultat. Jurnalul Mondial de Gastroenterologie: WJG. 2010; 16 (4): 425-430.
- American College of Radiology ACR Criterii de adecvare: acute (nelocalizate)
- Ko, C.W. și Dominitz, J.A. Complicații ale colonoscopiei: amploare și gestionare. Gastrointest Endosc Clin N Am. 2010; 20: 659-671.
- Warren JL, Klabunde CN, Mariotto AB și colab. Evenimente adverse după colonoscopie ambulatorie la populația Medicare. Ann Intern Med 2009; 150: 849-57.
- Hui, A.J., Wong, R.M., Ching, J.Y. și colab. Riscul de sângerare cu polipectomie colonoscopică cu anticoagulante și agenți antiplachetari: analiza a 1657 cazuri. Gastrointest Endosc. 2004; 59: 44–48.
- Sawhney, M.S., Salfiti, N., Nelson, D.B. și colab. Factori de risc pentru sângerări postpolypectomice întârziate severe. Endoscopie. 2008; 40: 115–119
- Yousfi, M., Gostout, C.J., Baron, T.H. și colab. Sângerări gastrointestinale inferioare postpolipectomie: rolul potențial al aspirinei. Sunt J Gastroenterol. 2004; 99: 1785–1789.
- Colegiul American de Radiologie ACR Criterii de adecvare: Managementul radiologic al hemoragiei tractului gastro-intestinal inferior. https://acsearch.acr.org/docs/69457/Narrative/ (Accesat la 16 iulie 2017).
- Lohsiriwat V, Sujarittanakarn S, Akaraviputh T, Lertakyamanee N, Lohsiriwat D, Kachinthorn U. Perforare colonoscopică: un raport de la centrul de instruire pentru endoscopie al Organizației Mondiale de Gastroenterologie din Thailanda. World J Gastroenterol. 2008; 14: 6722-6725.
- Iqbal CW, Cullinane DC, Schiller HJ, Sawyer MD, Zietlow SP, Farley DR. Managementul chirurgical și rezultatele a 165 de perforații colonoscopice dintr-o singură instituție. Arch Surg. 2008; 143: 701-706; discuție 706-707.
- Teoh AY, Poon CM, Lee JF, Leong HT, Ng SS, Sung JJ, Lau JY. Rezultate și predictori de mortalitate și formare de stomă în managementul chirurgical al perforațiilor colonoscopice: o revizuire multicentrică. Arch Surg. 2009; 144: 9-13.
- Lüning TH, Keemers-Gels ME, Barendregt WB, Tan AC, Rosman C. Perforări colonoscopice: o revizuire a 30.366 pacienți. Surg Endosc. 2007; 21: 994–997.
- Mai CM, Wen CC, Wen SH, Hsu KF, Wu CC, Jao SW, Hsiao CW. Perforarea colonică iatrogenă prin colonoscopie: o complicație fatală pentru pacienții cu risc anestezic ridicat. Int J Discul colorectal. 2010 apr; 25 (4): 449-54.
- Rathgaber SW, Wick TM. Completarea colonoscopiei și ratele de complicații într-o practică de gastroenterologie comunitară. Gastrointest Endosc. 2006; 64: 556-562.
- Damore LJ, Rantis PC, Vernava AM, Longo WE. Perforații colonoscopice. Etiologie, diagnostic și management. Dis Colon Rectum. 1996; 39: 1308-1314.
- Repici A, Pellicano R, Strangio G, Danese S, Fagoonee S, Malesci A. Rezecție endoscopică a mucoasei pentru neoplazia colorectală timpurie: bază patologică, proceduri și rezultate. Dis Colon Rectum. 2009; 52: 1502-1515.
- Chukmaitov A, Bradley CJ, Dahman B și colab. Asocierea tehnicilor de polipectomie, a volumului endoscopistului și a tipului de instalație cu complicații de colonoscopie. Gastrointest Endosc. 2013; 77: 436.
- Fisher DA, Maple DT și colab. Complicațiile colonoscopiei. Comitetul pentru standarde de practică ASGE Gastrointest Endosc. 2011; 74: 745. Durere și febră abdominală sau abces abdominal suspectat; Varianta 1: Pacient postoperator cu febră. https://acsearch.acr.org/docs/69356/Narrative/ (Accesat la 17 iulie 2017).
- Hirasawa K, Sato C, Makazu M și colab. Sindrom de coagulare: perforație întârziată după tratamentele endoscopice colorectale. Jurnalul Mondial de Endoscopie Gastrointestinală. 2015; 7 (12): 1055-1061.
- Levin TR, Zhao W, Conell C, Seeff LC, Manninen DL, Shapiro JA, Schulman J. Complicații ale colonoscopiei într-un sistem integrat de asistență medicală. Ann Intern Med. 2006; 145 (12): 880.
- Kim HW. Ce este diferit între febra postpolypectomie și sindromul de coagulare postpolypectomie? Clin Endosc. 2014; 47 (3): 205-6.
- Stock C, Ihle P, Sieg A, Schubert I, Hoffmeister M, Brenner H Evenimente adverse care necesită spitalizare în termen de 30 de zile după screening-ul ambulator și colonoscopii fără screening. Gastrointest Endosc. 2013 mar; 77 (3): 419-29.
- Sethi A, Song LMWK. Evenimente adverse legate de rezecția mucoasei endoscopice colonice și polipectomie. Gastrointest Endosc Clin N Am. 2015; 25 (1): 55–69.
- Benson BC, Myers JJ, Laczek JT. Sindromul de electrocoagulare postpolypectomie: un mimicker al perforării colonului. Case Rep Emerg Med. 2013; 2013 687931.