Inflamarea intravasculară malignă
Sepsisul a fost denumit un proces de inflamație intravasculară malignă . În mod normal, o cascadă puternică, complexă, imunologică asigură un răspuns protector prompt la invazia microorganismelor la om. O apărare imunologică deficitară poate permite stabilirea infecției; totuși, un răspuns excesiv sau slab reglementat poate dăuna gazdei prin eliberarea dezadaptativă a compușilor inflamatori generați în mod indigen (a se vedea imaginea de mai jos).
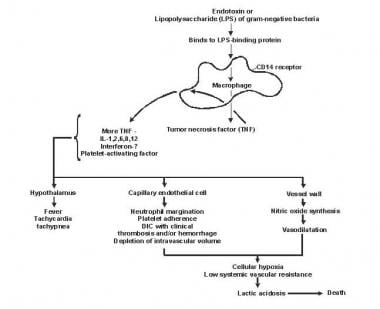 Patogenia sepsisului și a eșecului multiorganic.
Patogenia sepsisului și a eșecului multiorganic. Lipida A și alte produse bacteriene eliberează citokine și alți modulatori imuni care mediază manifestările clinice ale sepsisului. Interleukinele, factorul de necroză tumorală (TNF) -α, interferonul gamma (IFN-γ) și alți factori de stimulare a coloniilor sunt produse rapid în câteva minute sau ore după interacțiunile monocitelor și macrofagelor cu lipida A.
Eliberarea mediatorului inflamator devine un proces de auto-stimulare și eliberarea altor astfel de mediatori, inclusiv interleukina (IL) -1, factorul de activare a trombocitelor, IL-2, IL-6, IL-8, IL-10 , și oxidul azotic (NO), măresc în continuare nivelurile de citokine. Acest lucru duce la activarea continuă a leucocitelor polimorfonucleare (PMN), a macrofagelor și a limfocitelor; mediatorii proinflamatori recrutează mai multe dintre aceste celule. Toate aceste procese creează o stare de disonanță imunologică distructivă.
Sepsia este descrisă ca un proces autodestructiv care permite extinderea răspunsului fiziopatologic normal la infecție pentru a implica țesuturi și rezultate altfel normale. în MODS. Disfuncția organelor sau insuficiența organelor pot fi primul semn clinic al sepsisului și niciun sistem de organe nu este imun la consecințele exceselor inflamatorii ale sepsisului. Mortalitatea crește odată cu creșterea insuficienței organelor.
Deși necontrolată, odată ce MODS dezvoltă dovezi sistemice atât pentru reglarea proinflamatorie, cât și antiinflamatorie sunt de obicei prezente, sugerând că eșecul homeostaziei de apărare a gazdei este calea finală de la sepsis la MODS, mai degrabă decât simpla leziune a organului final indusă de hipotensiune, așa cum se poate întâmpla cu șocul hemoragic. Supraviețuirea din sepsis sever cu MODS este de obicei asociată cu o reducere generalizată atât a răspunsului proinflamator și antiinflamator.
O nouă ipoteză a apărut recent că supraviețuirea din sepsis sever necesită o descreștere generalizată a răspunsului imun al corpului, a funcțiilor energetice și a performanței organelor asociate. Astfel, MODS poate fi prin răspunsul adaptiv al gazdei la inflamația copleșitoare, permițând inflamarea să se elimine fără a provoca vătămări permanente ale organelor finale. După cum s-a discutat mai jos, toate organele dezvăluie o hiporesponsivitate generalizată, care este în mod clar anormală în sănătate, dar poate marca o strategie de supraviețuire în sepsisul sever.
Disfuncția sistemelor de organe
Deranjament circulator
Deranjamentul semnificativ în autoreglarea circulației este tipic pentru sepsis. Mediatorii vasoactivi provoacă vasodilatație și cresc permeabilitatea microvasculară la locul infecției. NU joacă un rol central în vasodilatația șocului septic. De asemenea, poate apărea secreția afectată de vasopresină, care poate permite persistența vasodilatației.
Modificări ale performanței ventriculare sistolice și diastolice apar în sepsis. Prin utilizarea mecanismului Frank-Starling, debitul cardiac este adesea crescut pentru a menține tensiunea arterială în prezența vasodilatației sistemice. Pacienții cu boală cardiacă preexistentă nu sunt în măsură să-și mărească debitul cardiac în mod corespunzător.
La nivel regional, sepsisul interferează cu distribuția normală a fluxului sanguin sistemic către sistemele de organe. În consecință, este posibil ca organele de bază să nu primească un aport adecvat de oxigen și rezultatul este ceea ce este cunoscut sub numele de hipoperfuzie regională.
Microcirculația este organul țintă cheie pentru leziuni în sepsis, deoarece endoteliul vascular este afectate universal de mediatorii inflamatori circulanți. Deși nu este clar dacă anomaliile microcirculatorii sunt cauza sau un spectator nevinovat al leziunii organului final, se observă o disfuncție microvasculară clară. Se observă o scădere a numărului de capilare perfuzate, deși cu aplicarea terapiilor vasodilatatoare, are loc recrutarea microvasculară completă. De asemenea, apare disfuncția mitocondrială și este adesea asociată cu gradienți de potențial transmembranar mitocondriali reduși, care sunt necesari pentru a determina fosforilarea oxidativă. Rezultatul final este o incapacitate aparentă a organelor finale de a extrage maxim oxigenul.
Dezbaterea continuă dacă acest eșec al metabolismului energetic este un mecanism citoprotector adaptativ similar hibernării sau dacă reflectă patologia mitocondrială primară. Acestea sunt domenii de cercetare activă, dar în prezent nu se traduc în linii directoare clare de practică clinică. Creșterea permeabilității endoteliale capilare duce la un edem tisular răspândit pe scară largă.
Șocul septic și SIRS se caracterizează prin depresie miocardică reversibilă, care se poate dovedi rezistentă la administrarea de catecolamină și lichide. „Factorul depresiv miocardic” circulant – reprezentând probabil efectele sinergice ale TNF-α, IL-1β, altor citokine și NO – este implicat în patogenie. Cele două caracteristici ale acestei depresii miocardice de stres acut sunt afectarea capacității de răspuns adrenergic și disfuncția diastolică rezistența relativă la catecolamină și inimile mici, mai degrabă decât dilatate. Ischemia și hipoperfuzia miocardică macrovasculară sunt factori care contribuie puțin probabil. și, prin urmare, dissoxia regională persistă. Această afecțiune se numește sindromul de detresă microcirculatorie și mitocondrială (MMDS). Disfuncția inflamatorie autoreglatorie inflamatorie indusă de sepsis persistă, iar necesitatea de oxigen nu este egalată cu aportul, ceea ce duce la MODS. >
Redistribuirea volumului lichidului intravascular rezultat din reducerea tonusului vascular arterial, diminuarea revenirii venoase din di și eliberarea substanțelor depresive miocardice cauzează hipotensiune.
Disfuncție pulmonară
Leziunea endotelială în vasculatura pulmonară duce la tulburări fluxul sanguin capilar și permeabilitatea microvasculară sporită, rezultând edem interstițial și alveolar. Prinderea neutrofilelor în microcirculația pulmonară inițiază și amplifică leziunea membranelor capilare alveolare. Leziunile pulmonare acute și sindromul de detresă respiratorie acută (ARDS) sunt manifestări frecvente ale acestor efecte. Într-adevăr, sepsisul și pneumonia sunt cele mai frecvente cauze ale ARDS.
Disfuncție gastro-intestinală
Tractul gastro-intestinal (GI) poate ajuta la propagarea leziunii sepsisului. Creșterea excesivă a bacteriilor din tractul gastro-intestinal superior poate fi aspirată în plămâni, producând pneumonie nosocomială sau de aspirație. Funcția normală de barieră a intestinului poate fi afectată, permițând translocarea bacteriilor, endotoxinelor și proteazelor digestive normale în circulația sistemică și extinderea răspunsului septic.
Șocul septic poate provoca ileus paralitic care poate duce la o întârziere în instituirea hrănirii enterale. Se consideră că excesul de producție de NO este agentul cauzal al ileusului indus de sepsis. Nivelul optim al aportului nutrițional este interferat în fața necesităților bogate în proteine și calorii. Narcoticele și relaxantele musculare pot agrava și mai mult motilitatea tractului gastrointestinal.
Disfuncție hepatică
Ca o consecință a rolului pe care ficatul îl joacă în apărarea gazdei, funcțiile sintetice anormale cauzate de disfuncția ficatului pot contribui atât la inițierea, cât și la progresia sepsisului. Sistemul reticuloendotelial al ficatului acționează ca o primă linie de apărare în eliminarea bacteriilor și a produselor acestora; disfuncția hepatică duce la o revărsare a acestor produse în circulația sistemică.
Insuficiența hepatică („ficatul șocat”) se poate manifesta prin creșterea enzimelor hepatice și a bilirubinei, defecte de coagulare și eșecul de a excreta toxine, cum ar fi amoniacul, care duc la agravarea encefalopatiei.
Disfuncție renală
Leziune renală acută (AKI) de multe ori însoțește sepsisul. Au fost raportate etiologii diferite pentru AKI, iar cauza este considerată de obicei multifactorială. Mecanismul AKI este complex, dar implică probabil o scădere a volumului intravascular eficient rezultat din hipotensiunea sistemică, vasoconstricția renală directă, eliberarea citokinelor, și activarea neutrofilelor de către endotoxine și alte peptide, care contribuie la leziuni renale. Totuși, majoritatea studiilor la animale arată că fluxul sanguin renal este crescut, nu scăzut, în sepsis, deși este asociat cu funcția tubulară afectată și cu o lipsă de dovezi histologice semnificative ale leziuni bulare.
Disfuncția sistemului nervos central
Implicarea sistemului nervos central (SNC) în sepsis produce encefalopatie și periferice neuropatie. Patogeneza este slab definită, dar este probabil legată de hipotensiunea sistemică, care poate duce la hipoperfuzie cerebrală.
Coagulopatie
Coagulopatie subclinică, semnalată printr-o creștere ușoară a timpului de trombină (TT) sau timpul de tromboplastină parțial activat (aPTT) sau o reducere moderată a numărul de trombocite este extrem de frecvent; cu toate acestea, se poate dezvolta și coagulare intravasculară diseminată (DIC). Receptorii activați cu protează (PAR), în special PAR 1, formează legătura moleculară dintre coagulare și inflamație; PAR1 exercită efecte citoprotectoare atunci când este stimulat de proteina C activată sau de trombină cu doze mici, dar exercită efecte perturbatoare asupra funcției de barieră a celulelor endoteliale atunci când este activată de doze mari de trombină.
Mecanismele disfuncției și leziunilor organelor
Mecanismele precise ale leziunii celulare și ale disfuncției organelor rezultate în sepsis nu sunt pe deplin înțelese. MODS este asociat cu o leziune extinsă a celulelor endoteliale și parenchimatoase, dintre care unele pot fi explicate prin următoarele 4 mecanisme propuse.
Hipoxie hipoxică
Leziunea circulatorie septică perturbă oxigenarea țesuturilor, modifică reglarea metabolică a eliberării de oxigen tisular și contribuie la disfuncția organelor. Anomaliile microvasculare și endoteliale contribuie la defectul septic microcirculator al sepsisului. Speciile reactive de oxigen, enzimele litice și substanțele vasoactive (de exemplu, NO și factori de creștere endotelială) duc la leziuni microcirculatorii, care se agravează de incapacitatea eritrocitelor de a naviga în microcirculația septică. >
Citotoxicitatea directă
Endotoxina, TNF-α și NO pot provoca daune transportului de electroni mitocondriale, ducând la metabolismul energetic dezordonat. Aceasta se numește anoxie citopatică sau histotoxică, o incapacitate de a utiliza oxigenul chiar și atunci când este prezent.
Apoptoză
Apoptoză ( moartea celulară programată) este principalul mecanism prin care celulele disfuncționale sunt în mod normal eliminate. Citokinele proinflamatorii pot întârzia apoptoza în macrofagele și neutrofilele activate, dar alte țesuturi (de exemplu, epiteliul intestinal) pot suferi apoptoză accelerată. Prin urmare, tulburarea apoptozei joacă un rol critic în leziunea tisulară a sepsisului.
Imunosupresie
Interacțiunea dintre proinflamator și mediatorii antiinflamatori pot duce la un dezechilibru între ei. Poate predomina o reacție inflamatorie sau o imunodeficiență sau pot fi prezente ambele.
Răspunsul gazdei și alți factori care influențează rezultatul
Caracteristicile clinice care se referă la severitate sepsisului include răspunsul gazdei la infecție, locul și tipul infecției, momentul și tipul terapiei antimicrobiene, organismul ofensator, dezvoltarea șocului, boala de bază, starea de sănătate a pacientului pe termen lung și numărul de eșecuri organe. Factorii care duc la sepsis și șoc septic pot să nu fie esențiali în determinarea rezultatului final.
Răspunsul gazdei la sepsis este caracterizat atât de răspunsuri proinflamatorii, cât și de răspunsuri imunosupresoare antiinflamatorii. Direcția, amploarea și durata acestor reacții sunt determinate atât de factorii gazdă (de exemplu, caracteristicile genetice, vârsta, boli coexistente, medicamente), cât și de factorii patogeni (de exemplu, încărcătura microbiană, virulența).
Răspunsurile inflamatorii sunt inițiate prin interacțiunea dintre tiparele moleculare asociate cu agenții patogeni, exprimate de agenți patogeni și receptorii de recunoaștere a tiparelor, exprimați de celulele gazdă la suprafața celulei (receptori asemănători și tip C receptori de lectină), în endozom (TLR) sau în citoplasmă (receptori genetici inductibili ai acidului retinoic 1 și receptori asemănători domeniului oligomerizării care leagă nucleotidele).
Consecința inflamației exagerate este deteriorarea colaterală a țesutului și moartea celulelor necrotice, care are ca rezultat eliberarea modelelor moleculare asociate cu deteriorarea, așa-numitele molecule de pericol care perpetuează inflamația cel puțin parțial acționând asupra aceluiași receptori de recunoaștere a modelelor declanșați de agenți patogeni.