États de l’eau: gaz, liquide et solide
La formation de liaisons hydrogène est une qualité importante de l’eau liquide qui est cruciale pour la vie telle que nous la connaissons. Comme les molécules d’eau créent des liaisons hydrogène les unes avec les autres, l’eau prend des caractéristiques chimiques uniques par rapport à d’autres liquides, et comme les êtres vivants ont une teneur élevée en eau, la compréhension de ces caractéristiques chimiques est essentielle pour comprendre la vie. Dans l’eau liquide, les liaisons hydrogène sont constamment formées et rompues lorsque les molécules d’eau glissent les unes sur les autres. La rupture de ces liaisons est provoquée par le mouvement (énergie cinétique) des molécules d’eau dû à la chaleur contenue dans le système. Lorsque la chaleur augmente lorsque l’eau est bouillie, l’énergie cinétique plus élevée des molécules d’eau provoque la rupture complète des liaisons hydrogène et permet aux molécules d’eau de s’échapper dans l’air sous forme de gaz (vapeur ou vapeur d’eau). En revanche, lorsque la température de l’eau diminue et que l’eau gèle, les molécules d’eau forment une structure cristalline maintenue par des liaisons hydrogène (il n’y a pas assez d’énergie pour rompre les liaisons hydrogène). Cela rend la glace moins dense que l’eau liquide, un phénomène non observé dans la solidification d’autres liquides.
Phases de la matière: voyez ce qui arrive aux liaisons intermoléculaires lors des changements de phase dans cet interactif.
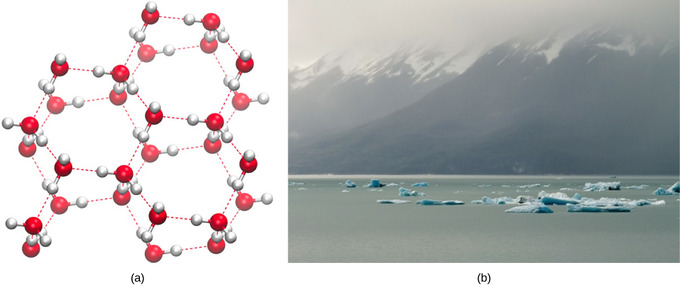
La densité plus faible de l’eau sous sa forme solide est due à la façon dont les liaisons hydrogène sont orientées lorsqu’elle gèle: les molécules d’eau sont plus éloignées les unes des autres que l’eau liquide. Avec la plupart des autres liquides, la solidification lorsque la température baisse inclut l’abaissement de l’énergie cinétique entre les molécules, leur permettant de se tasser encore plus étroitement que sous forme liquide et donnant au solide une plus grande densité que le liquide.
Le faible la densité de la glace, une anomalie, la fait flotter à la surface de l’eau liquide, comme un iceberg ou les glaçons dans un verre d’eau. Dans les lacs et les étangs, la glace se forme à la surface de l’eau, créant une barrière isolante qui protège les animaux et la flore de l’étang du gel. Sans cette couche de glace isolante, les plantes et les animaux vivant dans l’étang gèleraient dans le bloc de glace solide et ne pourraient pas survivre. L’effet néfaste du gel sur les organismes vivants est causé par l’expansion de la glace par rapport à l’eau liquide. Les cristaux de glace qui se forment lors de la congélation rompent les membranes délicates essentielles au fonctionnement des cellules vivantes, les endommageant de manière irréversible. Les cellules ne peuvent survivre au gel que si l’eau qu’elles contiennent est temporairement remplacée par un autre liquide comme le glycérol.