US Pharm. 2013; 38 (11) (Oncology suppl): 3-6.
RÉSUMÉ: L’anémie est une complication courante chez les patients atteints de cancer. Elle peut être causée soit par la tumeur elle-même, soit par le schéma thérapeutique utilisé. La gravité et la prévalence de l’affection varient en fonction d’un certain nombre de facteurs. Le traitement vise à augmenter la capacité de transport d’oxygène du sang, à réduire la fatigue et à améliorer la qualité de vie globale du patient.Les agents stimulant l’érythropoïèse, la supplémentation en fer et les transfusions de globules rouges ont tous été recommandés dans différents contextes. Bien que cela se soit avéré bénéfique chez certains patients, la modalité thérapeutique optimale n’a pas encore été établie.
L’anémie est une cause majeure de morbidité chez les patients atteints de cancer, associée à une performance physique, un pronostic et des résultats thérapeutiques médiocres.1 Selon l’Organisation mondiale de la santé ( OMS), l’anémie est définie comme un taux d’hémoglobine (Hb) de < 12 g / dL chez les femmes non enceintes et < 13 g / dL chez les hommes ≥ 15 ans.2
Épidémiologie
L’anémie est l’une des manifestations les plus fréquentes chez les patients atteints de cancer. En fait, il a été démontré que 30 à 90% des patients atteints de cancer sont anémiques, un chiffre qui dépend du type de cancer et de la définition de l’anémie utilisée.3 L’incidence et la gravité de l’anémie dépendent d’un certain nombre de facteurs, répertoriés dans le TABLEAU 1.4,5

Étiologie
La principale cause d’anémie chez les patients cancéreux est double: le cancer lui-même et le traitement utilisé pour la prise en charge du cancer. Les cellules cancéreuses qui infiltrent la moelle osseuse peuvent directement supprimer l’hématopoïèse et provoquer une anémie. De plus, les cellules cancéreuses libèrent des cytokines qui peuvent conduire à la séquestration du fer, réduisant ainsi la production de globules rouges (GR). Les tumeurs peuvent entraîner une perte de sang chronique à partir du site de la tumeur, entraînant une anémie progressive du cancer et des lésions organiques.6
Ce problème est aggravé par des pertes de sang, des carences nutritionnelles, une hémolyse, des troubles endocriniens, une maladie héréditaire, une insuffisance rénale, ou la présence de cytokines inflammatoires associées aux cancers et aux maladies chroniques.4,6 Les patients cancéreux ont tendance à perdre leur appétit, ce qui entraîne des carences nutritionnelles. Chez les patients atteints de tumeurs gastro-intestinales (GI), la malabsorption des nutriments entraîne également des carences. L’hémolyse résulte d’anticorps à médiation immunitaire ou de modifications de la capacité de coagulation. En conséquence, l’anémie est une commoncomorbidité chez les patients récemment diagnostiqués avec un cancer. Près de la moitié des patients diagnostiqués avec un cancer gynécologique et un tiers des patients diagnostiqués avec un lymphome non hodgkinien souffrent d’anémie au moment du diagnostic.
De plus, la myélosuppression est l’un des effets secondaires de la chimiothérapie et un facteur contributif important à l’anémie . La radiothérapie du squelette en particulier entraîne également une toxicité hématologique et donc une anémie.6
Symptômes
Les symptômes les plus courants de l’anémie sont la fatigue, la dyspnée à l’effort, les palpitations, la dépression, l’insuffisance cardiaque, les troubles cognitifs , étourdissements et insuffisance cardiaque.7,8
Diagnostic
L’ampleur du problème de l’anémie chez les patients cancéreux est amplifiée par des mesures diagnostiques sous-optimales, l’absence de définition standard et fait que la cause est souvent multifactorielle.6,9 Un historique détaillé indiquant la durée et le délai d’apparition des symptômes, la présence de comorbidités, les antécédents familiaux et les antécédents d’exposition aux médicaments antinéoplasiques et aux radiations doit être pris. Un examen aphysique pour rechercher une syncope, une dyspnée à l’effort, des maux de tête, des vertiges, des douleurs thoraciques, de la fatigue, des menstruations anormales chez les femmes et un paludisme doit être effectué.6
Le National Cancer Comprehensive Network recommande d’effectuer un CBC pour les patients atteints une Hb < 11 g / dL ou une réduction du nombre d’Hb de 2 g / dL. Ceci est utile pour déterminer si des cytopénies sont présentes. Un examen visuel du frottis de sang périphérique pour confirmer la taille, la forme et la couleur des globules rouges est également recommandé.6
Physiopathologie
L’anémie est le résultat d’une combinaison de diminution des érythrocytes circulants , réduction du volume de cellules concentrées et des taux d’Hb réduits.6 Cela peut se produire par le biais de divers mécanismes physiopathologiques, notamment une perte excessive de sang, une destruction accrue des globules rouges et une diminution de l’érythropoïèse.
Érythropoïétine (EPO), vitamine B12, acide folique et le fer est essentiel à l’érythropoïèse. L’érythropoïétine contrôle la saturation, la différenciation et la survie des cellules érythroïdes au cours de ce processus.10 L’EPO est principalement produite par les reins et transportée vers la moelle osseuse.11
Un métabolisme anormal du fer ou une rétention de fer dans les macrophages réduit la quantité de fer. fer disponible pour la forérythropoïèse.L’altération du métabolisme du fer est principalement causée par l’hepcidine, une protéine qui diminue l’absorption du fer dans les intestins ainsi que la libération de fer par les macrophages. La production d’hepcidine est augmentée par les cytokines libérées par les tumeurs, diminuant ainsi la quantité de fer en circulation. Il a également été démontré que la production de cytokines telles que l’interleukine (IL) -6 est augmentée par certains schémas chimiothérapeutiques.5 Des cycles répétés de chimiothérapie peuvent aggraver cumulativement la réduction de l’érythropoïèse.7
À mesure que l’apport d’oxygène est diminué, les cellules tissulaires du corps deviennent hypoxiques, ce qui entraîne une série de réponses physiologiques lorsque le corps tente d’obtenir ou de maintenir l’oxygénation des tissus.
On pense que l’utilisation normale des patients atteints d’un cancer du fer peut être interrompue par une interaction entre les cellules tumorales et le propre système immunitaire de l’hôte. Cette interaction conduit à une régulation à la hausse de cytokines inflammatoires spécifiques telles que l’IL-1, le gammainterféron et le facteur de nécrose tumorale alpha (TNF-α), ce qui diminue la différenciation des précurseurs érythroïdes dans la moelle osseuse, interfère avec l’utilisation normale du fer et inhibe l’hypoxie normale. production d’érythropoïétine. Les agents chimiothérapeutiques néphrotoxiques peuvent aggraver le problème en provoquant une insuffisance rénale.
Dans l’anémie chronique, il a été démontré que les tumeurs libéraient un facteur induisant l’ananémie, une molécule qui réduit la durée de vie des érythrocytes. Cela aggrave l’anémie au point où l’érythropoïèse ne peut pas compenser la survie inférieure des globules rouges.12
Facteurs de risque d’anémie dans le cancer
Les facteurs de risque suivants ont été identifiés pour l’anémie dans le cancer9:
- Chimiothérapie myélosuppressive ou radiothérapie
- Faible taux d’Hb (10-12 g / dL) au début de la chimiothérapie cytotoxique
- Administration de platine- contenant des schémas thérapeutiques, ce qui augmente également le besoin de soutien transfusionnel.
Traitement
Outre une amélioration globale de la qualité de vie du patient, le traitement de l’anémie est essentiel pour un certain nombre L’anémie compromet l’administration de quantités suffisantes d’oxygène à toutes les cellules, y compris les cellules tumorales.7 Étant donné qu’une faible oxygénation tissulaire est associée à une sensibilité réduite des tumeurs aux rayonnements et à d’autres formes de chimiothérapie, l’efficacité de ces traitements est réduite dans l’anémie.13,14
Le but de la thérapie devrait être d’augmenter le transport d’oxygène g de la capacité du sang et traiter la cause sous-jacente.Les conditions sous-jacentes telles que les carences nutritionnelles sont plus faciles à traiter que d’autres, telles que la perte de sang occulte. Diverses options sont disponibles pour la prise en charge des patients cancéreux souffrant d’anémie. Celles-ci incluent15:
- Traitement complémentaire approprié avec de l’acide folique et / ou de la vitamine B12 pour corriger les carences nutritionnelles
- Agents stimulant l’érythropoïèse (ASE)
- Supplémentation en fer
- Transfusions sanguines, qui sont indiquées pour les patients présentant une perte de sang aiguë sévère. Pour les patients dont l’anémie est chronique, les agents érythropoïétiques sont préférés.
Agents stimulant l’érythropoïèse: les ASE, y compris l’érythropoïétine alfa humaine recombinante (rHuEPO; Procrit, Epogen) et la darbepoetin alfa (Aranesp), étaient développé traditionnellement pour la prise en charge de l’anémie chez les patients atteints d’insuffisance rénale chronique. Ils ont démontré une efficacité et des limites similaires lorsqu’ils sont utilisés à des doses incomparables chez les patients cancéreux atteints d’anémie.5 Les ASE sont indiqués pour la prise en charge des patients dont les taux d’EPO endogène sont anormalement bas, car le mode d’action des ASE et les effets immunologiques et hématologiques sont similaires à ceux de l’EPO endogène.9 menée sur rHuEPO ont montré qu’elle améliore les Hblevels et la qualité de vie des patients et diminue les besoins transfusionnels.15,16 Il a été proposé que les ASE améliorent également la fonction cognitive des patients sous chimiothérapie.17
Une revue systémique menée par l’American Cancer Society, a montré que le bénéfice clinique optimal du traitement érythropoïétique de l’anémie induite par la chimiothérapie peut être obtenu grâce à une intervention précoce.18 Il y a clairement un avantage à utiliser les ASE; cependant, toutes les autres causes d’anémie doivent être étudiées et corrigées avant l’utilisation de l’ESAtherapy.
La darbepoetin et la rHuEPO sont toutes deux indiquées pour le traitement de l’anémie chez les patients atteints de tumeurs malignes non myéloïdes chez qui la fièvre est liée à la chimiothérapie.5 L’American Society of Hematology (ASH) et l’American Society of Clinical Oncology (ASCO) recommandent que le traitement soit instauré lorsque le taux d’Hb tombe en dessous de 10 g / dL et que la posologie soit réduite s’il y a une augmentation minimale de 1 g / dL de Hblevels de 2 semaines.19 Le but de la thérapie doit être d’augmenter le taux d’Hb à la concentration la plus faible pour éviter une transfusion. Si l’augmentation minimale de 1 à 2 g / dL d’Hb n’est pas obtenue après 6 à 8 semaines de traitement, le traitement par ESA doit être arrêté.18 Bien qu’il soit difficile de prédire la réponse des patients à ces thérapies avec les données actuelles, il a été démontré qu’environ 50% à 60% des patients présentent une augmentation de 2 g / dL de l’Hb lorsqu’ils sont traités par rHuEPO.9 Le traitement par ESA doit être interrompu à la fin du le cours de chimiothérapie.20,21
La posologie recommandée pour la darbepoetin alfa est de 2,25 mcg / kg en injection sous-cutanée (SC) hebdomadaire. Si les taux d’Hb n’augmentent pas d’au moins 1 g / dL après 6 semaines, la posologie doit être augmentée à 4,5 mcg / kg. Si les taux d’Hb augmentent de plus de 1 g / dL sur une période de 2 semaines ou si l’Hb dépasse 12 g / dL, la posologie de la darbépoétine doit être réduite de 40% .20 La darbépoétine doit être arrêtée si les taux d’Hb dépassent 13 g / dL. 9
La posologie recommandée de rHuEPO est de 40 000 USC administrés une fois par semaine ou de 150 U / kg administrés SC trois fois par semaine chez les patients dont le taux d’Hb est inférieur à 10 g / dL. La posologie de rHuEPO doit être réduite de 25% si le taux d’Hb augmente > 1 g / dL par période de 2 semaines ou atteint un niveau nécessaire pour éviter une transfusion de globules rouges.21
Les ASE sont emballés dans un flacon qui ne doit pas être secoué, car ils dénatureront.20,21 Le contenu du flacon ne doit pas être dilué ou mis en commun.
Les risques du traitement par ASE devraient également être pris en considération. On pense que les ASE augmentent les événements cardiovasculaires indésirables, augmentent le risque de thromboembolie veineuse, raccourcissent le temps de progression de la tumeur et réduisent la survie des patients cancéreux anémiques par le biais de différents mécanismes22,23. Pour cette raison, l’utilisation des ASE est déconseillée chez les patients cancéreux qui ne subissent pas de cancer. traitement par chimiothérapie ou radiothérapie.24 Tous les ASE sont accompagnés d’une boîte noire d’avertissement concernant l’augmentation du risque de décès, d’infarctus du myocarde, d’accident vasculaire cérébral, de thromboembolie veineuse, de thrombose de l’accès vasculaire et de progression et de récidive des tumeurs20,21. la FDA pour conseiller les patients, les soignants et les professionnels de la santé sur l’utilisation sûre des ASE.25
Supplémentation en fer: La supplémentation en fer, de préférence par voie parentérale, est indiquée chez les patients présentant de faibles taux de ferritine (< 30 ng / mL), saturation de la transferrine (TSAT < 15%) et faible (< 26 pg / cellule ) réticulocyte Hb conten t (CHr). Deux types d’irodéficience ont été reconnus chez les patients atteints d’un cancer anémique:
- Carence absolue en fer (AID) qui se produit avec des saignements chroniques dus, par exemple, à des lésions gastro-intestinales ou gynécologiques, à une perte de sang suite à une chirurgie, carences et anémie des maladies chroniques (ACD). Il est défini comme un taux de ferritine sérique de < 30 mcg / L et une diminution de TSAT de < 15% .1
- Carence en fer fonctionnelle (FID) qui survient après une utilisation continue d’érythropoïétine. C’est la cause la plus fréquente d’une réponse inadéquate au traitement par ESA, en particulier chez les patients atteints d’insuffisance rénale. Par conséquent, la plupart des patients sous traitement ASE nécessiteront éventuellement une supplémentation en fer.6
La supplémentation en fer a été introduite lorsque la thérapie ASE seule a démontré de faibles taux de réponse chez les patients traités par chimiothérapie.1 L’efficacité d’une association IV Le fer et la thérapie ASE ont été testés et le rôle du fer dans la carence en fer fonctionnelle a été établi.1 Bien que les preuves actuelles soutiennent l’utilisation d’une supplémentation en fer IV pour améliorer les réponses à l’hémoglobine chez les patients anémiques atteints de cancer, des études prospectives sur l’efficacité à long terme et l’innocuité du fer IV sont nécessaires. De plus, des schémas posologiques optimaux doivent être établis.5
Le fer peut être administré par voie orale ou sous forme de formulations parentérales de fer-dextran, de ferricgluconate et de fer-saccharose à faible poids moléculaire (LMW). Le fer administré par voie parentérale a une réponse supérieure par rapport au fer oral.6 Ce dernier est donc rarement utilisé chez les patients cancéreux atteints d’anémie et n’est pas abordé dans cet article. Les doses d’essai sont recommandées pour le fer-dextran.Les patients qui ont déjà présenté des sensibilités au fer-dextran ou à d’autres préparations de fer IV ou ceux qui ont des allergies médicamenteuses multiples devraient également recevoir une dose d’essai. Le TABLEAU 2 présente le schéma posologique de la supplémentation en fer IV.6
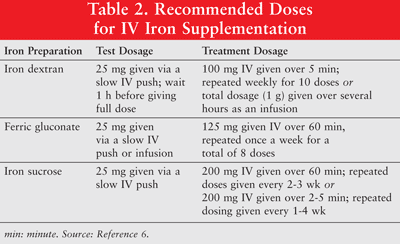
Le fer parentéral est associé à une hypotension, des nausées, des vomissements et / ou de la diarrhée, des douleurs, une hypertension, une dyspnée, un prurit, des maux de tête et des étourdissements. De plus, il peut être peu pratique à administrer et coûteux.9 Le fer-dextran de poids moléculaire élevé (HMW) étant associé à une incidence plus élevée d’événements indésirables que le fer-dextran LMW, ce dernier est globalement préféré.6
Rouge Transfusion de cellules sanguines: les globules rouges sont le produit sanguin préféré pour les transfusions afin de corriger l’anémie en cas d’anémie aiguë après une hémorragie. Certains patients peuvent nécessiter une perfusion négative pour le cytomégalovirus.Le but de l’utilisation d’une transfusion de globules rouges est de traiter ou de prévenir une déficience de la capacité de transport d’oxygène du sang, et la transfusion n’est généralement pas indiquée si le Hblevel du patient est ≥ 10 g / dL.6
Offre de transfusions de globules rouges l’avantage d’une augmentation rapide des taux d’Hb et d’hématocrite immédiatement après la perfusion. On estime qu’une transfusion de 300 mL (1 unité) de globules rouges purs entraînera une augmentation moyenne de 1 g / dL d’Hb ou de 3% de l’hématocrite chez un adulte autre wisenormal qui ne subit pas de perte de sang simultanée. Cela conduit à une amélioration globale rapide de la fatigue.6
Le sang du patient doit être comparé pour une compatibilité ABO avant que les globules rouges puissent être transfusés. Si le patient a besoin de perfusions répétées, le risque d’effets indésirables peut être minimisé par l’utilisation de sang réducteur de leucocytes et la prémédication avec de l’anantihistamine ou de l’acétaminophène.6
La transfusion de globules rouges n’est pas sans risques, y compris le potentiel d’infections transmises par transfusion médicaments, réactions transfusionnelles, allo-immunisation et immunosuppression.9 Les autres risques de transfusion comprennent l’insuffisance cardiaque congestive, l’augmentation des événements thrombotiques et la surcharge en fer.6 Il est toutefois utile de noter que les patients nécessitant des perfusions de globules rouges pendant la période correspondant au traitement chimiothérapeutique seulement sont très peu susceptibles de souffrez d’une surcharge en fer.6
Perspectives futures
De nouvelles stratégies de gestion de l’anémie chez les patients cancéreux sont actuellement mises en œuvre. Bien qu’il n’y ait pas de substitut au sang humain, les chercheurs sont en train de développer des produits qui ont la capacité de transport d’oxygène des globules rouges. Dans le pipeline sont des porteurs d’oxygène et des perfluorocarbures à base d’Hb.5
Conclusion
Dans l’ensemble, l’approche optimale de l’anémie en tant que question importante en oncologie n’a pas encore été établie. Le manque de cohérence entre les prestataires de soins de santé, une définition claire de l’anémie dans le cancer et les critères de diagnostic contribuent tous à ce problème.
1. Steinmetz HT. Le rôle du fer intraveineux dans le traitement de l’anémie chez les patients cancéreux. Ther Adv Hematol. 2012; 3: 177-191.
2. deBenoist B, McLean E, Egli I, et al. Prévalence mondiale de l’anémie 1993–2005: base de données mondiale de l’OMS sur l’anémie. Genève, Suisse: Organisation mondiale de la Santé; 2008.
3. Knight K, Wade S, Balducci L. Prévalence et résultats de l’anémie dans le cancer: une revue systématique de la littérature. Suis J Med. 2004; 116 (suppl 7A): 11S-26S.
4. Schwartz RN. Anémie chez les patients atteints de cancer: incidence, causes, impact, prise en charge et utilisation des directives de traitement et des protocoles. Suis J Health Syst Pharm. 2007; 64 (3 suppl. 2): S5-S13; quiz S28-S30.
5. Calabrich A, Katz A. Gestion de l’anémie chez les patients cancéreux. Future Oncol. 2011; 7: 507-517.
6. Rodgers GM, Becker P, Blinder M et al. Anémie induite par le cancer et la chimiothérapie. J Natl Compr Canc Netw. 2012; 10: 628-653.
7. Groopman JE, Itri LM. Anémie induite par la chimiothérapie chez l’adulte: incidence et traitement. J Natl Cancer Inst. 1999; 91: 1616-1634.
8. Ludwig H, Strasser K. Symptomatologie de l’anémie. Semin Oncol. 2001; 28: 7-14.
9. Gillespie TW. Anémie dans le cancer. Soins infirmiers en cancérologie. 2003; 26: 119-128.
10. Koeller JM. Lignes directrices cliniques pour le traitement de l’anémie liée au cancer. Pharmacothérapie. 1998; 18: 156-169.
11. Cazzola M, Mercuriali F, Brugnara C. Utilisation de l’érythropoïétine humaine recombinante en dehors du cadre de l’urémie. Sang. 1997; 89: 424-867.
12. Nowrousian MR, Kasper C, Oberhoff C, et al.Pathophysiology of cancer-related anemia. Dans: Smith JF, Boogaerts MA, Ehmer B, eds. Érythropoïétine dans le traitement de soutien du cancer. New York, NY: Marcel Dekker; 1997: 13-34.
13. Vaupel P, Dunst J, Engert A, et al. Effets de l’érythropoïétine humaine recombinante (rHuEPO) sur le contrôle des tumeurs chez les patients souffrant d’anémie cancéreuse. Onkologie. 2005; 28: 216-221.
14. Zhao KL, Liu G, Jiang GL et al. Association du taux d’hémoglobine avec la morbidité et la mortalité des patients atteints d’un carcinome de l’œsophage localement avancé subissant une radiothérapie – une analyse secondaire de trois essais cliniques consécutifs de phase III. Clin Oncol (R Coll Radiol). 2006; 18: 621-627.
15. Glaspy JA. Le développement d’agents érythropoïétiques en oncologie. Expert Opin Emerg Drugs. 2005; 10: 553-567.
16. Adamson JW, Spivak JL. Base physiologique de l’utilisation pharmacologique de l’érythropoïétine humaine recombinante en chirurgie et traitement du cancer. Opération. 1994; 115: 7-15.
17. Ferrario E, Ferrari L, Bidoli P, et al. Traitement de l’anémie liée au cancer avec l’époétine alfa: une revue. Cancer Treat Rev. 2004; 30: 563-575.
18. Lyman GH, Glaspy J. Y a-t-il des avantages cliniques avec une intervention érythropoïétique précoce pour l’anémie induite par la chimiothérapie? Revue asymétrique. Cancer. 2006; 106: 223-233.
19. Rizzo JD, Brouwers M, Hurley P et coll. AmericanSociety of Clinical Oncology / American Society of Hematology Clinicalpractice guideline update on the use of epoetin and darbepoetin in adultpatients with cancer. J Clin Oncol. 2010; 28: 4996-5010.
20. Informations posologiques sur Aranesp (darbepoetin alfa).Thousand Oaks, Californie: Amgen Inc; Mai 2012.
21. Informations posologiques de Procrit (époétine alfa). Horsham, PA: Janssen Products, LP; Juillet 2012.
22. Beutel G, Ganser A. Risques et avantages des agents stimulant l’érythropoïèse dans la gestion du cancer. Semin Hematol. 2007; 44: 157-165.
23. Fenner MH, Ganser A. Érythropoïétine dans l’anémie liée au cancer. Curr Opin Oncol. 2008; 20: 685-689.
24. Smith RE Jr, Aapro MS, Ludwig H et coll. Darbepoetinalfa pour le traitement de l’anémie chez les patients atteints d’un cancer actif ne recevant ni chimiothérapie ni radiothérapie: résultats d’une étude de phase III, multicentrique, randomisée, en double aveugle, contrôlée versus placebo. J Clin Oncol. 2008; 26: 1040-1050.
25. Programme d’oncologie ESA APPRISE. Produits Amgen et Janssen, LP. www.esa-apprise.com. Consulté le 13 octobre 2013.