Cas clinique
Une femme de 45 ans avec une histoire de 20 ans de la maladie de Crohn a présenté avec fièvre, frissons et fatigue pendant 10 jours. Peu de temps avant l’apparition des symptômes, la patiente a subi une coloscopie sans complications au cours de laquelle elle a subi 17 biopsies à des fins de surveillance ou de polypectomie. Au cours de la coloscopie, sa maladie de Crohn était en rémission et aucune inflammation des muqueuses n’a été notée.
Au SU, les signes vitaux de la patiente étaient HR 110, BP 120/80, RR 18, T 102,5. Elle avait une légère sensibilité abdominale supérieure droite. Des études de laboratoire ont révélé une numération des globules blancs élevée (15 000) et une AST et ALT élevées (120/137 U / L), avec une phosphatase alcaline légèrement élevée de 200 UI / L. Une tomodensitométrie (TDM) de l’abdomen a révélé de multiples zones de faible atténuation dans le lobe hépatique droit compatibles avec des abcès hépatiques. Le drainage des abcès a été mis en culture et s’est développé Streptococcus anginosus. La résolution de toutes les lésions est survenue après avoir été drainées par radiologie interventionnelle, et le patient a reçu une cure d’antibiotiques intraveineux de 6 semaines.
Introduction
La coloscopie est une procédure couramment pratiquée dans le diagnostic et le traitement d’un large éventail d’affections, notamment le cancer, les maladies inflammatoires de l’intestin, les polypes, les saignements et les sténoses. Selon l’American Cancer Society, une coloscopie de dépistage est recommandée tous les 10 ans à partir de 50 ans.1 Chez les patients à haut risque tels que ceux atteints d’une maladie inflammatoire de l’intestin, la coloscopie est pratiquée plus souvent. La procédure reste le moyen le plus efficace de trouver et d’éliminer les petits polypes précancéreux et de réduire ainsi le risque de décès par cancer du côlon et du rectum.
En général, la coloscopie est très sûre. Une revue systématique de 2008 de 12 études totalisant 57742 coloscopies effectuées pour le dépistage du risque moyen a montré un taux global d’événements indésirables graves de seulement 2,8 pour 1000 procédures et une mortalité de 0,007% .2 Cependant, le risque de coloscopie n’est pas constant entre les groupes, et certaines complications sont plus courants que d’autres. Les adultes plus âgés courent un risque accru de complications graves par rapport aux patients plus jeunes. Dans une étude portant sur 53 220 coloscopies, les patients âgés de 80 à 84 ans présentaient un taux significativement plus élevé de complications graves par rapport aux patients âgés de 66 à 69 ans. Le risque de complications graves a également augmenté chez les patients souffrant de comorbidités telles que des antécédents d’accident vasculaire cérébral, de BPCO, de fibrillation auriculaire et d’insuffisance cardiaque.
L’abcès hépatique pyogène (PLA) est une complication rare mais grave de la coloscopie . La plupart des complications de la coloscopie se présenteront dans les 7 jours, mais l’APL peut se présenter des jours, voire des semaines plus tard, et les antécédents de coloscopie récente peuvent même ne pas être obtenus à moins que le clinicien ne connaisse cette entité.4-6 En raison de la nature retardée de PLA, ces patients sont susceptibles d’être diagnostiqués au service des urgences.
Autres complications tardives telles que le syndrome d’électrocoagulation post-polypectomie, et les problèmes plus courants d’hémorragie retardée, de douleurs abdominales non spécifiques, de réactions aux agents de sédation , et la perforation peut également être vue dans l’ED. En revanche, une explosion de gaz ou des saignements immédiats seront rarement observés au SU, car ces problèmes se présentent généralement rapidement dans la salle d’endoscopie, où ils sont traités de manière urgente. Les médecins de l’urgence doivent être conscients de toutes les complications possibles et de leur évolution dans le temps et disposer des outils pour diagnostiquer et traiter correctement le patient malchanceux post-coloscopique qui souffre d’une complication grave.
Complications
Pyogène Abcès hépatique
L’APL est une maladie dangereuse avec une morbidité et une mortalité élevées qui surviennent à un taux de 10 à 20 cas pour 100 000 hospitalisations.4-6 Grâce aux progrès des techniques de diagnostic et des interventions, la mortalité s’améliore.7 Cependant, les patients courent toujours un grave danger, surtout si le diagnostic est retardé, comme c’est souvent le cas, car les patients peuvent se présenter de manière non spécifique. Une étude rétrospective de 63 patients atteints de PLA a montré que la fièvre était fréquente (59%), mais d’autres signes et symptômes tels que la douleur du quadrant supérieur droit et les signes péritonéaux étaient présents dans seulement 39% et 14%, respectivement.8 Le diagnostic dans cette étude était souvent retardé en moyenne d’une semaine après l’apparition des symptômes.
La coloscopie est un précipitant rare mais probablement sous-reconnu du PLA. On pense que des micro-perforations silencieuses pendant la procédure conduisent à une infection qui peut ensemencer le foie à travers la circulation porte. De même, d’autres infections intra-abdominales telles que la diverticulite peuvent potentiellement provoquer une PLA si la zone infectée est drainée par la veine porte.9 La clairance hépatique des bactéries via le réseau porte est un phénomène normal chez les patients sains, mais une obstruction biliaire, une mauvaise perfusion et une charge bactérienne élevée (comme dans le cas d’une infection ou de multiples biopsies lors d’une coloscopie ensemencant la circulation sanguine) peuvent prédisposer à la prolifération et à l’abcès formation. La littérature décrit environ 34% des cas de PLA comme étant cryptogènes, mais une partie de ceux-ci pourrait bien être des patients ayant subi une coloscopie récente qui n’a pas été reconnue comme un facteur de risque pour le processus de la maladie.8
La plupart des isolats de PLA sont polymicrobiens et composé d’une flore entérique normale. Les hémocultures sont positives dans 33 à 65% des cas, mais les cultures d’abcès sont presque toutes positives.10 Les microorganismes les plus couramment isolés sont les espèces Streptococcus (37%), Eserichia Coli (33%), les espèces Bacteroides (24%), Klebsiella pneumoniae (18%) et des streptocoques microaérophiles (12%). 10-11 Strep anginosus, trouvé dans le cas de ce patient, est un coccus anaérobie facultatif Gram-positif et l’un des organismes les plus courants trouvés dans l’APL.
Un diagnostic rapide du PLA est essentiel, car même si le diagnostic et le traitement s’améliorent, la mortalité reste à 10% .5,7 Les complications infectieuses de la coloscopie en général sont rares, mais là encore, la relation causale est probablement sous-reconnue. La coloscopie a été impliquée dans au moins quelques cas de PLA.12-14 Mais la bactériémie systémique transitoire, observée dans 4% des coloscopies, ne semble pas augmenter le risque d’infection en soi.15 On pense plutôt que l’infection dans le PLA se propage via de réelles microperforations.
S’il est connu que les perforations franches sont relativement rares (moins de 0,1% des coloscopies), l’incidence et la physiopathologie des microperforations ne sont pas entièrement connues.16-17 Armé de la connaissance de cette clinique entité, un clinicien qui a de bons antécédents et qui a un indice de suspicion élevé peut diagnostiquer plus rapidement l’APL chez un patient ayant subi une coloscopie récente.
Infection
Il est communément admis qu’une bactériémie transitoire après la coloscopie se produit dans environ 4% des procédures, bien que la fourchette soit de 0 à 25% et que les facteurs de risque de bactériémie ne soient pas définis.18 Des taux plus élevés de bactériémie surviennent au cours des activités quotidiennes de routine telles que le brossage des dents et la mastication d’aliments. Bien que les signes ou symptômes d’infection systémique chez les patients atteints de bactériémie transitoire soient rares, les patients peuvent ressentir de la fièvre, des frissons et des plaintes imitant tout, des infections des voies respiratoires supérieures aux infections abdominales.18
Bien que la bactériémie transitoire soit un risque accepté de coloscopie , il n’y a aucun bénéfice prouvé pour la prophylaxie antibiotique de routine et la plupart des patients n’auront pas pris d’antibiotiques péri-procédure.18 Les directives actuelles de l’American Society for Gastroenterology (ASGE) sont d’accord avec l’American Heart Association (AHA) et recommandent de ne pas prendre d’antibioprophylaxie pour patients subissant une coloscopie de routine.19
Il peut être difficile de différencier les symptômes d’une bactériémie transitoire d’une véritable infection.18 En général, les patients présentant des symptômes infectieux dans les jours suivant la coloscopie justifient des études de laboratoire comprenant des hémocultures, et selon l’indice de suspicion de perforation, d’imagerie abdominale 20-21 Si la suspicion de perforation est faible ou le diagnostic s est exclue, une hydratation IV et des antibiotiques peuvent être administrés si l’état clinique du patient le justifie.
Saignement
Le saignement post-polypectomie peut être immédiat ou retardé. Les saignements immédiats sont associés aux techniques de polypectomie qui n’utilisent pas de cautérisation ou lorsque le courant mélangé est utilisé pour la procédure. Les saignements retardés sont plus fréquemment observés au SU, car les saignements immédiats sont souvent détectés au moment de la procédure et traités par l’endoscopiste. Un saignement retardé peut être observé jusqu’à 7 jours après la procédure. On pense qu’il se produit en raison de la desquamation d’une escarre qui recouvrait un vaisseau sanguin ou en raison de l’extension de la zone de nécrose thermique à un tissu non lésé, ce qui pourrait entraîner un saignement s’il implique un vaisseau sanguin.19,22
Plusieurs grandes études ont rapporté une hémorragie dans 1 à 6 coloscopies sur 1000 (0,1% -0,6%) .22 Cependant, une étude analysant plus de 50 000 coloscopies a révélé que le taux d’hémorragie gastro-intestinale était significativement différent selon que la polypectomie était pratiquée. Le saignement post-polypectomie se produit à 1-2%, avec des taux plus élevés observés avec l’élimination des polypes plus gros. Le risque d’hémorragie post-polypectomie peut être augmenté chez les patients atteints de thrombocytopénie ou de coagulopathies.23
Les facteurs de risque connus d’hémorragie post-coloscopie comprennent la taille du polype, le nombre de polypes retirés, des antécédents d’utilisation d’anticoagulant récent ou un polype histologie.22 Curieusement, de nombreuses études de grande envergure n’ont pas trouvé que l’utilisation d’aspirine était associée à un saignement post-polypectomie.24-26
Les patients présentant une hémorragie retardée peuvent présenter des signes de saignement ou d’anémie, y compris fatigue, faiblesse , pâleur, saignement important ou caillots lors de l’essuyage, tachycardie, douleur thoracique et essoufflement.Les patients peuvent décrire une hématochézie ou une méléna, selon l’emplacement du saignement.
La prise en charge initiale d’un patient suspecté d’hémorragie comprend le traitement de base des voies respiratoires, de la respiration et de la circulation avec 2 intraveineuses de gros calibre, des liquides cristalloïdes et surveillance cardiaque. Les patients présentant un saignement gastro-intestinal inférieur macroscopique peuvent se décompenser rapidement et doivent avoir un type et un dépistage actifs au cas où une transfusion serait nécessaire.
L’imagerie n’est pas toujours nécessaire et, si possible, la décision d’imagerie doit être prise avec le GI consulter, de préférence le médecin qui a effectué la coloscopie. La coloscopie répétée est souvent la procédure diagnostique et thérapeutique de choix. L’American College of Radiology attribue la cote de pertinence la plus élevée à la coloscopie, bien qu’elle inclue également le CTA de l’abdomen / du bassin et le Tc-99m RBC scan abdomen / pelvis comme étapes appropriées du diagnostic.27
Si le patient est instable et que l’endoscopiste qui effectue le test n’est pas disponible, le médecin du service d’urgence doit consulter la radiologie interventionnelle générale (IR), GI et la chirurgie.
Perforation
La perforation coloscopique (CP) est l’une des complications les plus graves et les plus redoutées de la coloscopie. Bien que rare, la CP entraîne une morbidité et une mortalité élevées28-32 La perforation peut résulter de forces mécaniques contre la paroi intestinale, d’un barotraumatisme ou d’un électrocautérisation et peut entraîner la formation d’abcès, la formation de fistules, une septicémie intra-abdominale, une hospitalisation prolongée mort.
La CP survient dans environ 0,016% des coloscopies diagnostiques mais peut être observée dans jusqu’à 5% des coloscopies thérapeutiques.33-35 En fonction de ce qui a été réellement fait pendant la coloscopie, le risque de perforation peut être plus élevé ou inférieur à la moyenne, il peut donc être utile d’obtenir le rapport opératoire ou les antécédents de l’endoscopiste pour déterminer le risque.
Risque de CP pour diverses procédures coloscopiques: 1,36-37
-Coloscopie de dépistage: 0,01-0,1%
-Dilatation de la sténose anastomotique: 0-6%
-Dilatation de la sténose de la maladie de Crohn: 0-18%
-Stent placement: 4%
-Positionnement du tube de décompression colonique: 2%
-Résection endoscopique de la muqueuse colonique 0-5%
En dehors des événements survenus lors de la procédure, les facteurs de risque spécifiques de la CP comprennent l’âge avancé, les comorbidités multiples, la diverticulose, l’obstruction, la résection de polypes, les polypes de plus de 1 cm ou ceux trouvés dans le côlon droit, la mobilité réduite du côlon, la faiblesse existante de la paroi colique , précédente tentative incomplète de coloscopie ou inexpérience de l’endoscopiste.20
Les patients atteints de PC peuvent présenter des douleurs abdominales soudaines et qui s’aggravent, suivies d’une dissipation complète faussement rassurante de la douleur lorsque la perforation décompresse l’organe enflammé. À mesure que le contenu gastro-intestinal continue de se répandre dans le péritoine, une aggravation de la douleur et des symptômes péritonéaux se développent. Cependant, les symptômes varient en fonction de l’emplacement et de la taille de la perforation, du degré d’infiltration fécale dans le péritoine, de l’âge et des comorbidités du patient.
Notamment, les perforations peuvent également être rétro-péritonéales, correspondant à la localisation du côlon ascendant et descendant et des flexions hépatique et splénique. Bien que le symptôme le plus courant d’une perforation colique soit une douleur abdominale, les patients âgés peuvent avoir une réponse émoussée. Les autres symptômes comprennent la fièvre, les nausées, les vomissements, la dyspnée, les douleurs thoraciques, les douleurs scapulaires et les douleurs cervicales. Les perforations rétropéritonéales en particulier peuvent avoir des symptômes minimes ou atypiques, et les signes vitaux peuvent montrer une tachycardie et de la fièvre, mais peuvent également être normaux.20
La prise en charge initiale d’une perforation suspectée comprend une attention aux voies respiratoires, à la respiration, à la circulation avec 2 IV de gros calibre, liquides cristalloïdes et moniteur cardiaque. Des laboratoires comprenant le CBC, le CMP, la lipase, le type et le dépistage doivent être obtenus. Le patient doit être strictement NPO avec des antibiotiques empiriques IV. L’imagerie statistique avec TDM de l’abdomen / du bassin ou une radiographie abdominale si instable doit être commandée parallèlement à une consultation chirurgicale statique.21
Syndrome post-polypectomie
Syndrome post-polypectomie, également connu sous le nom de syndrome d’électrocoagulation post-polypectomie ou syndrome de brûlure transmurale, résulte d’une blessure par électrocoagulation de la paroi intestinale, créant une brûlure transmurale et une péritonite focale sans perforation franche38. ). Un syndrome post-polypectomie a été rapporté chez 6 patients sur 16318 coloscopies réalisées entre 1994 et 2002 dans un grand système de santé intégré.39 Les facteurs de risque de cette complication rare sont inconnus.
Les patients atteints du syndrome post-polypectomie présentent généralement dans les 12 heures suivant la coloscopie avec fièvre, tachycardie et douleurs abdominales. Cependant, l’apparition des symptômes peut être retardée de 5 à 7 jours après la procédure.40 Les patients ont souvent une leucocytose et peuvent présenter une rigidité et une tachycardie, qui imitent toutes une perforation du côlon.41
Cependant, contrairement à la perforation, qui peut nécessiter une intervention chirurgicale urgente, les patients atteints du syndrome post-polypectomie sont généralement traités de manière conservatrice avec des liquides intraveineux, un contrôle de la douleur et une évolution progressive de l’alimentation, avec ou sans antibiotiques ciblés agents pathogènes négatifs et anaérobies.42 Les cas moins graves peuvent même être pris en charge en ambulatoire avec des antibiotiques oraux et des liquides clairs pendant 1 à 2 jours.42-43
Comme ces patients peuvent ne pas être distingués des patients perforés, tout patient suspecté de syndrome post-polypectomie nécessite des laboratoires et une imagerie. Dans le syndrome post-polypectomie, la tomodensitométrie présentera généralement un épaississement focal de la paroi du côlon avec échouement de graisse environnant sans air extra-muros, bien que dans les cas bénins, la tomodensitométrie puisse être négative.42 Quel que soit le résultat de l’imagerie, comme pour la perforation, si le syndrome post-polypectomie est suspectée, le patient doit avoir une consultation chirurgicale.
Perles
- La coloscopie est un test de dépistage largement utilisé chez les patients de plus de 50 ans. Les complications peuvent être précoces ou retardées. Les médecins de médecine d’urgence doivent être conscients des complications possibles et de leur calendrier prévu, afin de diagnostiquer et de gérer avec précision toute complication possible.
- Les complications comprennent l’hémorragie, la perforation, le syndrome post-polypectomie, l’infection, l’explosion de gaz et abcès hépatique pyogène.
- Des antécédents sur les facteurs liés au patient et la procédure elle-même (conditions sous-jacentes, médicaments, élimination des polypes, cautérisation, hémorragie immédiate) peuvent guider le diagnostic et la prise en charge au SU.
- L’abcès hépatique pyogène peut se présenter 1 à 2 semaines après la coloscopie avec douleur dans le quadrant supérieur droit et fièvre.
- Une grande partie du côlon est rétropéritonéale. Les perforations rétropéritonéales peuvent provoquer des symptômes vagues et atypiques, donc l’indice de suspicion doit être élevé.
- Le syndrome post-polypectomie peut imiter une perforation et peut généralement être différencié par imagerie.
Références / Lectures complémentaires:
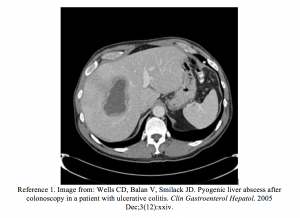
- Wells CD, Balan V, Smilack JD. Abcès hépatique pyogène après coloscopie chez un patient atteint de rectocolite hémorragique. Clin Gastroenterol Hepatol. Décembre 2005; 3 (12): xxiv.
- Whitlock, E.P., Lin, J.S., Liles, E. et al. Dépistage du cancer colorectal: une revue systématique ciblée et mise à jour pour le US Preventive Services Task Force. Ann Intern Med. 2008; 149: 638-658.
- Warren JL, Klabunde CN, Mariotto AB, Meekins A, Topor M, Brown ML, Ransohoff. Événements indésirables après coloscopie ambulatoire dans la population Medicare. Ann Intern Med. 2009; 150 (12): 849.
- Johannsen EC, CD Sifri, Madoff LC. Abcès hépatiques pyogènes.Infect Dis Clin North Am. 2000; 14: 547–63.
- Meddings L, Myers RP, Hubbard J, et al. Une étude basée sur la population des abcès hépatiques pyogènes aux États-Unis: incidence, mortalité et tendances temporelles. Am J Gastroenterol. 2010; 105: 117–24.
- Kaplan GG, Gregson DB, Laupland KB. Étude basée sur la population de l’épidémiologie et des facteurs de risque d’abcès hépatique pyogène. Clin Gastroenterol Hepatol. 2004; 2: 1032-8.
- Petri A, Höhn J, Hódi Z, Wolfárd A, Balogh A. Abcès hépatique pyogène – 20 ans d’expérience. Comparaison des résultats du traitement en deux périodes. Langenbecks Arch Surg. 2002; 387: 27–31.
- Pang TC, Fung T, Samra J, Hugh TJ, Smith RC. Abcès hépatique pyogène: un audit de 10 ans d’expérience. Monde J Gastroenterol. 2011; 17: 1622–30.
- Murarka S, Pranav F, Dandavate V. DisseminatedStreptococcus anginosus de diverticulite sigmoïde. J Glob Infect Dis. 2011; 3: 79–81.
- Branum GD, Tyson GS, Branum MA, Meyers WC. Abcès hépatique. Changements d’étiologie, de diagnostic et de prise en charge. Ann Surg. 1990 décembre 212 (6): 655-62.
- Gyorffy EJ, Frey CF, Silva J Jr, McGahan J. Pyogenic liver abcess. Stratégies diagnostiques et thérapeutiques. Ann Surg. 1987 décembre 206 (6): 699-705.
- Bonenfant F, Rousseau É, Farand P. Streptococcus anginosuspyogenic abcès hépatique après une coloscopie de dépistage. La Revue canadienne des maladies infectieuses & Microbiologie médicale. 2013; 24 (2): e45-e46.
- Ian G. Harnik. Abcès hépatique pyogène se présentant après une polypectomie maligne.Dig Dis Sci. 2007; 52: 3524–5.
- Paraskeva KD, Bury RW, Isaacs P. Abcès du foie de Steptococcus milleri: une complication inhabituelle après l’ablation coloscopique d’une arête de poisson incluse. Gastrointest Endosc. 2000; 51: 357–8.
- Low DE, Shoenut JP, Kennedy JK, et al. Évaluation prospective du risque de bactériémie par coloscopie et polypectomie. Dig Dis Sci. 1987; 32: 1239–43.
- Becker F, Nusko G, Welke J, Hahn EG, Mansmann U. Suivi après polypectomie colorectale: Une analyse bénéfice-risque des recommandations de surveillance allemandes. Int J Colorectal Dis. 2007; 22: 929–39.
- Macrae FA, Tan KG, Williams CB. Vers une coloscopie plus sûre: un rapport sur les complications de 5000 coloscopies diagnostiques ou thérapeutiques. Intestin. 1983; 24: 376–83.
- Nelson, D.B.Complications des maladies infectieuses de l’endoscopie gastro-intestinale: partie II, infections exogènes. Gastrointest Endosc. 2003; 57: 695 à 711.
- Khashab, M.A., Chithadi, K.V., Acosta, R.D. et al. Prophylaxie antibiotique pour l’endoscopie gastro-intestinale. Comité des normes de pratique de l’ASGE. Gastrointest Endosc. 2015; 81: 81-89.
- Lohsiriwat V. Perforation coloscopique: incidence, facteurs de risque, prise en charge et issue. Journal mondial de gastroentérologie: WJG. 2010; 16 (4): 425-430.
- American College of Radiology ACR Appropriateness Criteria: Acute (Nonlocalized)
- Ko, C.W. et Dominitz, J.A. Complications de la coloscopie: ampleur et prise en charge. Gastrointest Endosc Clin N Am. 2010; 20: 659 à 671.
- Warren JL, Klabunde CN, Mariotto AB, et al. Événements indésirables après coloscopie ambulatoire dans la population Medicare. Ann Intern Med 2009; 150: 849-57.
- Hui, A.J., Wong, R.M., Ching, J.Y. et coll. Risque d’hémorragie polypectomie coloscopique avec anticoagulants et antiagrégants plaquettaires: analyse de 1657 cas. Gastrointest Endosc. 2004; 59: 44-48.
- Sawhney, M.S., Salfiti, N., Nelson, D.B. et coll. Facteurs de risque d’hémorragie postpolypectomie retardée sévère. Endoscopie. 2008; 40: 115-119
- Yousfi, M., Gostout, C.J., Baron, T.H. et coll. Hémorragie gastro-intestinale basse après polypectomie: rôle potentiel de l’aspirine. Am J Gastroenterol. 2004; 99: 1785–1789.
- Critères de pertinence de l’ACR de l’American College of Radiology: Gestion radiologique du saignement du tractus gastro-intestinal inférieur. https://acsearch.acr.org/docs/69457/Narrative/ (Consulté le 16 juillet 2017).
- Lohsiriwat V, Sujarittanakarn S, Akaraviputh T, Lertakyamanee N, Lohsiriwat D, Kachinthorn U. Coloscopic perforation: A report du centre de formation en endoscopie de l’Organisation mondiale de la gastroentérologie en Thaïlande. Monde J Gastroenterol. 2008; 14: 6722–6725.
- Iqbal CW, Cullinane DC, Schiller HJ, Sawyer MD, Zietlow SP, Farley DR. Prise en charge chirurgicale et résultats de 165 perforations coloscopiques d’un seul établissement. Arch Surg. 2008; 143: 701–706; discussion 706-707.
- Teoh AY, Poon CM, Lee JF, Leong HT, Ng SS, Sung JJ, Lau JY. Résultats et prédicteurs de la mortalité et de la formation de stomies dans la gestion chirurgicale des perforations coloscopiques: une revue multicentrique. Arch Surg. 2009; 144: 9–13.
- Lüning TH, Keemers-Gels ME, Barendregt WB, Tan AC, Rosman C. Coloscopic perforations: a review of 30.366 patients. Surg Endosc. 2007; 21: 994–997.
- Mai CM, Wen CC, Wen SH, Hsu KF, Wu CC, Jao SW, Hsiao CW. Perforation iatrogène colique par coloscopie: une complication mortelle pour les patients à haut risque anesthésique. Int J Colorectal Dis. 2010 avril; 25 (4): 449-54.
- Rathgaber SW, Wick TM. Taux d’achèvement et de complications de la coloscopie dans un cabinet de gastro-entérologie communautaire. Gastrointest Endosc. 2006; 64: 556–562.
- Damore LJ, Rantis PC, Vernava AM, Longo WE. Perforations coloscopiques. Étiologie, diagnostic et prise en charge. Dis Colon Rectum. 1996; 39: 1308–1314.
- Repici A, Pellicano R, Strangio G, Danese S, Fagoonee S, Malesci A. Résection muqueuse endoscopique pour néoplasie colorectale précoce: base pathologique, procédures et résultats. Dis Colon Rectum. 2009; 52: 1502-1515.
- Chukmaitov A, Bradley CJ, Dahman B, et al. Association des techniques de polypectomie, du volume de l’endoscopiste et du type d’établissement avec les complications de la coloscopie. Gastrointest Endosc. 2013; 77: 436.
- Fisher DA, Maple DT, et al. Complications de la coloscopie. Comité des normes de pratique ASGE Gastrointest Endosc. 2011; 74: 745. Douleur et fièvre abdominales ou suspicion d’abcès abdominal; Variante 1: patient postopératoire avec fièvre. https://acsearch.acr.org/docs/69356/Narrative/ (Consulté le 17 juillet 2017).
- Hirasawa K, Sato C, Makazu M, et al. Syndrome de coagulation: Perforation retardée après des traitements endoscopiques colorectaux. Journal mondial de l’endoscopie gastro-intestinale. 2015; 7 (12): 1055-1061.
- Levin TR, Zhao W, Conell C, Seeff LC, Manninen DL, Shapiro JA, Schulman J. Complications of coloscopy in an integrated health care delivery system. Ann Intern Med. 2006; 145 (12): 880.
- Kim HW. Quelle est la différence entre la fièvre post-polypectomie et le syndrome de coagulation post-polypectomie? Clin Endosc. 2014; 47 (3): 205–6.
- Stock C, Ihle P, Sieg A, Schubert I, Hoffmeister M, Brenner H Evénements indésirables nécessitant une hospitalisation dans les 30 jours suivant le dépistage ambulatoire et les coloscopies sans dépistage. Gastrointest Endosc. 2013 mars; 77 (3): 419-29.
- Sethi A, Song LMWK. Événements indésirables liés à la résection endoscopique de la muqueuse du côlon et à la polypectomie. Gastrointest Endosc Clin N Am. 2015; 25 (1): 55–69.
- Benson BC, les juges Myers, Laczek JT. Syndrome d’électrocoagulation postpolypectomie: un mimicker de la perforation colique. Case Rep Emerg Med. 2013; 2013 687931.