- La présence de concentrations élevées d’anticorps (titre > 1: 640) devrait faire douter qu’une maladie auto-immune soit cadeau. Dans ce scénario, je recommande que les sérums soient ensuite testés pour les anticorps anti-ADNdb, Sm, RNP, Ro (SS-A), La (SS-B) et peut-être Scl-70. La présence d’anticorps dirigés contre l’un de ces éléments augmente considérablement la probabilité que le patient souffre de LED, de MCTD, de Sjögren ou de sclérodermie. Certains laboratoires testent automatiquement ces anticorps chaque fois que le dépistage ANA est positif. Cependant, la présence de ces anticorps n’est pas un diagnostic de maladie. Si aucun diagnostic initial ne peut être posé, ma pratique consiste à surveiller attentivement le patient au fil du temps pour le développement d’une maladie associée aux ANA, et à voir le patient au moins deux fois par an.
- La combinaison de faibles titres d’anticorps (< 1:80) et peu ou pas de signes ou symptômes de maladie laisse présager une probabilité beaucoup plus faible d’une maladie auto-immune. Par conséquent, ces patients avec des titres ANA faibles doivent être réévalués moins fréquemment, chaque année, à moins que les symptômes cliniques n’évoluent pour suggérer une maladie auto-immune.
- Il est très peu probable qu’un patient avec un ANA négatif ait un LED, un MCTD , Sjögren ou sclérodermie. Cependant, s’il existe encore des preuves cliniques solides d’une maladie auto-immune systémique, on peut tester les anticorps spécifiques à l’ADN double brin (ds), Sm, RNP, Ro, La ou Scl-70, bien que, d’après mon expérience, ils sont généralement négatifs. Néanmoins, il est prudent de voir ces patients avec un indice de suspicion clinique élevé, au moins une fois par an – bien que plus fréquemment si cela est cliniquement indiqué.
- Les anticorps antinucléaires produisent un large éventail de motifs de coloration (homogènes, diffus , périphérique, bord, moucheté, nucléolaire, anticentromère, etc.). Le modèle de coloration nucléaire a été reconnu pour avoir une sensibilité et une spécificité relativement faibles pour différentes maladies auto-immunes. La présence d’anticorps dirigés contre des antigènes nucléaires spécifiques est généralement plus utile. (Ces anticorps incluent les suivants: dsDNA, Sm, RNP, Ro, La ou Scl-70.)
Au cours des dernières années, les chercheurs et les entreprises de biotechnologie ont développé la phase solide immunoessais pour remplacer le test IF ANA.4-23 La justification de cette tentative est liée aux caractéristiques de performance de la technique IF. Ce test demande beaucoup de travail et est sujet à des variations en raison des différentes interprétations des techniciens. La décoloration de l’image lors de son examen au microscope fluorescent complique également les tests. En outre, la technique IF utilise des dilutions en série de sérums de patients, ce qui donnera des résultats qui peuvent ne pas être linéaires. Les variations de titre par deux sont courantes dans les tests quotidiens sur le même échantillon; les différences quadruples sont dites «significatives». En revanche, les dosages immunologiques en phase solide sont automatisés et hautement reproductibles. Les résultats sont linéaires, et la technique demande moins de main-d’œuvre, et donc moins coûteuse à réaliser.
En raison de ces considérations, il devrait y avoir des économies employant un immunoessai en phase solide pour quantifier un ANA. Ainsi, dans une tentative de développer des immunoessais ANA en phase solide, un certain nombre de groupes ont placé sur la phase solide les antigènes qui sont typiquement dosés dans les immunoessais ANA plus spécifiques (par exemple, ADN, Sm, RNP, Ro / SSA, La / SSB, nucléoprotéine, extraits cellulaires, etc.). Dans les rapports publiés, le coefficient de corrélation entre les titres ANA et ces dosages en phase solide est assez bon. Ainsi, de nombreuses entreprises commerciales ont changé leurs ANA Cependant, la fréquence / le pourcentage élevé de résultats faussement négatifs chez les patients atteints de LES et de maladies apparentées connues, ainsi que la fréquence élevée continue de «faux positifs» (p. ex., un ANA positif chez quelqu’un sans LED) dans ces études.15-21 Des travaux supplémentaires sont nécessaires pour améliorer la sensibilité et en particulier la spécificité de ces dosages immunologiques en phase solide afin de garantir que les patients atteints de LED et de maladies apparentées ne sont pas manqués par ces dosages immunologiques en phase solide.
Anticorps contre l’ADN
Les anticorps contre l’ADN peuvent être principalement divisés en ceux qui réagissent avec l’ADN simple brin (ss) et ceux qui reconnaissent l’ADNdb.24-26
Anti- Des anticorps anti-ADNsb ont été signalés dans le LED, la polyarthrite rhumatoïde, le lupus d’origine médicamenteuse, les parents sains de patients atteints de LED et, moins fréquemment, dans d’autres maladies rhumatismales. (Voir Tableau 2, p. 17.) Ainsi, l’anti-ADNsb a une utilité limitée pour le diagnostic du LED ou d’autres maladies rhumatismales. L’anti-ADNsb n’est pas bien corrélé à l’activité de la maladie et n’est donc pas utile pour la gestion de la maladie.
Les anticorps anti-ADNdb sont le plus souvent détectés par des tests immunologiques en phase solide, mais aussi dans certains laboratoires par le test Crithidia IF ou occasionnellement le radioimmunoessai Farr.La plupart des laboratoires hospitaliers et commerciaux n’en font qu’un. Le test Farr a probablement la spécificité la plus élevée et la sensibilité la plus faible des trois tests pour le diagnostic du LED, tandis que les tests en phase solide ont la sensibilité la plus élevée et la spécificité la plus faible; le test des crithidies se situe entre les deux. Le test de Farr présente également l’inconvénient d’utiliser des matières radioactives, que la plupart des laboratoires évitent, et le test des crithidies demande beaucoup de travail. Je préfère le test ELISA pour une utilisation quotidienne.
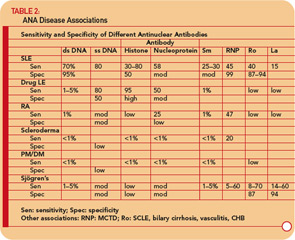
Les anti-ADNdb sont spécifiques (95%) mais pas très sensibles (70%) pour le SLE, ce qui les rend très utiles pour le diagnostic lorsqu’ils sont positifs.9 (Voir le tableau 2 , p. 17.) On les trouve parfois dans d’autres conditions, notamment la polyarthrite rhumatoïde, l’arthrite juvénile, le lupus d’origine médicamenteuse, l’hépatite auto-immune et même chez les personnes normales.
Les titres d’anticorps anti-ADNdb varient souvent avec une activité de la maladie, en particulier la néphrite lupique, et sont donc utiles chez de nombreux patients pour suivre l’évolution du LED. Si un patient a un titre en hausse, ou un titre très élevé, mais qu’il est cliniquement au repos, je ne traite pas l’anomalie sérologique, mais je considère cela comme un signe d’avertissement indiquant que le patient doit être suivi de plus près et traité lorsque quelque chose se produit cliniquement pour justifier un changement de thérapie. Cependant, certains chercheurs ont traité ces anomalies sérologiques (en particulier lorsqu’elles sont associées à de faibles niveaux de complément) et ont signalé une amélioration des résultats cliniques. Inversement, j’utilise un titre en baisse chez une personne qui va mieux après une poussée de traitement comme guide pour réduire le traitement (par exemple, corticostéroïdes et / ou immunosuppresseurs).
L’association entre les anticorps anti-ADNdb et d’autres les manifestations de la maladie du LED sont beaucoup moins claires. Par exemple, il n’y a pas de relation entre le titre anti-ADNdb et l’activité de la maladie du LED neuropsychiatrique.
Distinguer les manifestations actives du lupus des complications infectieuses ou des effets toxiques des médicaments – et des maladies non liées – est toujours un défi. La présence d’anticorps anti-ADNdb peut être utile chez certains patients pour faire cette distinction.
Anticorps anti-Smith et anti-ribonucléoprotéine
Anticorps contre Smith (Sm) et anti-ribonucléoprotéine (anti-RNP) sont le plus souvent détectés par des dosages immunologiques en phase solide.24,27
Les anticorps anti-Sm ne sont trouvés que chez 10% à 40% des patients atteints de LED, mais sont très peu fréquents chez les patients atteints d’autres conditions (c’est-à-dire qu’elles ne sont pas sensibles mais sont très spécifiques). La mesure des titres anti-Sm peut être utile pour le diagnostic, en particulier à un moment où les anticorps anti-ADN sont indétectables. Compte tenu de la sensibilité relativement faible de l’anti-Sm, cependant, une valeur négative n’exclut en aucun cas le diagnostic de LED.
Des anticorps anti-RNP sont trouvés chez environ 40% à 60% des patients atteints de LED, mais ne sont pas spécifiques au SLE, étant une caractéristique déterminante de MCTD. Ces anticorps peuvent également apparaître à des titres faibles et à de basses fréquences dans d’autres maladies rhumatismales, y compris la PR et la sclérodermie. (Voir Tableau 2, p. 17.)
Ni le titre (taux) d’anticorps anti-Sm ni anti-RNP ne correspond à une activité clinique.
Anti-Ro / SSA et les anticorps anti-La / SSB
Les anticorps anti-Ro / SSA et La / SSB sont le plus fréquemment détectés par des tests immunologiques en phase solide.28,29 Anti-Ro / SSA et anti-La / SSB ont été détectés en haute fréquence chez les patients atteints du syndrome de Sjögren et du LED, mais aussi chez les patients atteints de dermatite photosensible, et chez 0,1% à 0,5% des adultes en bonne santé.
Des anticorps anti-Ro / SSA sont retrouvés dans environ 50% des patients atteints de LED. (Voir Tableau 2, p. 17.) Ils ont été associés à une photosensibilité, un lupus cutané subaigu, une vascularite cutanée (purpura palpable), une maladie pulmonaire interstitielle, un lupus néonatal et un bloc cardiaque congénital. Des anticorps anti-Ro / SSA sont trouvés chez environ 75% des patients atteints du syndrome de Sjögren primaire (voir tableau 2, p. 17), et des titres élevés de ces anticorps sont associés à une plus grande incidence de caractéristiques extra-glandulaires, en particulier de purpura et de vascularite. En revanche, les anticorps Ro / SSA ne sont présents que chez 10% à 15% des patients atteints du syndrome de Sjögren secondaire associé à la polyarthrite rhumatoïde. Par conséquent, la présence d’anticorps Ro / SSA ou anti-La / SSB chez les patients suspectés de syndrome de Sjögren primaire soutient fortement le diagnostic.
Environ 50% des patients atteints de LED qui ont des anticorps anti-Ro ont également des -La anticorps, un antigène ARN-protéine étroitement apparenté. De même, la plupart des patients atteints du syndrome de Sjögren ont également des anticorps anti-La (SSB). Il est extrêmement rare de trouver des patients avec des anticorps anti-La sans anticorps anti-Ro.
À mon avis, les indications pour commander un test d’anticorps anti-Ro / SSA et anti-La / SSB sont les suivantes:
- Les femmes atteintes de LED qui sont enceintes ou peuvent devenir enceintes à l’avenir;
- Les femmes qui ont déjà donné naissance à un enfant souffrant de bloc cardiaque ou de myocardite;
- Les patients ayant des antécédents d’éruptions cutanées photosensibles inexpliquées;
- Patients fortement suspectés de SLE mais dont le test ANA est négatif; ou
- Patients présentant des symptômes de xérostomie, kératoconjonctivite sèche et / ou hypertrophie des glandes salivaires et lacrymales.
Anticorps anti-protéine P
Anti- Des anticorps anti-protéine ribosomale P ont été détectés chez 10% à 20% des patients atteints de LED aux États-Unis et 40% à 50% des patients asiatiques atteints de LED, mais rarement dans d’autres maladies rhumatismales.30 Les anticorps anti-protéine ribosomale P peuvent être fortement spécifique de la psychose associée au lupus, bien que toutes les études ne l’aient pas confirmé. La dépression et l’atteinte rénale et hépatique chez les patients atteints de lupus ont également été associées à des anticorps anti-ribosomaux de la protéine P dans certaines petites études.
En raison de la faible sensibilité et de la faible corrélation clinique, de nombreux chercheurs – dont moi-même – voient peu d’utilité clinique dans ce test.
Anticorps anti-centromères
Les anticorps anti-centromère (ACA) se trouvent presque exclusivement chez les patients atteints de sclérose systémique cutanée limitée (lcSSc), en particulier chez ceux atteints CREST.31 Des ACA ont été observés chez 57% des patients atteints de CREST, mais ont également été observés chez des patients présentant d’autres affections, y compris chez certains patients atteints du seul phénomène de Raynaud. Les ACA sont généralement détectés par le schéma IF caractéristique sur les cellules Hep-2.
Anticorps anti – Scl-70 (topoisomérase-1)
Environ 15% à 20% des patients atteints de sclérodermie ont des anticorps dirigés contre une protéine de 70 kd (topoisomérase-1), appelée par la suite Scl-70.31 La méthode habituelle de détection est l’ELISA. La présence de ces anticorps semble augmenter le risque de fibrose pulmonaire chez les patients atteints de sclérodermie et est assez spécifique de la maladie.
Résumé
Si l’on soupçonne un LED sur la base des antécédents, physique examen et numération globulaire complète (p. ex., leucopénie, thrombocytopénie), demander un test ANA. S’il est négatif, il est hautement improbable que le patient ait un LED et le patient peut être rassuré. Si le titre est < 1: 160, le LED est peu probable et le patient peut être rassuré que le LED est peu probable, mais le patient doit être suivi périodiquement. Un titre ≥1: 160 augmente la probabilité de LED et de troubles associés. Cependant, il est important de se rappeler que 85% des personnes avec un ANA positif n’ont pas de LED. Si l’ANA est positif, il faut également rechercher des anticorps anti-ADNdb, Sm, RNP, Ro / SSA et La / SSB. La présence de ces anticorps augmente considérablement la probabilité que le patient souffre de LED et de troubles associés (voir Tableau 2, p. 17), et le patient doit être suivi de plus près. La détection des anticorps anti-centromère et anti – Scl-70 est très utile pour le diagnostic de la sclérodermie. La détection des anticorps anti-Ro / SSA et La / SSB est également utile pour le diagnostic du syndrome de Sjögren.
Le seul de ces tests qui soit utile pour surveiller l’activité est l’anti-ADNdb.
Remerciements: Je suis redevable au travail de nombreux auteurs d’UpToDate in Medicine, dont le travail a fourni un cadre utile pour le développement de cet article, ainsi qu’aux Drs. Robert Shmerling, David Lee et Donald Bloch, avec lesquels j’ai écrit des articles et des chapitres sur ce même sujet.
Dr. Schur est professeur de médecine à la Harvard Medical School et à la division de rhumatologie, d’immunologie et d’allergie du département de médecine du Brigham and Women’s Hospital de Boston.
- Reichlin M. Mesure et signification clinique de anticorps antinucléaires. À jour. Octobre 2008.
- Comité ad hoc de l’American College of Rheumatology sur les lignes directrices en matière de tests immunologiques. Lignes directrices pour les tests de laboratoire immunologiques dans les maladies rhumatismales: une introduction. Arthritis Rheum. 2002; 47: 429-433.
- Solomon DH, Kavanaugh AJ, Schur PH, et al. Lignes directrices fondées sur des preuves pour l’utilisation des tests immunologiques: tests d’anticorps antinucléaires. Arthritis Rheum. 2002; 47: 434-444.
- Sinclair D, Saas M, Williams D, Hart M, Goswami R. Un ELISA peut-il remplacer l’immunofluorescence pour la détection d’anticorps anti-nucléaires? – ELISA de dépistage d’anticorps nucléaires. Clin Lab. 2007; 53: 183-191.
- Avaniss-Aghajani E, Berzon S, Sarkissian A. Valeur clinique des dosages immunologiques multiplexés à base de billes pour la détection d’autoanticorps contre les antigènes nucléaires. Clin Vaccine Immunol. 2007; 14: 505-509.
- Copple SS, Martins TB, Masterson C, Joly E, Hill HR. Comparaison de trois immunoessais multiplex pour la détection d’anticorps dirigés contre des anticorps nucléaires extractibles à l’aide de sérums définis cliniquement. Ann N Y Acad Sci.2007; 1109: 464-472.
- Caramaschi P., Ruzzenente O, Pieropan S, et al. Détermination de la spécificité ANA en utilisant un dosage immunologique multiplexé sur microsphères fluorescentes chez des patients présentant une positivité ANA à des titres élevés après un traitement par infliximab: résultats préliminaires. Rheumatol Int. 2007; 27: 649-654.
- Biagini RE, Parks CG, Smith JP, Sammons DL, Robertson SA. Performance analytique du test AtheNA MultiLyte ANA II dans des sérums de patients atteints de lupus avec plusieurs AAN positifs. Anal Bioanal Chem. 2007; 388: 613-618.
- Gonzalez C, Garcia-Berrocal B, Perez M, et al. Dépistage en laboratoire des maladies du tissu conjonctif par un nouveau test de dépistage automatisé ENA (EliA Symphony) chez des patients cliniquement définis. Clin Chim Acta. 2005; 359: 109-114.
- Eissfeller P, Sticherling M, Scholz D, et al. Comparaison de différents systèmes de test pour la détection simultanée d’auto-anticorps dans les maladies du tissu conjonctif. Ann N Y Acad Sci. 2005; 1050: 327-339.
- Smith J, Onley D, Garey C, et al. Détermination de la spécificité ANA à l’aide de la plateforme UltraPlex. Ann N Y Acad Sci. 2005; 1050: 286-294.
- Martins TB, Burlingame R, von Muhlen CA, et al. Évaluation du dosage immunologique de microsphères fluorescentes multiplexées pour la détection d’auto-anticorps contre les antigènes nucléaires. Clin Diagn Lab Immunol. 2004; 11: 1054-1059.
- Bernardini S, Infantino M, Bellincampi L, et al. Criblage des anticorps antinucléaires: Comparaison entre un dosage immunoenzymatique basé sur des homogénats nucléaires, des antigènes purifiés ou recombinants et un test d’immunofluorescence. Clin Chem Lab Med. 2004; 42: 1155-1160.
- Nossent H, Rekvig OP. Dépistage des anticorps antinucléaires en ce nouveau millénaire: adieu au microscope? Scand J Rheumatol. 2001; 30: 123-126; discussion 127-128.
- Lopez-Hoyos M, Rodriguez-Valverde V, Martinez-Taboada V. Performance du dépistage de la maladie du tissu conjonctif par anticorps antinucléaires. Ann N Y Acad Sci. 2007; 1109: 322-329.
- Ghillani P, Rouquette AM, Desgruelles C, et al. Évaluation du test de dépistage LIAISON ANA pour les tests d’anticorps antinucléaires dans les maladies auto-immunes. Ann N Y Acad Sci. 2007; 1109: 407-413.
- Bonilla E, Francis L, Allam F, et al. La microscopie par immunofluorescence est supérieure aux billes fluorescentes pour la détection de la réactivité des anticorps antinucléaires chez les patients atteints de lupus érythémateux disséminé. Clin Immunol. 2007; 124: 18-21.
- Nifli AP, Notas G, Mamoulaki M, et al. Comparaison d’un test fluorescent multiplex à base de billes et de méthodes d’immunofluorescence pour la détection d’autoanticorps ANA et ANCA dans le sérum humain. J Immunol Methods. 2006; 311: 189-197.
- Shovman O, Gilburd B, Zandman-Goddard G, et al. Test immunologique multi-lyte AtheNA multiplexé pour le dépistage des ANA dans les maladies auto-immunes. Auto-immunité. 2005; 38: 105-109.
- Ulvestad E. Caractéristiques de performance et utilité clinique d’un ELISA hybride pour la détection de l’ANA. Apmis. 2001; 109: 217-222.
- Olaussen E, Rekvig OP. Tests de dépistage des anticorps antinucléaires (ANA): Utilisation sélective d’antigènes nucléaires centraux comme base rationnelle pour le dépistage par ELISA. J Autoimmun. 1999; 13: 95-102.
- Homburger HA, Cahen YD, Griffiths J, Jacob GL. Détection des anticorps antinucléaires: évaluation comparative des méthodes immunoenzymatiques et d’immunofluorescence indirecte. Arch Pathol Lab Med. 1998; 122: 993-999.
- Gniewek RA, Stites DP, McHugh TM, Hilton JF, Nakagawa M. Comparaison des méthodes de test des anticorps antinucléaires: essai d’immunofluorescence versus immunoessai enzymatique. Clin Diagn Lab Immunol. 1997; 4: 185-188.
- Reichlin M. Anticorps contre l’ADN, la SM et la RNP. À jour. Octobre 2008.
- Hahn BH. Anticorps contre l’ADN. Nouveau Engl J Med. 1998; 338: 1359.
- Kavanaugh AF, Solomon DH, Comité ad hoc de l’American College of Rheumatology sur les directives de tests immunologiques. Lignes directrices pour les tests de laboratoire immunologiques dans les maladies rhumatismales: tests d’anticorps anti-ADN. Arthritis Rheum. 2002; 47: 546-555.
- Benito-Garcia E, Schur PH, Lahita R. Lignes directrices pour les tests de laboratoire immunologiques dans les maladies rhumatismales: tests d’anticorps anti-Sm et anti-RNP. Arthritis Rheum. 2004; 51: 1030-1044.
- Reichlin M. Signification clinique des anticorps anti-Ro / SSA et anti-La / SSB. À jour. Octobre 2008.
- Reveille JD, Sherrer YRS, Solomon DH, Schur P, Kavanaugh A. Lignes directrices fondées sur des données probantes pour l’utilisation de tests de laboratoire immunologiques: Anti-Ro (SS-A) et La (SS- B): Un rapport du Comité ad hoc de l’ACR sur les lignes directrices pour les tests immunologiques. Soumis pour publication.
- Reichlin M. Antiribosomal P protein anticorps. À jour. Octobre 2008.
- Denton CP. Classification de la sclérodermie. À jour. Octobre 2008.