Inflammation intravasculaire maligne
La septicémie a été qualifiée de processus d’inflammation intravasculaire maligne . Normalement, une cascade immunologique puissante et complexe assure une réponse protectrice rapide à l’invasion de micro-organismes chez l’homme. Une défense immunologique déficiente peut permettre à l’infection de s’établir; cependant, une réponse excessive ou mal régulée peut nuire à l’hôte en raison d’une libération inadaptée de composés inflammatoires générés localement (voir l’image ci-dessous).
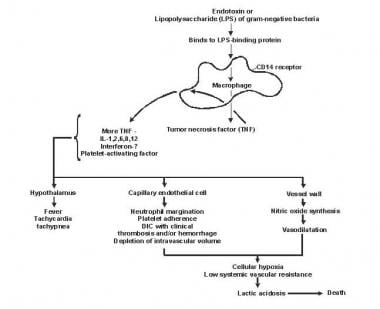 Pathogenèse de la septicémie et de l’échec multiorganique.
Pathogenèse de la septicémie et de l’échec multiorganique. Le lipide A et d’autres produits bactériens libèrent des cytokines et d’autres modulateurs immunitaires qui interviennent dans les manifestations cliniques de la septicémie. Les interleukines, le facteur de nécrose tumorale (TNF) -α, l’interféron gamma (IFN-γ) et d’autres facteurs stimulant les colonies sont produits rapidement en quelques minutes ou quelques heures après les interactions des monocytes et des macrophages avec le lipide A.
La libération de médiateurs inflammatoires devient un processus auto-stimulant, et la libération d’autres médiateurs de ce type, y compris l’interleukine (IL) -1, le facteur d’activation des plaquettes, IL-2, IL-6, IL-8, IL-10 et l’oxyde nitrique (NO), augmente encore les niveaux de cytokines. Cela conduit à une activation continue des leucocytes polymorphonucléaires (PMN), des macrophages et des lymphocytes; les médiateurs pro-inflammatoires recrutent davantage de ces cellules. Tous ces processus créent un état de dissonance immunologique destructrice.
La septicémie est décrite comme un processus autodestructif qui permet l’extension de la réponse physiopathologique normale à l’infection pour impliquer des tissus et des résultats autrement normaux dans MODS. Un dysfonctionnement ou une défaillance d’organe peut être le premier signe clinique de la septicémie, et aucun système organique n’est à l’abri des conséquences des excès inflammatoires de la septicémie. La mortalité augmente à mesure que la défaillance des organes augmente.
Bien que incontrôlée, une fois que le MODS se développe, des preuves systémiques d’une régulation à la fois pro-inflammatoire et anti-inflammatoire sont généralement présentes, suggérant que l’échec de l’homéostasie de la défense de l’hôte est la voie finale entre la septicémie et le MODS, plutôt qu’une simple lésion d’organe terminal induite par l’hypotension, comme cela peut se produire avec un choc hémorragique. La survie après une septicémie sévère avec MODS est généralement associée à une réduction généralisée de la réponse pro-inflammatoire et anti-inflammatoire.
Une nouvelle hypothèse a récemment émergé selon laquelle la survie après une septicémie sévère nécessite un régulation à la baisse généralisée de la réponse immunitaire du corps, des fonctions énergétiques et des performances des organes associées. Ainsi, MODS peut, par la réponse adaptative de l’hôte à une inflammation écrasante, permettre à l’inflammation de disparaître sans causer de dommages permanents aux organes terminaux. Comme discuté ci-dessous, tous les organes révèlent une hyporéactivité généralisée qui est clairement anormale pour la santé mais peut marquer une stratégie de survie en cas de sepsie sévère.
Dysfonctionnement des systèmes organiques
Dérangement circulatoire
Un dérangement significatif dans l’autorégulation de la circulation est typique de la septicémie. Les médiateurs vasoactifs provoquent une vasodilatation et augmentent la perméabilité microvasculaire au site d’infection. Le NO joue un rôle central dans la vasodilatation du choc septique. En outre, une altération de la sécrétion de vasopressine peut survenir, ce qui peut permettre la persistance de la vasodilatation.
Des changements dans les performances ventriculaires systoliques et diastoliques se produisent en cas de septicémie. Grâce à l’utilisation du mécanisme de Frank-Starling, le débit cardiaque est souvent augmenté pour maintenir la pression artérielle en présence de vasodilatation systémique. Les patients atteints d’une maladie cardiaque préexistante sont incapables d’augmenter leur débit cardiaque de manière appropriée.
Au niveau régional, la septicémie interfère avec la distribution normale du flux sanguin systémique vers les systèmes organiques. Par conséquent, les organes centraux peuvent ne pas recevoir l’apport d’oxygène approprié, et le résultat est ce que l’on appelle une hypoperfusion régionale.
La microcirculation est l’organe cible clé pour les blessures dans la septicémie puisque l’endothélium vasculaire est universellement affecté par les médiateurs inflammatoires circulants. Bien qu’il ne soit pas clair si des anomalies microcirculatoires sont la cause ou un spectateur innocent de la lésion de l’organe terminal, un dysfonctionnement microvasculaire clair est observé. Une diminution du nombre de capillaires perfusés est observée, bien qu’avec l’application de thérapies vasodilatatrices, un recrutement microvasculaire complet se produit. Un dysfonctionnement mitochondrial se produit également et est souvent associé à une réduction des gradients de potentiel transmembranaire mitochondrial, qui sont nécessaires pour conduire la phosphorylation oxydative. Le résultat final est une incapacité apparente des organes terminaux à extraire l’oxygène au maximum.
Le débat se poursuit quant à savoir si cet échec du métabolisme énergétique est un mécanisme cytoprotecteur adaptatif similaire à l’hibernation ou reflète une pathologie mitochondriale primaire. Ce sont des domaines de recherche active mais qui ne se traduisent actuellement pas par des lignes directrices claires pour la pratique clinique. L’augmentation de la perméabilité endothéliale capillaire conduit à un œdème tissulaire riche en protéines.
Le choc septique et le SIRS sont caractérisés par une dépression myocardique réversible, qui peut s’avérer résistante à la catécholamine et à l’administration de liquide. Le «facteur dépresseur myocardique» circulant – représentant vraisemblablement les effets synergiques du TNF-α, de l’IL-1β, d’autres cytokines et du NO – est impliqué dans la pathogenèse. Les deux caractéristiques de cette dépression myocardique de stress aigu sont une altération de la réactivité adrénergique et un dysfonctionnement diastolique conduisant à résistance relative aux catécholamines et cœurs petits plutôt que dilatés. L’ischémie myocardique macrovasculaire et l’hypoperfusion sont peu probables.
En cas de septicémie sévère et de choc septique, un dysfonctionnement microcirculatoire et une dépression mitochondriale provoquent une détresse tissulaire régionale, et la dysoxie régionale persiste par conséquent. Cette condition est appelée syndrome de détresse microcirculatoire et mitochondriale (MMDS). Le dysfonctionnement de l’autorégulation inflammatoire induit par la septicémie persiste et les besoins en oxygène ne correspondent pas à l’apport, ce qui entraîne un MODS.
Redistribution du volume de liquide intravasculaire résultant d’une réduction du tonus vasculaire artériel, d’une diminution du retour veineux de la di et la libération de substances dépresseurs du myocarde provoque une hypotension.
Dysfonction pulmonaire
Une lésion endothéliale dans le système vasculaire pulmonaire entraîne une perturbation circulation sanguine capillaire et perméabilité microvasculaire améliorée, entraînant un œdème interstitiel et alvéolaire. Le piégeage des neutrophiles dans la microcirculation pulmonaire initie et amplifie la lésion des membranes capillaires alvéolaires. Les lésions pulmonaires aiguës et le syndrome de détresse respiratoire aiguë (SDRA) sont des manifestations fréquentes de ces effets. En effet, la septicémie et la pneumonie sont les causes les plus fréquentes du SDRA.
Dysfonctionnement gastro-intestinal
Le tractus gastro-intestinal (GI) peut aider à propager la blessure de la septicémie. Une prolifération de bactéries dans le tube digestif supérieur peut être aspirée dans les poumons, produisant une pneumonie nosocomiale ou par aspiration. La fonction de barrière normale de l’intestin peut être affectée, permettant la translocation des bactéries, des endotoxines et des protéases digestives normales dans la circulation systémique et prolongeant la réponse septique.
Un choc septique peut provoquer iléus paralytique pouvant entraîner un retard dans l’institution de l’alimentation entérale. On pense que la production excessive de NO est l’agent causal de l’iléus induit par la septicémie. Le niveau optimal de l’apport nutritionnel est perturbé face à des besoins élevés en protéines et en calories. Les narcotiques et les myorelaxants peuvent aggraver davantage la motilité du tractus gastro-intestinal.
Dysfonctionnement hépatique
En raison du rôle joué par le foie dans la défense de l’hôte, les fonctions synthétiques anormales causées par un dysfonctionnement hépatique peuvent contribuer à la fois à l’initiation et à la progression de la septicémie. Le système réticuloendothélial du foie agit comme une première ligne de défense pour éliminer les bactéries et leurs produits; un dysfonctionnement hépatique entraîne un débordement de ces produits dans la circulation systémique.
L’insuffisance hépatique («foie choqué») peut se manifester par une élévation des enzymes hépatiques et de la bilirubine, des anomalies de la coagulation et absence d’excrétion de toxines telles que l’ammoniac, qui conduisent à une aggravation de l’encéphalopathie.
Dysfonction rénale
Lésion rénale aiguë (AKI) accompagne souvent la septicémie. Différentes étiologies de l’AKI ont été rapportées et la cause est généralement considérée comme multifactorielle. Le mécanisme de l’AKI est complexe mais implique probablement une diminution du volume intravasculaire efficace résultant d’une hypotension systémique, d’une vasoconstriction rénale directe, de la libération de cytokines, et l’activation des neutrophiles par les endotoxines et autres peptides, qui contribuent à des lésions rénales. Pourtant, la plupart des études animales montrent que le flux sanguin rénal est augmenté, pas diminué, dans la septicémie, bien que associé à une fonction tubulaire altérée et un manque de preuves histologiques significatives de tu lésion bulaire.
Dysfonctionnement du système nerveux central
L’implication du système nerveux central (SNC) dans la septicémie produit une encéphalopathie et périphérique neuropathie. La pathogenèse est mal définie mais est probablement liée à une hypotension systémique, qui peut conduire à une hypoperfusion cérébrale.
Coagulopathie
Coagulopathie subclinique, signalée par une légère élévation du temps de thrombine (TT) ou du temps de thromboplastine partielle activée (aPTT) ou une réduction modérée du la numération plaquettaire est extrêmement fréquente; cependant, une coagulation intravasculaire disséminée manifeste (CID) peut également se développer. Les récepteurs activés par la protéase (PAR), en particulier PAR 1, forment le lien moléculaire entre la coagulation et l’inflammation; PAR1 exerce des effets cytoprotecteurs lorsqu’il est stimulé par la protéine C activée ou la thrombine à faible dose, mais exerce des effets perturbateurs sur la fonction de barrière des cellules endothéliales lorsqu’il est activé par la thrombine à haute dose.
Mécanismes de dysfonctionnement et de blessure d’organes
Les mécanismes précis de la lésion cellulaire et du dysfonctionnement organique résultant de la septicémie ne sont pas entièrement compris. MODS est associé à une lésion généralisée des cellules endothéliales et parenchymateuses, dont certaines peuvent être expliquées par les 4 mécanismes proposés suivants:
Hypoxie hypoxique
La lésion circulatoire septique perturbe l’oxygénation tissulaire, altère la régulation métabolique de l’apport d’oxygène tissulaire et contribue au dysfonctionnement des organes. Les anomalies microvasculaires et endothéliales contribuent au défaut microcirculatoire septique dans la septicémie. Les espèces réactives de l’oxygène, les enzymes lytiques et les substances vasoactives (par exemple, le NO et les facteurs de croissance endothéliale) entraînent des lésions microcirculatoires, qui sont aggravées par l’incapacité des érythrocytes à naviguer dans la microcirculation septique.
Cytotoxicité directe
L’endotoxine, le TNF-α et le NO peuvent endommager le transport des électrons mitochondriaux, entraînant des troubles du métabolisme énergétique. C’est ce qu’on appelle l’anoxie cytopathique ou histotoxique, une incapacité à utiliser l’oxygène même lorsqu’il est présent.
Apoptose
Apoptose ( mort cellulaire programmée) est le principal mécanisme par lequel les cellules dysfonctionnelles sont normalement éliminées. Les cytokines pro-inflammatoires peuvent retarder l’apoptose dans les macrophages activés et les neutrophiles, mais d’autres tissus (par exemple, l’épithélium intestinal) peuvent subir une apoptose accélérée. Par conséquent, le dérangement de l’apoptose joue un rôle critique dans la lésion tissulaire de la septicémie.
Immunosuppression
L’interaction entre pro-inflammatoire et les médiateurs anti-inflammatoires peuvent conduire à un déséquilibre entre eux. Une réaction inflammatoire ou une immunodéficience peut prédominer, ou les deux peuvent être présents.
Réponse de l’hôte et autres facteurs influençant le résultat
Caractéristiques cliniques liées à la gravité de la septicémie comprennent la réponse de l’hôte à l’infection, le site et le type d’infection, le moment et le type de traitement antimicrobien, l’organisme incriminé, le développement du choc, la maladie sous-jacente, l’état de santé à long terme du patient et le nombre d’échecs organes. Les facteurs qui conduisent à la septicémie et au choc septique peuvent ne pas être essentiels pour déterminer le résultat final.
La réponse de l’hôte à la septicémie est caractérisée à la fois par des réponses pro-inflammatoires et des réponses immunosuppressives anti-inflammatoires. La direction, l’étendue et la durée de ces réactions sont déterminées à la fois par des facteurs de l’hôte (p. Ex., Caractéristiques génétiques, âge, maladies coexistantes, médicaments) et par des facteurs pathogènes (p. Ex., Charge microbienne, virulence).
Les réponses inflammatoires sont initiées par l’interaction entre les modèles moléculaires associés aux agents pathogènes exprimés par les agents pathogènes et les récepteurs de reconnaissance de formes exprimés par les cellules hôtes à la surface cellulaire (récepteurs de type Toll et type C récepteurs de lectine), dans l’endosome (TLR) ou dans le cytoplasme (récepteurs de type gène 1 inductibles par l’acide rétinoïque et récepteurs de type domaine d’oligomérisation de liaison aux nucléotides).
La conséquence d’une inflammation exagérée est une lésion tissulaire collatérale et la mort cellulaire nécrotique, qui se traduit par la libération de modèles moléculaires associés aux dommages, des molécules dites de danger qui perpétuent au moins l’inflammation en partie en agissant sur les mêmes récepteurs de reconnaissance de formes déclenchés par des agents pathogènes.