US Pharm. 2013; 38 (11) (Suprimento de oncologia): 3-6.
RESUMO: A anemia é uma complicação comum em pacientes com câncer. Pode ser causado pelo próprio tumor ou pelo esquema quimioterápico utilizado. A gravidade e a prevalência da doença variam com base em vários fatores. O tratamento visa aumentar a capacidade de transporte de oxigênio do sangue, reduzir a fadiga e melhorar a qualidade de vida geral do paciente. Agentes estimuladores de eritropoiese, suplementação de ferro e transfusões de células vermelhas do sangue foram recomendados em diferentes ambientes. Embora tenham se mostrado benéficos em alguns pacientes, a modalidade terapêutica ideal ainda não foi estabelecida.
A anemia é uma das principais causas de morbidade em pacientes com câncer, associada a baixo desempenho físico, prognóstico e desfecho terapêutico.1 De acordo com a Organização Mundial da Saúde ( OMS), a anemia é definida como um nível de hemoglobina (Hb) de < 12 g / dL em mulheres não grávidas e < 13 g / dL em homens ≥15 anos.2
Epidemiologia
A anemia é uma das manifestações mais frequentes em pacientes com câncer. Na verdade, foi demonstrado que 30% a 90% de todos os pacientes com câncer são anêmicos, um número que depende do tipo de câncer e da definição de anemia usada.3 A incidência e a gravidade da anemia dependem de uma série de fatores, que estão listados na TABELA 1.4,5

Etiologia
A principal causa de anemia em pacientes com câncer é dupla: o próprio câncer e a terapia usada para o tratamento do câncer. As células cancerosas que se infiltram na medula óssea podem suprimir diretamente a hematopoiese e causar anemia. Além disso, as células cancerosas liberam citocinas que podem levar ao sequestro de ferro, reduzindo a produção de glóbulos vermelhos (hemácias). Os tumores podem resultar em perda crônica de sangue do local do tumor, levando à anemia progressiva do câncer e organdamage.6
Esse problema é agravado por perdas de sangue, deficiências nutricionais, hemólise, distúrbios endócrinos, doença hereditária, insuficiência renal ou a presença de citocinas inflamatórias associadas a cânceres e doenças crônicas.4,6 Pacientes com câncer tendem a perder o apetite, levando a deficiências nutricionais. Em pacientes com tumores gastrointestinais (GI), a má absorção de nutrientes também leva a deficiências. A hemólise resulta de anticorpos imunomediados ou alterações na capacidade de coagulação. Como resultado, a anemia é uma comorbidade comum em pacientes recentemente diagnosticados com câncer. Quase metade das pacientes com diagnóstico de câncer ginecológico e um terço das pacientes com diagnóstico de linfoma não Hodgkin têm anemia no momento do diagnóstico.
Além disso, a mielossupressão é um dos efeitos colaterais da quimioterapia e um fator contribuinte significativo para a anemia. . A radioterapia para o esqueleto em particular também causa toxicidade hematológica e, portanto, anemia.6
Sintomas
Os sintomas mais comuns de anemia são fadiga, dispneia aos esforços, palpitações, depressão, insuficiência cardíaca, comprometimento cognitivo função, tontura e insuficiência cardíaca.7,8
Diagnóstico
A magnitude do problema da anemia em pacientes com câncer é amplificada por medidas diagnósticas subótimas, a falta de uma definição padrão e o fato de a causa frequentemente ser multifatorial.6,9 Uma história detalhada registrando a duração e o tempo de início dos sintomas, a presença de comorbidades, história familiar e história de exposição a antineoplásicos e radiação devem ser coletadas. Deve ser realizado um exame físico para verificar se há síncope, dispneia ao exercício, dor de cabeça, vertigem, dor no peito, fadiga, menstruação anormal em mulheres e palidez.6
A National Cancer Comprehensive Network recomenda que aCBC seja realizada para pacientes com uma Hb < 11 g / dL ou uma redução na contagem de Hb de 2 g / dL. Isso é útil para determinar se as citopenias estão presentes. Uma revisão visual do esfregaço de sangue periférico para confirmar o tamanho, forma e cor dos eritrócitos também é recomendada.6
Fisiopatologia
A anemia é o resultado de uma combinação de diminuição dos eritrócitos circulantes , redução do volume de hemácias e redução dos níveis de Hb.6 Isso pode ocorrer por meio de vários mecanismos fisiopatológicos, incluindo excesso de perda de sangue, aumento da destruição de eritrócitos e diminuição da eritropoiese.
Eritropoietina (EPO), vitamina B12, ácido fólico e o ferro é essencial para a eritropoiese. A eritropoietina controla a maturação, diferenciação e sobrevivência das células eritróides durante este processo.10 A EPO é produzida principalmente pelos rins e transportada para a medula óssea.11
O metabolismo anormal do ferro ou a retenção do ferro nos macrófagos reduzem a quantidade de ferro que está disponível para eritropoiese.O metabolismo alterado do ferro é causado principalmente pela hepcidina, uma proteína que diminui a absorção de ferro nos intestinos e também a liberação de ferro pelos macrófagos. A produção de hepcidina é aumentada pelas citocinas liberadas dos tumores, diminuindo assim a quantidade de ferro circulante. Também foi demonstrado que a produção de citocinas como a interleucina (IL) -6 é aumentada por certos regimes quimioterápicos.5 Ciclos repetidos de quimioterapia podem piorar a redução da eritropoiese cumulativamente.7
À medida que a distribuição de oxigênio diminui, as células do tecido do corpo tornam-se hipóxicas, resultando em uma série de respostas fisiológicas conforme o corpo tenta ganhar ou manter a oxigenação do tecido.
Pensa-se que a utilização normal de pacientes com câncer de ferro pode ser interrompida por uma interação entre as células tumorais e o próprio sistema imunológico do hospedeiro. Essa interação leva à supressão de citocinas inflamatórias específicas, como IL-1, gamainterferon e fator de necrose tumoral alfa (TNF-α), que diminuiu a diferenciação de precursores eritroides na medula óssea, interfere com a utilização normal de ferro e inibe a hipóxia normal. produção de eritropoietina dirigida. Agentes quimioterápicos nefrotóxicos podem piorar o problema, causando insuficiência renal.
Na anemia crônica, os tumores têm mostrado liberar fator indutor de ananemia, uma molécula que reduz a expectativa de vida dos oferecitrócitos. Isso agrava a anemia a ponto de a eritropoiese não compensar a sobrevivência inferior dos eritrócitos.12
Fatores de risco para anemia no câncer
Os seguintes fatores de risco foram identificados para anemia no câncer9:
- Quimioterapia mielossupressora ou radioterapia
- Níveis baixos de Hb (10-12 g / dL) no início da quimioterapia citotóxica
- Administração de platina- contendo regimes, o que também aumenta a necessidade de suporte transfusional.
Tratamento
Além de uma melhora geral na qualidade de vida do paciente, o tratamento da anemia é essencial para vários A anemia compromete o fornecimento de quantidades suficientes de oxigênio para todas as células, incluindo células tumorais.7 Como a baixa oxigenação dos tecidos está associada a uma sensibilidade reduzida dos tumores à radiação e outras formas de quimioterapia, a eficácia desses tratamentos é reduzida na anemia.13,14
O objetivo da terapia deve ser aumentar a carga de oxigênio g capacidade do sangue e tratar a causa subjacente. Condições subjacentes, como deficiências nutricionais, são mais fáceis de tratar do que outras, como perda de sangue oculto. Várias opções estão disponíveis para o tratamento de pacientes com câncer com anemia. Estes incluem 15:
- Terapia suplementar apropriada com ácido fólico e / ou vitamina B12 para corrigir deficiências nutricionais
- Agentes estimuladores de eritropoiese (ESAs)
- Suplementação de ferro
- Transfusões de sangue, que são indicadas para pacientes com perda de sangue aguda grave. Para pacientes cuja anemia é crônica, os agentes eritropoiéticos são preferidos.
Agentes estimuladores da eritropoiese: ESAs, incluindo eritropoietina alfa humana recombinante (rHuEPO; Procrit, Epogen) e darbepoetina alfa (Aranesp), foram tradicionalmente desenvolvido para o manejo da anemia em pacientes com insuficiência renal crônica. Eles demonstraram eficácia e limitações semelhantes quando usados em doses incomparáveis em pacientes com câncer com anemia.5 Os AEEs são indicados para o manejo de pacientes cujos níveis endógenos de EPO são anormalmente baixos, visto que o modo de ação do AEE e os efeitos imunológicos e hematológicos são semelhantes aos da EPO endógena.9 Estudos conduzidos em rHuEPO mostraram que melhora os níveis de Hbl e a qualidade de vida dos pacientes e diminui as necessidades de transfusão.15,16 Foi proposto que os AEEs também melhoram a função cognitiva de pacientes que recebem quimioterapia.17
Uma revisão sistêmica conduzido pela American Cancer Society mostrou que o benefício clínico ideal do tratamento eritropoiético da anemia induzida por quimioterapia pode ser alcançado por meio de intervenção precoce.18 Há claramente um benefício no uso de AEEs; no entanto, todas as outras causas de anemia devem ser investigadas e corrigidas antes do uso da terapia ESA.
A darbepoetina e a rHuEPO são indicadas para o tratamento da anemia em pacientes com neoplasias não mieloides em que a manemia está relacionada à quimioterapia.5 A Sociedade Americana de Hematologia (ASH) e a Sociedade Americana de Oncologia Clínica (ASCO) recomendam que o tratamento seja iniciado quando os níveis de Hb caírem abaixo de 10 g / dL e a dosagem seja reduzida se houver um aumento mínimo de 1 g / dL nos níveis de H em 2 semanas.19 O objetivo da terapia deve ser elevar a Hb à concentração mais baixa para evitar a transfusão. Se o aumento mínimo de 1 a 2 g / dL de Hb não for alcançado após 6 a 8 semanas de tratamento, a terapia com AEE deve ser interrompida.18 Embora seja difícil prever a resposta do paciente a essas terapias com os dados atuais, foi demonstrado que aproximadamente 50% a 60% dos pacientes demonstram um aumento de 2 g / dL na Hb quando tratados com rHuEPO.9 A terapia com ESA deve ser descontinuada após a conclusão de o curso de quimioterapia.20,21
A dosagem recomendada para darbepoetina alfa é de 2,25 mcg / kg como uma injeção subcutânea (SC) semanal. Se os níveis de Hb não subirem pelo menos 1 g / dL após 6 semanas, a dosagem deve ser aumentada para 4,5 mcg / kg. Se os níveis de Hb aumentarem mais de 1 g / dL em um período de 2 semanas ou se a Hb exceder 12 g / dL, a dosagem de darbepoetina deve ser reduzida em 40% .20 A darbepoetina deve ser interrompida se os níveis de Hb subirem acima de 13 g / dL. 9
A dosagem recomendada de rHuEPO é 40.000 U SC administrada uma vez por semana ou 150 U / kg administrada SC três vezes por semana em pacientes internados com níveis de Hb abaixo de 10 g / dL. A dosagem de rHuEPO deve ser reduzida em 25% se o nível de Hb aumentar > 1 g / dL em qualquer período de 2 semanas ou atingir um nível necessário para evitar a transfusão de hemácias.21
Os ESAs são embalados em um frasco que não deve ser agitado, pois eles se desnaturam.20,21 O conteúdo do frasco não deve ser diluído ou agrupado.
Os riscos da terapia com ESA também devem ser tomadas em consideração. Acredita-se que os AEEs aumentem os eventos cardiovasculares adversos, aumentem o risco de tromboembolismo venoso, encurtem o tempo de progressão do tumor e reduzam a sobrevida em pacientes com câncer anêmico por meio de diferentes mecanismos.22,23 Por esse motivo, o uso de AEEs é desencorajado em pacientes com câncer que não estão passando por tratamento com quimioterapia ou radioterapia.24 Todos os AEEs vêm com uma caixa preta alertando sobre o aumento do risco de morte, infarto do miocárdio, acidente vascular cerebral, tromboembolismo venoso, trombose de acesso vascular e progressão e recorrência tumoral.20,21 O Programa de Oncologia ESA APPRISE foi estabelecido por o FDA para aconselhar pacientes, cuidadores e profissionais de saúde sobre o uso seguro de AEEs.25
Suplementação de ferro: A suplementação de ferro, de preferência parenteral, é indicada em pacientes com baixos níveis de offerritina (< 30 ng / mL), saturação de transferrina (TSAT < 15%) e baixa (< 26 pg / célula ) reticulócito Hb conten t (CHr). Dois tipos de deficiência de ferro foram reconhecidos em pacientes com câncer anêmico:
- Deficiência absoluta de ferro (AID) que ocorre com sangramento crônico devido a, por exemplo, lesões gastrointestinais ou ginecológicas, perda de sangue em cirurgia, nutricional deficiências e anemia de doenças crônicas (ACD). É definido como um nível de ferritina sérica de < 30 mcg / L e TSAT diminuído de < 15% .1
- Deficiência funcional de ferro (FID) que surge após o uso continuado de eritropoietina. É a causa mais comum de resposta inadequada à terapia com AEE, particularmente em pacientes com insuficiência renal. Portanto, a maioria dos pacientes em terapia com AEE eventualmente exigirá suplementação de ferro.6
A suplementação de ferro foi introduzida quando a terapia com AEE por si só demonstrou baixas taxas de resposta em pacientes tratados com quimioterapia.1 A eficácia de uma combinação de IV a terapia com ferro e AEE foi testada e o papel do ferro na deficiência funcional de ferro foi estabelecido.1 Embora as evidências atuais apóiem o uso de suplementação de ferro IV para melhorar as respostas de hemoglobina em pacientes anêmicos com câncer, estudos prospectivos sobre a eficácia e segurança a longo prazo do ferro IV são necessários .Além disso, os regimes de dosagem ideais precisam ser estabelecidos.5
O ferro pode ser administrado por via oral ou como formulações parenterais de ferro dextrano de baixo peso molecular (LMW), gluconato férrico e sacarose de ferro. O ferro administrado por via parenteral tem resposta superior quando comparado ao ferro oral.6 Portanto, este último é raramente usado em pacientes com câncer com anemia e não é discutido neste artigo. Doses de teste são recomendadas para o dextrano de ferro. Pacientes que exibiram sensibilidades anteriores ao dextrano de ferro ou outras preparações de ferro IV ou aqueles que têm alergia a múltiplos medicamentos também devem receber uma dose de teste. A TABELA 2 mostra o regime de dosagem para suplementação de ferro IV.6
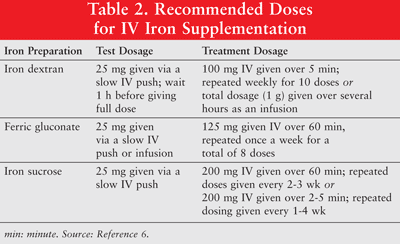
O ferro parenteral está associado a hipotensão, náusea, vômito e / ou diarreia, dor, hipertensão, dispneia, prurido, cefaleia e tontura. Além disso, pode ser inconveniente para administrar e caro.9 Como o ferro dextrano de alto peso molecular (HMW) está associado a uma maior incidência de eventos adversos do que o ferro dextrano LMW, o último é geralmente preferido.6
Vermelho Transfusão de células sanguíneas: os eritrócitos são os hemoderivados preferidos para transfusões para correção de anemia em casos de anemia aguda após hemorragia. Certos pacientes podem necessitar de uma infusão com citomegalovírus negativa.O objetivo de usar uma transfusão de hemácias é tratar ou prevenir uma deficiência na capacidade de transporte de oxigênio do sangue, e a transfusão geralmente não é indicada se o nível de H do paciente for ≥10 g / dL.6
Oferta de transfusões de hemácias a vantagem de um rápido aumento dos níveis de Hb e hematócrito imediatamente após a infusão. Estima-se que uma transfusão de 300 mL (1 unidade) de eritrócitos puros resultará em um aumento médio de 1 g / dL de Hb ou 3% do hematócrito em um adulto normal que não sofra perda de sangue simultânea. Isso leva a uma rápida melhora geral na fadiga.6
O sangue do paciente deve ser comparado para compatibilidade ABO antes que os eritrócitos possam ser transfundidos. Se o paciente necessitar de infusões repetidas, o risco de reações adversas pode ser minimizado pelo uso de sangue redutor de leucócitos e pré-medicação com anantihistamina ou paracetamol.6
A transfusão de hemácias não é isenta de riscos, incluindo o potencial para infecções transmitidas por transfusão agentes, reações transfusionais, aloimunização e imunossupressão.9 Outros riscos de transfusão incluem insuficiência cardíaca congestiva, aumento de eventos trombóticos e sobrecarga de ferro.6 É útil notar, entretanto, que os pacientes que requerem infusões de hemácias durante o período correspondente ao tratamento quimioterápico são altamente improváveis de experimente sobrecarga de ferro.6
Perspectivas futuras
Novas estratégias para controlar a anemia em pacientes com câncer estão sendo perseguidas. Embora não haja substituto para o sangue humano, os pesquisadores estão no processo de desenvolvimento de produtos com a capacidade de transportar oxigênio dos eritrócitos. No pipeline estão carreadores de oxigênio baseados em Hb e perfluorocarbonos.5
Conclusão
Em suma, a abordagem ideal para a anemia como uma questão importante em oncologia ainda não foi estabelecida. A falta de consistência entre os prestadores de cuidados de saúde, uma definição clara de anemia no câncer e os critérios de diagnóstico contribuem para este problema.
1. Steinmetz HT. O papel do ferro intravenoso no tratamento da anemia em pacientes com câncer. Ther Adv Hematol. 2012; 3: 177-191.
2. deBenoist B, McLean E, Egli I, et al. Prevalência Mundial de Anemia 1993–2005: Banco de Dados Global da OMS sobre Anemia. Genebra, Suíça: Organização Mundial da Saúde; 2008.
3. Knight K, Wade S, Balducci L. Prevalência e resultados da anemia no câncer: uma revisão sistemática da literatura. Am J Med. 2004; 116 (suppl 7A): 11S-26S.
4. Schwartz RN. Anemia em pacientes com câncer: incidência, causas, impacto, manejo e uso de diretrizes e protocolos de tratamento. Am J Health Syst Pharm. 2007; 64 (3 supl. 2): S5-S13; questionário S28-S30.
5. Calabrich A, Katz A. Gestão da anemia em pacientes com câncer. Future Oncol. 2011; 7: 507-517.
6. Rodgers GM, Becker P, Blinder M, et al. Anemia induzida por câncer e quimioterapia. J Natl Compr Canc Netw. 2012; 10: 628-653.
7. Groopman JE, Itri LM. Anemia induzida por quimioterapia em adultos: incidência e tratamento. J Natl Cancer Inst. 1999; 91: 1616-1634.
8. Ludwig H, Strasser K. Symptomatology of anemia. Semin Oncol. 2001; 28: 7-14.
9. Gillespie TW. Anemia no câncer. Enfermagem oncológica. 2003; 26: 119-128.
10. Koeller JM. Diretrizes clínicas para o tratamento da anemia relacionada ao câncer. Farmacoterapia. 1998; 18: 156-169.
11. Cazzola M, Mercuriali F, Brugnara C. Uso de eritropoietina humana recombinante fora do ambiente de uremia. Sangue. 1997; 89: 424-867.
12. Nowrousian MR, Kasper C, Oberhoff C, et al. Patofisiologia da anemia relacionada ao câncer. In: Smith JF, Boogaerts MA, Ehmer B, eds. Erythropoietin in Cancer Supportive Treatment. New York, NY: Marcel Dekker; 1997: 13-34.
13. Vaupel P, Dunst J, Engert A, et al. Efeitos da eritropoetina humana recombinante (rHuEPO) no controle do tumor em pacientes com anemia induzida por câncer. Onkologie. 2005; 28: 216-221.
14. Zhao KL, Liu G, Jiang GL, et al. Associação do nível de hemoglobina com morbidade e mortalidade de pacientes com carcinoma esofágico localmente avançado submetidos à radioterapia – uma análise secundária de três ensaios clínicos consecutivos de fase III. Clin Oncol (R Coll Radiol). 2006; 18: 621-627.
15. Glaspy JA. O desenvolvimento de agentes eritropoiéticos em oncologia. Expert Opin Emerg Drugs. 2005; 10: 553-567.
16. Adamson JW, Spivak JL. Bases fisiológicas para o uso farmacológico da eritropoietina humana recombinante em cirurgia e tratamento do câncer. Cirurgia. 1994; 115: 7-15.
17. Ferrario E, Ferrari L, Bidoli P, et al. Tratamento da anemia relacionada ao câncer com epoetina alfa: uma revisão. Cancer Treat Rev. 2004; 30: 563-575.
18. Lyman GH, Glaspy J. Existem benefícios clínicos na intervenção eritropoiética precoce para anemia induzida por quimioterapia? Revisão assistemática. Câncer. 2006; 106: 223-233.
19. Rizzo JD, Brouwers M, Hurley P, et al. AmericanSociety of Clinical Oncology / American Society of Hematology atualização das diretrizes de prática clínica sobre o uso de epoetina e darbepoetina em pacientes adultos com câncer. J Clin Oncol. 2010; 28: 4996-5010.
20. Informação de prescrição de Aranesp (darbepoetina alfa).Thousand Oaks, CA: Amgen Inc; Maio de 2012.
21. Informação de prescrição de Procrit (epoetina alfa). Horsham, PA: Janssen Products, LP; Julho de 2012.
22. Beutel G, Ganser A. Riscos e benefícios dos agentes estimuladores da eritropoiese na gestão do câncer. Semin Hematol. 2007; 44: 157-165.
23. Fenner MH, Ganser A. Erythropoietin in cancer-related anemia. Curr Opin Oncol. 2008; 20: 685-689.
24. Smith RE Jr, Aapro MS, Ludwig H, et al. Darbepoetinalfa para o tratamento da anemia em pacientes com câncer ativo que não estão recebendo quimioterapia ou radioterapia: resultados de um estudo de fase III, multicêntrico, randomizado, duplo-cego e controlado por placebo. J Clin Oncol. 2008; 26: 1040-1050.
25. Programa de Oncologia ESA APPRISE. Produtos da Amgen e Janssen, LP. www.esa-apprise.com. Acessado em 13 de outubro de 2013.