Caso clínico
Apresentou-se uma mulher de 45 anos com história de doença de Crohn de 20 anos com febre, calafrios e fadiga por 10 dias. Pouco antes do início dos sintomas, a paciente foi submetida a uma colonoscopia não complicada, durante a qual fez 17 biópsias para vigilância ou polipectomia. Durante a colonoscopia, sua doença de Crohn estava em remissão e não havia inflamação da mucosa observada.
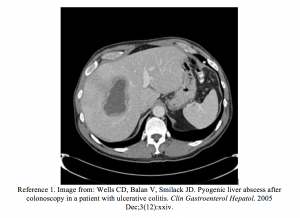
No pronto-socorro, os sinais vitais da paciente eram HR 110, BP 120/80, RR 18, T 102,5. Ela tinha dor abdominal superior direita leve. Os estudos laboratoriais revelaram uma contagem elevada de leucócitos (15.000) e AST e ALT elevadas (120/137 U / L), com fosfatase alcalina ligeiramente elevada de 200 UI / L. A tomografia computadorizada (TC) do abdome revelou várias áreas de baixa atenuação no lobo hepático direito, consistentes com abscessos hepáticos. A drenagem dos abscessos foi cultivada e cresceu Streptococcus anginosus. A resolução de todas as lesões ocorreu após serem drenadas por radiologia intervencionista e o paciente recebeu um curso de 6 semanas de antibióticos intravenosos.
Introdução
A colonoscopia é um procedimento comumente realizado no diagnóstico e tratamento de uma ampla variedade de condições, incluindo câncer, doenças inflamatórias do intestino, pólipos, sangramento e estenoses. De acordo com a American Cancer Society, a colonoscopia de rastreamento é recomendada a cada 10 anos a partir dos 50 anos.1 Em pacientes de alto risco, como aqueles com doença inflamatória intestinal, a colonoscopia é realizada com mais frequência. O procedimento ainda é a maneira mais eficaz de localizar e remover pequenos pólipos pré-cancerosos e, assim, diminuir o risco de morte por câncer de cólon e reto.
Em geral, a colonoscopia é muito segura. Uma revisão sistemática de 12 estudos em 2008, totalizando 57.742 colonoscopias realizadas para rastreamento de risco médio, mostrou uma taxa geral de eventos adversos graves de apenas 2,8 por 1000 procedimentos e mortalidade de 0,007% .2 No entanto, o risco de colonoscopia não é constante entre os grupos e algumas complicações são mais comuns do que outros. Os adultos mais velhos têm maior risco de complicações graves em comparação com os pacientes mais jovens. Em um estudo de 53.220 colonoscopias, pacientes com idade entre 80 e 84 anos tiveram uma taxa significativamente maior de complicações graves em comparação com pacientes com idade entre 66 e 69 anos. O risco de complicações graves também aumentou entre pacientes com comorbidades, como história de acidente vascular cerebral, DPOC, fibrilação atrial e insuficiência cardíaca.
O abscesso hepático piogênico (PLA) é uma complicação rara, mas séria da colonoscopia . A maioria das complicações da colonoscopia se manifestará dentro de 7 dias, mas o PLA pode se apresentar dias ou até semanas depois disso, e a história da colonoscopia recente pode nem mesmo ser eliciada, a menos que o clínico esteja ciente dessa entidade.4-6 Por causa da natureza tardia de PLA, esses pacientes provavelmente serão diagnosticados no departamento de emergência.
Outras complicações tardias, como a síndrome de eletrocoagulação pós-polipectomia e os problemas mais comuns de hemorragia retardada, dor abdominal inespecífica, reações a agentes sedativos , e perfuração também pode ser vista no DE. Por outro lado, explosão de gás ou sangramento imediato raramente serão vistos no pronto-socorro, já que esses problemas geralmente se apresentam rapidamente na sala de endoscopia, onde são tratados emergencialmente. Os médicos do pronto-socorro devem estar cientes de todas as complicações possíveis e seu curso de tempo e ter as ferramentas para diagnosticar e tratar corretamente o infeliz paciente pós-colonoscopia que sofre uma complicação séria.
Complicações
Piogênicas Abscesso hepático
PLA é uma doença perigosa com alta morbidade e mortalidade que ocorre a uma taxa de 10 a 20 casos por 100.000 internações hospitalares.4-6 Com os avanços nas técnicas de diagnóstico e intervenções, a mortalidade está melhorando.7 No entanto, os pacientes ainda correm grande perigo, especialmente se o diagnóstico for tardio, como costuma acontecer, porque os pacientes podem se apresentar de forma inespecífica. Um estudo retrospectivo de 63 pacientes com PLA mostrou que a febre era comum (59%), mas outros sinais e sintomas, como dor no quadrante superior direito e sinais peritoneais estavam presentes em apenas 39% e 14%, respectivamente.8 O diagnóstico neste estudo foi frequentemente atrasa em média uma semana do início dos sintomas.
A colonoscopia é um agente precipitante de PLA raro, mas provavelmente sub-reconhecido. Acredita-se que microperfurações silenciosas durante o procedimento causem infecção que pode espalhar o fígado pela circulação portal. Da mesma forma, outras infecções intra-abdominais, como diverticulite, podem causar PLA se a área infectada for drenada pela veia porta.9 A eliminação hepática de bactérias através da rede portal é um fenômeno normal em pacientes saudáveis, mas obstrução biliar, má perfusão e alta carga bacteriana (como no caso de infecção ou biópsias múltiplas durante a colonoscopia semeando a corrente sanguínea) podem predispor à proliferação e abscesso formação. A literatura descreve aproximadamente 34% dos casos de PLA como criptogênicos, mas uma parte deles pode muito bem ser pacientes com colonoscopia recente que não foi reconhecida como um fator de risco para o processo da doença.8
A maioria dos isolados de PLA são polimicrobianos e composta por flora entérica normal. As hemoculturas são positivas em 33-65% dos casos, mas as culturas de abscesso são quase todas positivas.10 Os microrganismos mais comumente isolados são espécies de Streptococcus (37%), Eserichia Coli (33%), espécies Bacteroides (24%), Klebsiella pneumoniae (18%) e estreptococos microaerofílicos (12%). 10-11 Strep anginosus, encontrado no caso deste paciente, é um coco Gram-positivo anaeróbio facultativo e um dos organismos mais comuns encontrados no PLA.
O diagnóstico imediato de PLA é crítico, porque mesmo com a melhora do diagnóstico e da terapia, a mortalidade permanece em 10% .5,7 As complicações infecciosas da colonoscopia em geral são raras, mas, novamente, a relação causal também é provavelmente sub-reconhecida. A colonoscopia foi implicada em pelo menos alguns casos de PLA.12-14 Mas a bacteremia sistêmica transitória, observada em 4% das colonoscopias, não parece aumentar o risco de infecção per se.15 Em vez disso, acredita-se que a infecção em PLA se espalhe via microperfurações reais.
Embora seja conhecido que as perfurações francas são relativamente raras (menos de 0,1% das colonoscopias), a incidência e a fisiopatologia das microperfurações não são inteiramente conhecidas.16-17 Com o conhecimento desta clínica entidade, um clínico que obtém uma boa história e tem um alto índice de suspeita pode diagnosticar PLA mais rapidamente em um paciente com colonoscopia recente.
Infecção
É comumente aceito que bacteremia transitória após a colonoscopia, ocorre em aproximadamente 4% dos procedimentos, embora a variação seja relatada como 0-25%, e os fatores de risco para bacteremia não sejam definidos.18 Taxas mais altas de bacteremia ocorrem durante atividades diárias de rotina, como escovar os dentes e mastigar alimentos. Embora os sinais ou sintomas de infecção sistêmica em pacientes com bacteremia transitória sejam raros, os pacientes podem sentir febre, calafrios e queixas que imitam tudo, desde infecções respiratórias superiores a abdominais.18
Embora bacteremia transitória seja um risco aceito de colonoscopia , não há benefício comprovado para a profilaxia antibiótica de rotina e a maioria dos pacientes não terá tomado antibióticos peri-procedimento.18 As diretrizes atuais da Sociedade Americana de Gastroenterologia (ASGE) concordam com a American Heart Association (AHA) e recomendam contra a profilaxia antibiótica para pacientes submetidos à colonoscopia de rotina.19
Pode ser difícil diferenciar os sintomas de bacteremia transitória da infecção verdadeira.18 Em geral, os pacientes com sintomas infecciosos nos dias após a colonoscopia justificam estudos laboratoriais, incluindo hemoculturas, e dependendo de o índice de suspeita de perfuração, imagem abdominal.20-21 Se a suspeita de perfuração for baixa ou o diagnóstico Se for descartada, hidratação IV e antibióticos podem ser administrados se garantidos pelo estado clínico do paciente.
Sangramento
O sangramento pós-polipectomia pode ser imediato ou retardado. O sangramento imediato está associado às técnicas de polipectomia que não usam cautério ou quando a corrente combinada é usada para o procedimento. O sangramento retardado é mais comumente visto no pronto-socorro, pois o sangramento imediato é freqüentemente detectado no momento do procedimento e tratado pelo endoscopista. O sangramento tardio pode ser observado em até 7 dias após o procedimento. Acredita-se que ocorra devido ao descamação de uma escara que estava cobrindo um vaso sanguíneo ou devido à extensão da zona de necrose térmica para tecido não lesado, o que poderia resultar em sangramento se envolver um vaso sanguíneo.19,22
Vários grandes estudos relataram hemorragia em 1 a 6 por 1000 colonoscopias (0,1% -0,6%) .22 No entanto, um estudo analisando mais de 50.000 colonoscopias descobriu que a taxa de hemorragia gastrointestinal era significativamente diferente dependendo se a polipectomia foi realizada. O sangramento pós-polipectomia ocorre em 1-2%, com taxas mais altas observadas com a remoção de pólipos maiores. O risco de sangramento pós-polipectomia pode ser aumentado em pacientes com trombocitopenia ou coagulopatias.23
Fatores de risco conhecidos para sangramento pós-colonoscopia incluem tamanho do pólipo, número de pólipos removidos, história de uso recente de anticoagulante ou pólipo histologia.22 Curiosamente, vários estudos grandes não encontraram o uso de aspirina associado ao sangramento pós-polipectomia.24-26
Pacientes com hemorragia tardia podem apresentar qualquer sinal de sangramento ou anemia, incluindo fadiga, fraqueza , palidez, sangramento grosseiro ou coágulos na limpeza, taquicardia, dor no peito e falta de ar.Os pacientes podem descrever hematoquezia ou melena, dependendo da localização do sangramento.
O manejo inicial de um paciente com suspeita de hemorragia inclui o tratamento das vias aéreas básicas, respiração e circulação com 2 IVs de grande calibre, fluidos cristalóides e monitoramento cardíaco. Pacientes com hemorragia digestiva baixa grosseira podem descompensar rapidamente e devem ter um tipo ativo e triagem caso a transfusão seja necessária.
Os exames de imagem nem sempre são necessários e, se possível, a decisão por exames de imagem deve ser feita junto com o GI consulte, de preferência, o médico que realizou a colonoscopia. A repetição da colonoscopia costuma ser o procedimento diagnóstico e terapêutico de escolha. O American College of Radiology dá a mais alta classificação de adequação para colonoscopia, embora também inclua CTA do abdômen / pelve e tomografia de hemácias Tc-99m abdômen / pelve como possíveis etapas apropriadas no diagnóstico.27
Se o paciente é instável e o endoscopista não está disponível, o médico do pronto-socorro deve consultar radiologia intervencionista geral (IR), GI e cirurgia.
Perfuração
A perfuração colonoscópica (CP) é uma das complicações mais graves e temidas da colonoscopia. Embora rara, a PC resulta em alta morbidade e mortalidade.28-32 A perfuração pode resultar de forças mecânicas contra a parede do intestino, barotrauma ou eletrocautério e pode levar à formação de abscesso, formação de fístula, sepse intra-abdominal, internação hospitalar prolongada e até mesmo morte.
A PC ocorre em aproximadamente 0,016% das colonoscopias diagnósticas, mas pode ser observada em até 5% das colonoscopias terapêuticas.33-35 Dependendo do que realmente foi feito durante a colonoscopia, o risco de perfuração pode ser maior ou abaixo da média, portanto, obter o relatório cirúrgico ou a história do endoscopista pode ser útil para determinar o risco.
Risco de PC para vários procedimentos colonoscópicos: 1,36-37
– Colonoscopia de triagem: 0,01-0,1%
– Dilatação da estenose anastomótica: 0-6%
– Dilatação da estenose da doença de Crohn: 0-18%
-Stent colocação: 4%
-Colocação do tubo de descompressão colônica: 2%
-Ressecção endoscópica colônica da mucosa 0-5%
Além dos eventos durante o procedimento, os fatores de risco específicos para PC incluem idade avançada, múltiplas comorbidades, diverticulose, obstrução, ressecção de pólipos, pólipos maiores que 1 cm de tamanho ou encontrados no cólon direito, mobilidade reduzida do cólon, fraqueza existente na parede do cólon , tentativa anterior incompleta de colonoscopia ou inexperiência do endoscopista.20
Os pacientes com PC podem apresentar dor abdominal súbita e piora, seguida por dissipação completa falsamente reconfortante da dor conforme a perfuração descomprime o órgão inflamado. À medida que o conteúdo gastrointestinal continua a vazar para o peritônio, ocorre o agravamento da dor e dos sintomas peritoneais. No entanto, os sintomas variam de acordo com a localização e o tamanho da perfuração, o grau de infiltração fecal no peritônio e a idade e comorbidades do paciente.
Notavelmente, as perfurações também podem ser retro-peritoneais, correspondendo ao localização do cólon ascendente e descendente e das flexuras hepática e esplênica. Embora o sintoma mais comum de perfuração do cólon seja a dor abdominal, os pacientes idosos podem ter uma resposta embotada. Outros sintomas incluem febre, náusea, vômito, dispneia, dor no peito, dor escapular e dor no pescoço. As perfurações retroperitoneais, em particular, podem ter sintomas mínimos ou atípicos, e os sinais vitais podem mostrar taquicardia e febre, mas também podem ser normais.20
O manejo inicial de uma suspeita de perfuração inclui atenção às vias aéreas, respiração, circulação com 2 IVs de grande calibre, fluidos cristalóides e monitor cardíaco. Devem ser obtidos laboratórios incluindo CBC, CMP, lipase e tipo e obtenção de tela. O paciente deve ser estritamente NPO com antibióticos IV empíricos. Imagens estatísticas com TC de abdômen / pelve ou raio-X abdominal, se instável, devem ser solicitadas juntamente com uma consulta cirúrgica de estatística.21
Síndrome pós-polipectomia
Síndrome pós-polipectomia, também conhecida como síndrome de eletrocoagulação pós-polipectomia ou síndrome de queimadura transmural, resulta de lesão por eletrocoagulação na parede intestinal, criando uma queimadura transmural e peritonite focal sem perfuração franca.38 A incidência relatada varia de 3 por 100.000 (0,003%) a 1 em 1000 (0,1% ) A síndrome pós-polipectomia foi relatada em 6 pacientes de 16.318 colonoscopias realizadas entre 1994 e 2002 em um grande sistema de saúde integrado.39 Fatores de risco para esta complicação incomum são desconhecidos.
Pacientes com síndrome pós-polipectomia geralmente presentes dentro de 12 horas de colonoscopia com febre, taquicardia e dor abdominal. No entanto, o início dos sintomas pode ser retardado em até 5–7 dias após o procedimento.40 Os pacientes costumam ter leucocitose e podem apresentar rigidez e taquicardia, todas simulando perfuração colônica.41
No entanto, ao contrário da perfuração, que pode exigir cirurgia de emergência, os pacientes com síndrome pós-polipectomia são geralmente tratados de forma conservadora com fluidos intravenosos, controle da dor e avanço gradual da dieta, com ou sem antibióticos direcionados para gram patógenos negativos e anaeróbicos.42 Casos menos graves podem até mesmo ser tratados em um ambiente ambulatorial com antibióticos orais e líquidos claros por 1-2 dias.42-43
Como esses pacientes podem ser indistinguíveis de pacientes com perfuração, qualquer paciente com suspeita de síndrome pós-polipectomia precisa de exames laboratoriais e de imagem. Na síndrome pós-polipectomia, a tomografia computadorizada geralmente exibe espessamento focal da parede do cólon com fita adiposa circundante, sem qualquer ar extramural, embora em casos leves a TC possa ser negativa.42 Independentemente do resultado de imagem, como com perfuração, se houver síndrome pós-polipectomia é suspeito, o paciente deve ter uma consulta cirúrgica.
Pérolas
- A colonoscopia é um teste de triagem amplamente usado em pacientes com mais de 50 anos. As complicações podem ser precoces ou tardias. Os médicos EM devem estar cientes das possíveis complicações e seu cronograma esperado, a fim de diagnosticar e gerenciar com precisão qualquer possível complicação apresentada.
- As complicações incluem hemorragia, perfuração, síndrome pós-polipectomia, infecção, explosão de gás e abscesso hepático piogênico.
- A história sobre os fatores do paciente e o próprio procedimento (condições subjacentes, medicamentos, se os pólipos foram removidos, se foi usado cautério, se houve sangramento imediato) pode orientar o diagnóstico e o tratamento no PS.
- O abscesso hepático piogênico pode se apresentar 1-2 semanas após a colonoscopia com dor no quadrante superior direito e febre.
- Grande parte do cólon é retroperitoneal. As perfurações retroperitoneais podem causar sintomas vagos e atípicos, portanto o índice de suspeita deve ser alto.
- A síndrome pós-polipectomia pode mimetizar a perfuração e geralmente pode ser diferenciada por imagens.
Referências / leituras adicionais:
- Wells CD, Balan V, Smilack JD. Abscesso hepático piogênico após colonoscopia em paciente com colite ulcerativa. Clin Gastroenterol Hepatol. Dezembro de 2005; 3 (12): xxiv.
- Whitlock, E.P., Lin, J.S., Liles, E. et al. Triagem para câncer colorretal: uma revisão sistemática direcionada e atualizada para a Força-Tarefa de Serviços Preventivos dos EUA. Ann Intern Med. 2008; 149: 638–658.
- Warren JL, Klabunde CN, Mariotto AB, Meekins A, Topor M, Brown ML, Ransohoff. Eventos adversos após colonoscopia ambulatorial na população do Medicare. Ann Intern Med. 2009; 150 (12): 849.
- Johannsen EC, Sifri CD, Madoff LC. Abcessos hepáticos piogênicos. Infect Dis Clin North Am. 2000; 14: 547–63.
- Meddings L, Myers RP, Hubbard J, et al. Um estudo de base populacional de abscessos hepáticos piogênicos nos Estados Unidos: incidência, mortalidade e tendências temporais. Am J Gastroenterol. 2010; 105: 117–24.
- Kaplan GG, Gregson DB, Laupland KB. Estudo de base populacional da epidemiologia e dos fatores de risco para abscesso hepático piogênico. Clin Gastroenterol Hepatol. 2004; 2: 1032-8.
- Petri A, Höhn J, Hódi Z, Wolfárd A, Balogh A. Abscesso hepático piogênico – 20 anos de experiência. Comparação de resultados de tratamento em dois períodos. Langenbecks Arch Surg. 2002; 387: 27–31.
- Pang TC, Fung T, Samra J, Hugh TJ, Smith RC. Abscesso hepático piogênico: Uma auditoria de 10 anos de experiência. World J Gastroenterol. 2011; 17: 1622–30.
- Murarka S, Pranav F, Dandavate V. Disseminated Streptococcus anginosus da diverticulite sigmóide. J Glob Infect Dis. 2011; 3: 79–81.
- Branum GD, Tyson GS, Branum MA, Meyers WC. Abscesso hepático. Mudanças na etiologia, diagnóstico e tratamento. Ann Surg. 1990 dez. 212 (6): 655-62.
- Gyorffy EJ, Frey CF, Silva J Jr, McGahan J. Pyogenic liver abscess. Estratégias diagnósticas e terapêuticas. Ann Surg. 1987 dez. 206 (6): 699-705.
- Bonenfant F, Rousseau É, Farand P. Streptococcus anginosuspyogenic liver abscess following a screening colonoscopy. The Canadian Journal of Infectious Diseases & Microbiologia Médica. 2013; 24 (2): e45-e46.
- Ian G. Harnik. Abscesso hepático piogênico que se apresenta após polipectomia maligna. Dig Dis Sci. 2007; 52: 3524–5.
- Paraskeva KD, Bury RW, Isaacs P. Streptococcus milleri abcessos hepáticos: uma complicação incomum após a remoção colonoscópica de uma espinha de peixe impactada. Gastrointest Endosc. 2000; 51: 357–8.
- Low DE, Shoenut JP, Kennedy JK, et al. Avaliação prospectiva do risco de bacteremia com colonoscopia e polipectomia. Dig Dis Sci. 1987; 32: 1239–43.
- Becker F, Nusko G, Welke J, Hahn EG, Mansmann U. Acompanhamento após polipectomia colorretal: Uma análise risco-benefício das recomendações de vigilância alemãs. Int J Colorretal Dis. 2007; 22: 929–39.
- Macrae FA, Tan KG, Williams CB. Para uma colonoscopia mais segura: Um relatório sobre as complicações de 5.000 colonoscopias diagnósticas ou terapêuticas. Intestino. 1983; 24: 376–83.
- Nelson, D.B.Complicações de doenças infecciosas da endoscopia GI: parte II, infecções exógenas. Gastrointest Endosc. 2003; 57: 695–711.
- Khashab, M.A., Chithadi, K.V., Acosta, R.D. et al. Profilaxia antibiótica para endoscopia GI. Comitê de Padrões de Prática da ASGE. Gastrointest Endosc. 2015; 81: 81-89.
- Lohsiriwat V. Perfuração colonoscópica: incidência, fatores de risco, gestão e resultado. World Journal of Gastroenterology: WJG. 2010; 16 (4): 425-430.
- Critérios de adequação do ACR do American College of Radiology: agudo (não localizado)
- Ko, C.W. e Dominitz, J.A. Complicações da colonoscopia: magnitude e manejo. Gastrointest Endosc Clin N Am. 2010; 20: 659–671.
- Warren JL, Klabunde CN, Mariotto AB, et al. Eventos adversos após colonoscopia ambulatorial na população do Medicare. Ann Intern Med 2009; 150: 849-57.
- Hui, A.J., Wong, R.M., Ching, J.Y. et al. Risco de sangramento de polipectomia colonoscópica com anticoagulantes e antiplaquetários: análise de 1.657 casos. Gastrointest Endosc. 2004; 59: 44–48.
- Sawhney, M.S., Salfiti, N., Nelson, D.B. et al. Fatores de risco para sangramento pós-polipectomia grave retardado. Endoscopia. 2008; 40: 115–119
- Yousfi, M., Gostout, C.J., Baron, T.H. et al. Sangramento gastrointestinal inferior pós-polipectomia: papel potencial da aspirina. Am J Gastroenterol. 2004; 99: 1785–1789.
- Critérios de adequação do ACR do American College of Radiology: Radiologic Management of Lower Gastrointestinal Tract Bleeding. https://acsearch.acr.org/docs/69457/Narrative/ (Acessado em 16 de julho de 2017).
- Lohsiriwat V, Sujarittanakarn S, Akaraviputh T, Lertakyamanee N, Lohsiriwat D, Kachinthorn U. Perfuração colonoscópica: um relatório do centro de treinamento em endoscopia da Organização Mundial de Gastroenterologia na Tailândia. World J Gastroenterol. 2008; 14: 6722–6725.
- Iqbal CW, Cullinane DC, Schiller HJ, Sawyer MD, Zietlow SP, Farley DR. Tratamento cirúrgico e resultados de 165 perfurações colonoscópicas de uma única instituição. Arch Surg. 2008; 143: 701–706; discussão 706-707.
- Teoh AY, Poon CM, Lee JF, Leong HT, Ng SS, Sung JJ, Lau JY. Resultados e preditores de mortalidade e formação de estomas no tratamento cirúrgico de perfurações colonoscópicas: uma revisão multicêntrica. Arch Surg. 2009; 144: 9–13.
- Lüning TH, Keemers-Gels ME, Barendregt WB, Tan AC, Rosman C. Colonoscopic perfurações: uma revisão de 30.366 pacientes. Surg Endosc. 2007; 21: 994–997.
- Mai CM, Wen CC, Wen SH, Hsu KF, Wu CC, Jao SW, Hsiao CW. Perfuração colônica iatrogênica por colonoscopia: uma complicação fatal para pacientes com alto risco anestésico. Int J Colorretal Dis. Abril de 2010; 25 (4): 449-54.
- Rathgaber SW, Wick TM. Conclusão da colonoscopia e taxas de complicações em uma clínica de gastroenterologia comunitária. Gastrointest Endosc. 2006; 64: 556–562.
- Damore LJ, Rantis PC, Vernava AM, Longo WE. Perfurações colonoscópicas. Etiologia, diagnóstico e gerenciamento. Dis Colon Rectum. 1996; 39: 1308–1314.
- Repici A, Pellicano R, Strangio G, Danese S, Fagoonee S, Malesci A. Ressecção endoscópica da mucosa para neoplasia colorretal precoce: bases patológicas, procedimentos e resultados. Dis Colon Rectum. 2009; 52: 1502–1515.
- Chukmaitov A, Bradley CJ, Dahman B, et al. Associação de técnicas de polipectomia, volume do endoscopista e tipo de instalação com complicações da colonoscopia. Gastrointest Endosc. 2013; 77: 436.
- Fisher DA, Maple DT, et al. Complicações da colonoscopia. ASGE Standards of Practice Committee Gastrointest Endosc. 2011; 74: 745. Dor abdominal e febre ou suspeita de abscesso abdominal; Variante 1: Paciente pós-operatório com febre. https://acsearch.acr.org/docs/69356/Narrative/ (Acessado em 17 de julho de 2017).
- Hirasawa K, Sato C, Makazu M, et al. Síndrome de coagulação: perfuração tardia após tratamentos endoscópicos colorretais. World Journal of Gastrointestinal Endoscopy. 2015; 7 (12): 1055-1061.
- Levin TR, Zhao W, Conell C, Seeff LC, Manninen DL, Shapiro JA, Schulman J. Complicações da colonoscopia em um sistema integrado de prestação de cuidados de saúde. Ann Intern Med. 2006; 145 (12): 880.
- Kim HW. O que é diferente entre a febre pós-polipectomia e a síndrome de coagulação pós-polipectomia? Clin Endosc. 2014; 47 (3): 205–6.
- Estoque C, Ihle P, Sieg A, Schubert I, Hoffmeister M, Brenner H Eventos adversos que exigem hospitalização dentro de 30 dias após a triagem ambulatorial e colonoscopias sem triagem. Gastrointest Endosc. 2013 Mar; 77 (3): 419-29.
- Sethi A, Song LMWK. Eventos adversos relacionados à ressecção endoscópica da mucosa colônica e polipectomia. Gastrointest Endosc Clin N Am. 2015; 25 (1): 55–69.
- Benson BC, Myers JJ, Laczek JT. Síndrome de eletrocoagulação pós-polipectomia: um simulador de perfuração colônica. Case Rep Emerg Med. 2013; 2013 687931.