- A presença de altas concentrações de anticorpos (título > 1: 640) deve fazer com que suspeite que uma doença auto-imune é presente. Nesse cenário, recomendo que os soros sejam testados para anticorpos anti-dsDNA, Sm, RNP, Ro (SS-A), La (SS-B) e talvez Scl-70. A presença de anticorpos para qualquer um desses aumenta muito a probabilidade de que o paciente tenha LES, DMTC, doença de Sjögren ou esclerodermia. Alguns laboratórios testarão automaticamente para esses anticorpos sempre que o ANA de triagem for positivo. No entanto, a presença desses anticorpos não é diagnóstico de doença. Se nenhum diagnóstico inicial puder ser feito, é minha prática observar o paciente cuidadosamente ao longo do tempo para o desenvolvimento de uma doença associada a ANA e ver o paciente pelo menos duas vezes por ano.
- A combinação de títulos baixos de anticorpos (< 1:80) e nenhum ou poucos sinais ou sintomas de doença pressagiam uma probabilidade muito menor de uma doença autoimune. Como resultado, esses pacientes com títulos baixos de ANA precisam ser reavaliados com menos frequência – anualmente, a menos que os sintomas clínicos evoluam para sugerir uma doença autoimune.
- É altamente improvável que um paciente com ANA negativo tenha LES ou DMTC , Sjögren ou esclerodermia. No entanto, se ainda houver forte evidência clínica de um distúrbio autoimune sistêmico, pode-se testar os anticorpos específicos para DNA de fita dupla (ds), Sm, RNP, Ro, La ou Scl-70, embora, em minha experiência, eles são tipicamente negativos. No entanto, é prudente ver esses pacientes onde há um alto índice clínico de suspeita, pelo menos uma vez por ano – embora com mais frequência se houver indicação clínica.
- Os anticorpos antinucleares produzem uma ampla gama de padrões de coloração (homogêneo, difuso , periférico, rim, pontilhado, nucleolar, anticentrômero, etc.). O padrão de coloração nuclear foi reconhecido por ter uma sensibilidade e especificidade relativamente baixas para diferentes doenças autoimunes. A presença de anticorpos dirigidos a antígenos nucleares específicos é geralmente mais útil. (Esses anticorpos incluem o seguinte: dsDNA, Sm, RNP, Ro, La ou Scl-70.)
Nos últimos anos, pesquisadores e firmas de biotecnologia desenvolveram fase sólida imunoensaios para substituir o teste IF ANA.4-23 A justificativa por trás dessa tentativa está relacionada às características de desempenho da técnica IF. Este teste é muito trabalhoso e está sujeito a variações devido a diferentes interpretações dos técnicos. Também complicar os testes é o desbotamento da imagem ao ser examinada em um microscópio fluorescente. Além disso, a técnica IF usa diluições em série de soros de pacientes, o que dará resultados que podem não ser lineares. As variações de duas vezes no título são comuns nos testes diários da mesma amostra; diferenças quádruplas são consideradas “significativas”. Em contraste, os imunoensaios de fase sólida são automatizados e altamente reproduzíveis. Os resultados são lineares, e a técnica é menos trabalhosa e, portanto, mais barata de executar.
Devido a essas considerações, deve haver economia em empregando um imunoensaio de fase sólida para quantificar um ANA. Assim, em uma tentativa de desenvolver imunoensaios de ANA de fase sólida, uma série de grupos colocaram na fase sólida quaisquer antígenos tipicamente testados nos imunoensaios ANA mais específicos (por exemplo, DNA, Sm, RNP, Ro / SSA, La / SSB, nucleoproteína, extratos de células, etc.) Em relatórios publicados, o coeficiente de correlação entre os títulos de ANA e esses ensaios de fase sólida é muito bom. Assim, muitas empresas comerciais mudaram seus ANAs a esses imunoensaios de fase sólida.4-23 De preocupação, no entanto, é a alta frequência / porcentagem de resultados falso-negativos em pacientes com LES conhecido e doenças relacionadas, bem como a alta frequência contínua de “falso-positivos” (por exemplo, um ANA positivo em alguém sem LES) nesses estudos.15-21 Mais trabalhos são necessários para melhorar a sensibilidade e especialmente a especificidade desses imunoensaios de fase sólida para garantir que os pacientes com LES e doenças relacionadas não sejam perdidos por esses imunoensaios de fase sólida.
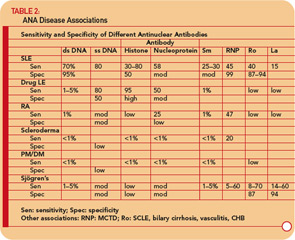
Anticorpos para DNA
Os anticorpos para DNA podem ser divididos principalmente em aqueles que reagem com DNA de fita simples (ss) e aqueles que reconhecem dsDNA.24-26
Anti- Anticorpos ssDNA foram relatados no LES, artrite reumatoide, lúpus relacionado a medicamentos, parentes saudáveis de pacientes com LES e, menos comumente, em outras doenças reumáticas. (Ver Tabela 2, p. 17.) Assim, o anti-ssDNA tem utilidade limitada para o diagnóstico de LES ou outras doenças reumáticas. O anti-ssDNA não se correlaciona bem com a atividade da doença e, portanto, não são úteis para o manejo da doença.
Os anticorpos para dsDNA são detectados mais frequentemente por imunoensaios de fase sólida, mas também em alguns laboratórios pelo ensaio IF de crithidia ou ocasionalmente, o radioimunoensaio Farr.A maioria dos laboratórios hospitalares e comerciais faz apenas um. O teste de Farr provavelmente tem a maior especificidade e a menor sensibilidade dos três testes para o diagnóstico de LES, enquanto os testes de fase sólida têm a maior sensibilidade e menor especificidade; o ensaio crithidia fica no meio. O ensaio de Farr também tem a desvantagem de usar material radioativo, que a maioria dos laboratórios evita, e o teste de crithidia é muito trabalhoso. Eu prefiro o ensaio ELISA para uso diário.
Os anti-dsDNA são específicos (95%), embora não altamente sensíveis (70%) para LES, tornando-os muito úteis para o diagnóstico quando positivos.9 (Ver Tabela 2 , p. 17.) Eles são ocasionalmente encontrados em outras condições, incluindo artrite reumatóide, artrite juvenil, lúpus induzido por drogas, hepatite autoimune e até mesmo em pessoas normais.
Os títulos de anticorpos anti-dsDNA costumam flutuar com atividade da doença, especialmente nefrite lúpica, e, portanto, são úteis em muitos pacientes para acompanhar o curso do LES. Se um paciente tem um título crescente, ou um título muito alto, mas clinicamente está quiescente, eu não trato a anormalidade sorológica, mas considero um sinal de alerta de que o paciente precisa ser seguido mais de perto e tratado quando algo acontece clinicamente para justificar um mudança na terapia. No entanto, alguns pesquisadores trataram essas anormalidades sorológicas (especialmente quando associadas a baixos níveis de complemento) e relataram melhores resultados clínicos. Por outro lado, eu uso um título decrescente em alguém que está melhorando após um surto de tratamento como um guia para reduzir o tratamento (por exemplo, corticosteroides e / ou imunossupressores).
A associação entre anticorpos anti-dsDNA e outros as manifestações da doença do LES são muito menos claras. Por exemplo, não há relação entre o título de anti-dsDNA e a atividade da doença do LES neuropsiquiátrico.
Distinguir as manifestações ativas do lúpus de complicações infecciosas ou efeitos tóxicos de drogas – e de doenças não relacionadas – é sempre um desafio. A presença de anticorpos anti-dsDNA pode ser útil em alguns pacientes para fazer essa distinção.
Anticorpos anti-Smith e anti-ribonucleoproteína
Anticorpos para Smith (Sm) e anti-ribonucleoproteína (anti-RNP) são mais frequentemente detectados por imunoensaios de fase sólida.24,27
Os anticorpos anti-Sm são encontrados em apenas 10% a 40% dos pacientes com LES, mas são muito raros em pacientes com outras condições (ou seja, eles não são sensíveis, mas são altamente específicos). A medição dos títulos de anti-Sm pode ser útil no diagnóstico, particularmente em um momento em que os anticorpos anti-DNA são indetectáveis. Dada a sensibilidade relativamente baixa do anti-Sm, no entanto, um valor negativo de forma alguma exclui o diagnóstico de LES.
Os anticorpos anti-RNP são encontrados em cerca de 40% a 60% dos pacientes com LES, mas não são específicos para o LES, sendo uma característica definidora do MCTD. Esses anticorpos também podem ocorrer em títulos e frequências baixas em outras doenças reumáticas, incluindo AR e esclerodermia. (Consulte a Tabela 2, p. 17.)
Nem o título (níveis) de anticorpos anti-Sm nem anti-RNP se correlacionam com qualquer atividade clínica.
Anti-Ro / SSA e anticorpos anti-La / SSB
Os anticorpos para Ro / SSA e La / SSB são mais frequentemente detectados por imunoensaios de fase sólida.28,29 Anti-Ro / SSA e anti-La / SSB foram detectados em alta frequência em pacientes com síndrome de Sjögren e no LES, mas também em pacientes com dermatite fotossensível e em 0,1% a 0,5% dos adultos saudáveis.
Anticorpos anti-Ro / SSA são encontrados em aproximadamente 50% de pacientes com LES. (Ver Tabela 2, p. 17.) Eles têm sido associados a fotossensibilidade, lúpus cutâneo subagudo, vasculite cutânea (púrpura palpável), doença pulmonar intersticial, lúpus neonatal e bloqueio cardíaco congênito. Anticorpos anti-Ro / SSA são encontrados em aproximadamente 75% dos pacientes com síndrome de Sjögren primária (ver Tabela 2, p. 17), e altos títulos desses anticorpos estão associados a uma maior incidência de características glandulares extras, especialmente púrpura e vasculite. Em contraste, os anticorpos Ro / SSA estão presentes em apenas 10% a 15% dos pacientes com síndrome de Sjögren secundária associada à artrite reumatóide. Portanto, a presença de anticorpos Ro / SSA ou anti-La / SSB em pacientes com suspeita de síndrome de Sjögren primária apóia fortemente o diagnóstico.
Aproximadamente 50% dos pacientes com LES que têm anticorpos anti-Ro também têm anticorpos anti-Ro -La anticorpo, um antígeno de RNA-proteína intimamente relacionado. Da mesma forma, a maioria dos pacientes com síndrome de Sjögren também tem anticorpos anti-La (SSB). É extremamente raro encontrar pacientes com anticorpos anti-La sem anticorpos anti-Ro.
Na minha opinião, as indicações para a solicitação de testes de anticorpos anti-Ro / SSA e anti-La / SSB são as seguintes:
- Mulheres com LES grávidas ou podem engravidar no futuro;
- Mulheres com histórico de parto de uma criança com bloqueio cardíaco ou miocardite;
- Pacientes com histórico de erupções cutâneas fotossensíveis inexplicáveis;
- Pacientes com forte suspeita de LES, mas com teste ANA negativo; ou
- Pacientes com sintomas de xerostomia, ceratoconjuntivite seca e / ou aumento das glândulas salivares e lacrimais.
Anticorpos anti-proteína P antiribossômicos
Anti- anticorpos da proteína P ribossomal foram detectados em 10% a 20% dos pacientes com LES nos Estados Unidos e 40% a 50% dos pacientes asiáticos com LES, mas raramente em outras doenças reumáticas.30 Os anticorpos anti-proteína P ribossomal podem ser altamente específico para psicose associada ao lúpus, embora nem todos os estudos tenham confirmado isso. Depressão e envolvimento renal e hepático em pacientes com lúpus também foram associados a anticorpos antiproteína P ribossomal em alguns estudos pequenos.
Devido à baixa sensibilidade e pobre correlação clínica, muitos investigadores – incluindo eu – veja pouca utilidade clínica neste teste.
Anticorpos anti-centrômero
Os anticorpos anti-centrômero (ACAs) são encontrados quase exclusivamente em pacientes com esclerose cutânea sistêmica limitada (lcSSc), especialmente naqueles com CREST.31 ACAs foram observados em 57% dos pacientes com CREST, mas também foram observados em pacientes com outras condições, incluindo em alguns pacientes apenas com fenômeno de Raynaud. ACAs são normalmente detectados pelo padrão IF característico nas células Hep-2.
Anticorpos anti-Scl-70 (topoisomerase-1)
Aproximadamente 15% a 20% dos pacientes com esclerodermia possuem anticorpos para uma proteína de 70kd (topoisomerase-1), posteriormente denominada Scl-70.31. O método usual de detecção é por ELISA. A presença desses anticorpos parece aumentar o risco de fibrose pulmonar entre pacientes com esclerodermia e é bastante específico para a doença.
Resumo
Se alguém suspeitar de LES com base na história, exame físico exame físico e hemograma completo (por exemplo, leucopenia, trombocitopenia), solicite um teste de ANA. Se for negativo, é altamente improvável que o paciente tenha LES, e o paciente pode ficar tranquilo. Se o título for < 1: 160, o LES é improvável e o paciente pode ter certeza de que o LES é improvável, mas o paciente deve ser acompanhado periodicamente. Um título ≥1: 160 aumenta a probabilidade de LES e distúrbios relacionados. No entanto, é importante lembrar que 85% dos indivíduos com FAN positivo não têm LES. Se o ANA for positivo, deve-se também testar os anticorpos anti-dsDNA, Sm, RNP, Ro / SSA e La / SSB. A presença desses anticorpos aumenta muito a probabilidade de o paciente ter LES e distúrbios relacionados (ver Tabela 2, p. 17), e o paciente precisa ser acompanhado mais de perto. A detecção de anticorpos anticentrômero e anti-Scl-70 é muito útil para o diagnóstico de esclerodermia. A detecção de anticorpos para Ro / SSA e La / SSB também são úteis para o diagnóstico da síndrome de Sjögren.
O único desses testes que é útil para monitorar a atividade é o anti-dsDNA.
Agradecimento: Agradeço o trabalho de muitos autores do UpToDate in Medicine, cujo trabalho forneceu uma estrutura útil para o desenvolvimento deste artigo, bem como aos Drs. Robert Shmerling, David Lee e Donald Bloch, com quem escrevi artigos e capítulos sobre o mesmo assunto.
Dr. Schur é professor de medicina na Harvard Medical School e da divisão de reumatologia, imunologia e alergia no departamento de medicina do Brigham and Women’s Hospital em Boston.
- Reichlin M. Medição e significado clínico de anticorpos antinucleares. Atualizado. Outubro de 2008.
- Comitê Ad Hoc do American College of Rheumatology para Diretrizes de Testes Imunológicos. Diretrizes para testes de laboratório imunológico nas doenças reumáticas: Uma introdução. Arthritis Rheum. 2002; 47: 429-433.
- Solomon DH, Kavanaugh AJ, Schur PH, et al. Diretrizes baseadas em evidências para o uso de testes imunológicos: Teste de anticorpos antinucleares. Arthritis Rheum. 2002; 47: 434-444.
- Sinclair D, Saas M, Williams D, Hart M, Goswami R. Pode um ELISA substituir a imunofluorescência para a detecção de anticorpos antinucleares? —O uso rotineiro de anti – ELISAs de rastreamento de anticorpos nucleares. Clin Lab. 2007; 53: 183-191.
- Avaniss-Aghajani E, Berzon S, Sarkissian A. Clinical value of multiplexed bead-based immunoassays for detecção of autoanticorpos to nuclear antigen. Clin Vaccine Immunol. 2007; 14: 505-509.
- Copple SS, Martins TB, Masterson C, Joly E, Hill HR. Comparação de três imunoensaios multiplex para detecção de anticorpos para anticorpos nucleares extraíveis usando soros clinicamente definidos. Ann N. Y Acad Sei.2007; 1109: 464-472.
- Caramaschi P, Ruzzenente O, Pieropan S, et al. Determinação da especificidade de ANA usando imunoensaio de microesferas fluorescentes multiplexadas em pacientes com positividade de ANA em altos títulos após tratamento com infliximabe: Resultados preliminares. Rheumatol Int. 2007; 27: 649-654.
- Biagini RE, Parks CG, Smith JP, Sammons DL, Robertson SA. Desempenho analítico do ensaio AtheNA MultiLyte ANA II em soros de pacientes com lúpus com múltiplos ANAs positivos. Anal Bioanal Chem. 2007; 388: 613-618.
- Gonzalez C, Garcia-Berrocal B, Perez M, et al. Triagem laboratorial de doenças do tecido conectivo por um novo ensaio de triagem ENA automatizado (EliA Symphony) em pacientes clinicamente definidos Clin Chim Acta. 2005; 359: 109-114.
- Eissfeller P, Sticherling M, Scholz D, et al. Comparação de diferentes sistemas de teste para detecção simultânea de autoanticorpos em doenças do tecido conjuntivo. Ann N. Y Acad Sei. 2005; 1050: 327-339.
- Smith J, Onley D, Garey C, et al. Determinação da especificidade ANA usando a plataforma UltraPlex. Ann N. Y Acad Sei. 2005; 1050: 286-294.
- Martins TB, Burlingame R, von Muhlen CA, et al. Avaliação de imunoensaio de microesferas fluorescentes multiplexadas para detecção de autoanticorpos para antígenos nucleares. Clin Diagn Lab Immunol. 2004; 11: 1054-1059.
- Bernardini S, Infantino M, Bellincampi L, et al. Rastreio de anticorpos antinucleares: Comparação entre imunoensaio enzimático baseado em homogenatos nucleares, antigénios purificados ou recombinantes e ensaio de imunofluorescência. Clin Chem Lab Med. 2004; 42: 1155-1160.
- Nossent H, Rekvig OP. Triagem de anticorpos antinucleares neste novo milênio: adeus ao microscópio? Scand J Rheumatol. 2001; 30: 123-126; discussão 127-128.
- Lopez-Hoyos M, Rodriguez-Valverde V, Martinez-Taboada V. Performance of antinuclear anticorpos conectivos tecido disease screen. Ann N. Y Acad Sei. 2007; 1109: 322-329.
- Ghillani P, Rouquette AM, Desgruelles C, et al. Avaliação do ensaio de triagem LIAISON ANA para teste de anticorpos antinucleares em doenças autoimunes. Ann N. Y Acad Sei. 2007; 1109: 407-413.
- Bonilla E, Francis L, Allam F, et al. A microscopia de imunofluorescência é superior às esferas fluorescentes para detecção de reatividade de anticorpos antinucleares em pacientes com lúpus eritematoso sistêmico. Clin Immunol. 2007; 124: 18-21.
- Nifli AP, Notas G, Mamoulaki M, et al. Comparação de um ensaio fluorescente multiplex baseado em esferas e métodos de imunofluorescência para a detecção de autoanticorpos ANA e ANCA em soro humano. J Immunol Methods. 2006; 311: 189-197.
- Shovman O, Gilburd B, Zandman-Goddard G, et al. Multiplexed AtheNA multi-lyte immunoassay para ANA rastreio em doenças auto-imunes. Autoimunidade. 2005; 38: 105-109.
- Ulvestad E. Características de desempenho e utilidade clínica de um ELISA híbrido para detecção de ANA. Apmis. 2001; 109: 217-222.
- Olaussen E, Rekvig OP. Testes de triagem para anticorpos antinucleares (ANA): Uso seletivo de antígenos nucleares centrais como base racional para triagem por ELISA. J Autoimmun. 1999; 13: 95-102.
- Homburger HA, Cahen YD, Griffiths J, Jacob GL. Detecção de anticorpos antinucleares: Avaliação comparativa dos métodos de imunoensaio enzimático e imunofluorescência indireta. Arch Pathol Lab Med. 1998; 122: 993-999.
- Gniewek RA, Stites DP, McHugh TM, Hilton JF, Nakagawa M. Comparison of antinuclear anticorpos test methods: Immunofluorescence assay versus enzima immunoassay. Clin Diagn Lab Immunol. 1997; 4: 185-188.
- Reichlin M. Antibodies to DNA, SM e RNP. Atualizado. Outubro de 2008.
- Hahn BH. Anticorpos para DNA. New Engl J Med. 1998; 338: 1359.
- Kavanaugh AF, Solomon DH, Comitê Ad Hoc do American College of Rheumatology sobre Diretrizes de Testes Imunológicos. Diretrizes para testes laboratoriais imunológicos nas doenças reumáticas: Testes de anticorpos anti-DNA. Arthritis Rheum. 2002; 47: 546-555.
- Benito-Garcia E, Schur PH, Lahita R. Diretrizes para testes de laboratório imunológico nas doenças reumáticas: testes de anticorpos anti-Sm e anti-RNP. Arthritis Rheum. 2004; 51: 1030-1044.
- Reichlin M. Significância clínica dos anticorpos anti-Ro / SSA e anti-La / SSB. Atualizado. Outubro de 2008.
- Reveille JD, Sherrer YRS, Solomon DH, Schur P, Kavanaugh A. Diretrizes baseadas em evidências para o uso de testes laboratoriais imunológicos: Anti-Ro (SS-A) e La (SS- B): Um relatório do Comitê Ad Hoc ACR sobre Diretrizes de Testes Imunológicos. Enviado para publicação.
- Anticorpos de proteína P antiribossômica de Reichlin M. Atualizado. Outubro de 2008.
- Denton CP. Classificação da esclerodermia. Atualizado. Outubro de 2008.