US Pharm. 2018; 43 (7): 22-26.
RESUMO: As estatinas são uma classe de medicamentos amplamente utilizada na prevenção primária e secundária de eventos cardiovasculares. Com seis estatinas disponíveis genericamente, a seleção de um agente apropriado pode ser determinada com base em fatores específicos do medicamento, incluindo considerações de dosagem, interações medicamentosas e eventos adversos. Planos individualizados de cuidados com o paciente podem ser desenvolvidos com base em dados de estudos clínicos importantes, diferenças nas diretrizes e recomendações de manejo atuais para dois eventos adversos principais associados ao uso de estatinas.
A pedra angular do tratamento da dislipidemia envolve o uso de Inibidores da 3-hidroxi-3-metilglutaril-coenzima A redutase, mais comumente conhecidos como estatinas. Com uma variedade de opções genéricas no mercado e fortes evidências apoiando seu uso, as estatinas são alguns dos medicamentos mais amplamente prescritos no mundo.1 No entanto, o uso frequente desses agentes levou a um escrutínio contínuo de sua segurança e ao debate contínuo sobre seus papel na terapia. Este artigo, que se concentra nas estatinas genéricas, destacará o debate sobre o papel das estatinas na terapia, discutirá o uso adequado e explorará as evidências em torno de dois eventos adversos importantes.
Das sete estatinas diferentes no mercado, seis estão disponíveis genericamente (TABELA 1) .2-7 Três formulações de marca disponíveis são pitavastatina (Livalo), suspensão oral de sinvastatina (FloLipid) e lovastatina de liberação prolongada (Altoprev) .8-10 O papel dos agentes de marca na terapia é limitado, dado a ampla disponibilidade de opções genéricas.
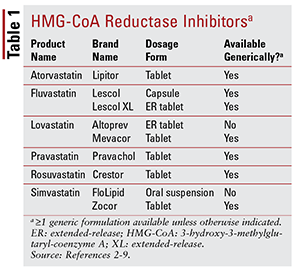
Atorvastatina e sinvastatina também estão disponíveis genericamente em vários produtos combinados. Estes incluem a combinação de atorvastatina e amlodipina, um bloqueador dos canais de cálcio (CCB) indicado para hipertensão, e a combinação de sinvastatina e ezetimiba, um inibidor da absorção de colesterol intestinal também indicado para hipercolesterolemia.11,12 Estatina coformulada e produtos de niacina (niacina / lovastatina e niacina / sinvastatina) foram removidos do mercado em 2016 com base na falta de evidências de que a adição de niacina em pacientes tratados com estatina reduz ainda mais os resultados cardiovasculares (CV) além do que é visto com estatinas isoladamente.13
RECOMENDAÇÕES DE TRATAMENTO
As estatinas têm se mostrado repetidamente eficazes na redução dos níveis de LDL-colesterol (LDL-C) e triglicerídeos, enquanto aumentam os níveis de HDL-colesterol (HDL-C). 14 Além disso, elas mostraram melhorar significativamente resultados orientados para o paciente, como eventos CV maiores (CVEs), na prevenção primária e secundária.15-19
Várias diretrizes de tratamento amplamente debatidas discutem o papel das estatinas no tratamento de perlipidemia. Estas incluem a diretriz 2013 do American College of Cardiology / American Heart Association (ACC / AHA) e a diretriz da Academia Americana de Endocrinologia Clínica (AACE) de 2017.14,20 Ambas as diretrizes sugerem que após a implementação de modificações no estilo de vida, incluindo a cessação do tabagismo, aderir um regime de exercícios e seguindo uma dieta saudável para o coração, as estatinas são a terapia de primeira linha para prevenção primária e secundária de doenças cardiovasculares (DCV) .14,20 As diretrizes diferem, no entanto, em como determinar quais estatinas são apropriadas para quais pacientes.
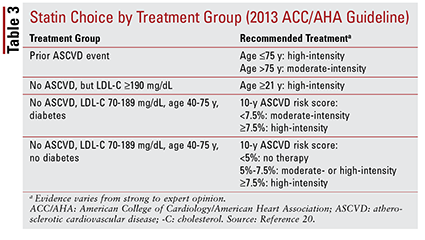
A diretriz ACC / AHA de 2013 introduziu quatro grupos de tratamento a serem direcionados para terapia com estatinas:
1. Pacientes com DCV aterosclerótica prévia (ASCVD), incluindo aqueles com um evento anterior (ou seja, síndromes coronárias agudas, história de infarto do miocárdio, angina estável ou instável, coronária ou outra revascularização arterial, acidente vascular cerebral, ataque isquêmico transitório ou doença arterial periférica presumida origem aterosclerótica).
2. Pacientes sem histórico de um evento ASCVD que têm um nível de LDL-C de 190 mg / dL ou superior. A idade não é uma base para exclusão deste critério.
3. Pacientes de 40 a 75 anos com diabetes, mas sem histórico de evento ASCVD e nível de LDL-C entre 70 e 189 mg / dL.
4. Pacientes com idade entre 40 e 75 anos sem diabetes sem histórico de evento ASCVD e nível de LDL-C entre 70 e 189 mg / dL.20
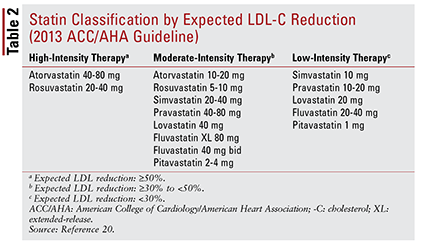
A diretriz ACC / AHA também introduziu a ideia de agrupar estatinas por intensidade (ou seja, sua capacidade de redução do LDL-C esperada) (TABELA 2) .20 Com base no grupo de tratamento (conforme definido acima), a diretriz recomenda intensidades específicas de estatinas para situações clínicas particulares (TABELA 3) .20 Vários grupos de tratamento exigem o cálculo de uma pontuação de risco ASCVD usando um estimador de risco ASCVD. Esta ferramenta online leva em consideração a idade do paciente, sexo, raça, pressão arterial sistólica, colesterol total, HDL-C e histórico médico anterior significativo para tratamento de hipertensão, diabetes ou tabagismo.21 Uma vez que todas as entradas foram inseridas, o paciente 10 É calculado o risco de um ano de experimentar um evento ASCVD.
Essas recomendações não se aplicam automaticamente a certos subgrupos de pacientes. Por exemplo, o uso de estatinas em adultos mais velhos deve ser abordado com cautela. Embora o uso de estatinas para prevenção secundária em pacientes idosos confira benefícios significativos, seu uso para prevenção primária não é claro.22-24 Além disso, não se constatou que pacientes com insuficiência cardíaca experimentam os mesmos benefícios da terapia com estatinas que aqueles sem insuficiência cardíaca.25 sobre esses achados, as recomendações de tratamento incluem limitar o início de estatinas de alta intensidade para pacientes com menos de 75 anos e possivelmente evitar estatinas em pacientes com insuficiência cardíaca.20 No geral, a decisão de usar estatinas nesses grupos não é clara e deve envolver uma conversa contínua entre o provedor e o paciente sobre os riscos e benefícios potenciais da terapia.20
Ao contrário da recomendação ACC / AHA de 2013 para iniciar a terapia de acordo com a classificação do grupo de tratamento, a diretriz AACE 2017 recomenda que os pacientes individuais sejam tratados com base em resultados laboratoriais.14 De acordo com esta diretriz, o risco do paciente é determinado por uma variedade de principais, adicionais, a e fatores de risco não tradicionais. Os indivíduos são então classificados em um dos cinco grupos de risco, cada um com uma meta de LDL-C e não-HDL-C correspondente (TABELA 4). Com base nos níveis atuais e objetivos individualizados, as estatinas sozinhas ou em combinação com outros agentes devem ser iniciadas com base na capacidade de redução de LDL-C ou não-HDL-C esperada.14

O tratamento combinado envolvendo a adição de um segundo agente à terapia em andamento com estatinas permanece um tópico um tanto controverso. Considerando que estudos e diretrizes anteriores minimizaram a adição de outros agentes à terapia de base com estatina, estudos recentes e declarações de consenso – incluindo um do ACC / AHA – apóiam o uso de ezetimiba, evolocumabe ou alirocumabe, os dois últimos dos quais são subtilisina de pró-proteína convertase / inibidores da kexina tipo 9, como terapia adicional para prevenção secundária.20,26-31 Dito isso, as estatinas permanecem como terapia de primeira linha universal na prevenção primária e secundária; o papel definitivo de outros agentes específicos permanece obscuro.
SELEÇÃO DE ESTATINA
A escolha da terapia com estatina começa com a abordagem de tratamento preferida do médico, seja o método ACC / AHA de tratamento com estatina grupos ou o método AACE de metas de LDL-C ou não-HDL-C. A partir daí, as propriedades de cada estatina devem ser levadas em consideração para determinar a melhor opção para cada paciente. Nem todas as estatinas são iguais e existem várias diferenças importantes que podem influenciar a seleção do paciente, incluindo considerações sobre a dosagem, interações medicamentosas e eventos adversos (AEs).
Dosagem
Embora a maioria das estatinas possa ser tomada independentemente das refeições, a lovastatina de liberação imediata (IR) deve ser tomada com a refeição da noite devido ao aumento da biodisponibilidade.4 No entanto, o oposto é verdadeiro para a lovastatina de liberação prolongada, que não deve ser tomada com alimentos devido à diminuição da biodisponibilidade .8 Além disso, embora todas as estatinas possam ser administradas uma vez ao dia, IR fluvastatina e lovastatina podem requerer administração de duas vezes ao dia.3,4 Finalmente, enquanto atorvastatina, pravastatina e rosuvastatina podem ser administradas a qualquer hora do dia, fluvastatina, lovastatina e a sinvastatina deve ser tomada à noite.3,4,7 A sinvastatina, em particular, demonstrou ter eficácia significativamente diferente quando tomada à noite em comparação com a manhã.32
Interações medicamentosas
Cada estatina possui diferentes preocupações com relação às interações medicamento-medicamento e medicamento-alimento devido às vias específicas através das quais cada um é metabolizado (TABELA 5). Existem muitas interações medicamentosas para discutir cada uma delas em detalhes; portanto, apenas alguns selecionados são descritos abaixo.
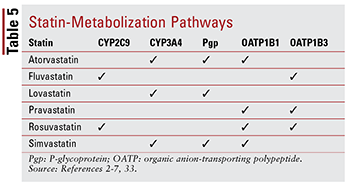
Fibra: embora a combinação de um fibrato e uma estatina não mostrou alterar significativamente os resultados clínicos, os pacientes ainda podem receber gemfibrozil, fenofibrato ou ácido fenofíbrico junto com uma estatina para direcionar a hipertrigliceridemia gravemente não controlada.14,20,26,33 Porque ambas as classes estão associados à toxicidade relacionada aos músculos, a terapia combinada aumenta significativamente esse risco em comparação com qualquer uma das terapias isoladamente.33 Essa toxicidade aditiva é mais freqüentemente observada com o gemfibrozil do que com outros fibratos.33 Portanto, o uso do gemfibrozil é contra-indicado com a sinvastatina e deve ser evitado com outros estatinas.7,20 Se uma estatina e um fibrato forem usados juntos, fenofibrato ou ácido fenofíbrico é preferido.20,33 No entanto, se gemfibrozil deve ser usado, fluvastatina – ou, com monitoramento cuidadoso, atorvastatina ou rosuvastatina (máximo de 10 mg por dia ) – é o agente de escolha.33
Amiodarona: Este agente antiarrítmico indicado para fibrilação ventricular é um conhecido inibidor da glicoproteína P (Pgp) e do sistema enzimático CYP450, especificamente CYP3A4 e, em menor extensão, CYP2C9.33,34 Como um resultado, existem dosagens máximas recomendadas para lovastatina (máximo de 40 mg por dia) e sinvastatina (máximo de 20 mg por dia) quando usado com amiodarona.4,7,33 Embora a atorvastatina seja metabolizada através do CYP3A4, nenhum ajuste de dose é necessário (semelhante a outras estatinas) porque os dados não sugerem AEs graves quando atorvastatina e amiodarona são usados concomitantemente.2,33
CCBs: Ambos os CCBs dihidropiridina (amlodipina) e não dihidropiridina (diltiazem, verapamil) demonstraram ter interações medicamentosas significativas com estatinas . Da mesma forma que a amiodarona, amlodipina, diltiazem e verapamil inibem CYP3A4.33,35-37 A amlodipina também tem um efeito inibitório na Pgp.33,35 Com base em EAs relatados na literatura, uma dosagem máxima diária de 20 mg para lovastatina é recomendada quando usado com amlodipina, diltiazem ou verapamil.4,33 Também é recomendado que a sinvastatina não exceda 20 mg quando usada com amlodipina, mas uma dose inferior de 10 mg deve ser administrada quando usada com diltiazem e verapamil.7,33 Sem dosagem específica existem recomendações com a atorvastatina, embora seja necessário cautela ao administrá-la com qualquer um dos CCBs não di-hidropiridínicos.2,33
Reações adversas ao medicamento
As estatinas geralmente são bem toleradas; no entanto, as taxas de descontinuação permanecem altas.38 A descontinuação da terapia com estatinas e a falha em retomar a terapia com estatinas após a ocorrência de reações adversas ao medicamento estão associadas a taxas aumentadas de CVEs.39 As preocupações dos pacientes sobre a segurança das estatinas à luz de dois grandes eventos adversos relacionados às estatinas— miotoxicidade e diabetes de início recente – podem levar à descontinuação das estatinas.
Miotoxicidade: as estatinas têm sido associadas à toxicidade relacionada aos músculos, incluindo mialgia (dor muscular sem creatina quinase elevada), miopatia (termo geral para músculo doença) e miosite (inflamação muscular), as duas últimas das quais envolvem elevações significativas de CK.40,41 Todas as estatinas compartilham um alerta para o efeito colateral raro, mas sério, da rabdomiólise.2-7 Freqüentemente, entretanto, a miotoxicidade atribuída às estatinas é devido ao efeito nocebo; ou seja, uma pessoa acredita que um medicamento causará dano e, subsequentemente, o medicamento causará o dano previsto.42,43 Portanto, para garantir o melhor resultado, os farmacêuticos devem ser bem versados neste efeito colateral comumente relatado e em seu manejo adequado.
É incorreto assumir que todos os relatos de sintomas musculares são devidos ao efeito nocebo; a verificação adequada da história médica pregressa do paciente (HPM), descrição da dor e associação com terapia com estatinas é imprescindível.44 Em primeiro lugar, um exame de HPM para elevações de CK e outras causas potenciais de dor ou fraqueza muscular permite que o clínico trate fisiopatologia subjacente ou fatores corretos que podem alterar o metabolismo das estatinas. As causas comuns incluem idade avançada, interações medicamentosas, disfunção renal ou hepática, aumento da atividade física e deficiência de vitamina D.20,41
Em seguida, o clínico deve comparar a apresentação do paciente com os sintomas comumente observados induzidos por estatinas . A toxicidade muscular induzida por estatinas geralmente se apresenta como dor, sensibilidade, cãibras e fraqueza, geralmente nos músculos das pernas.20,41 Esses sintomas geralmente pioram após o exercício e não se resolvem sem a interrupção do agente agressor.41
A última etapa é determinar se existe uma relação causal entre os sintomas e o uso de estatinas. Quando se suspeita que uma estatina é a causa dos sintomas leves a moderados, a suspensão temporária é recomendada. Se os sintomas não desaparecerem após aproximadamente 2 semanas, a estatina provavelmente não é a causa e deve ser reiniciada com a dose original. No entanto, se os sintomas desaparecerem, deve ser realizado um novo teste da mesma estatina com a mesma dose ou com uma dose inferior. Se ocorrerem sintomas semelhantes, a estatina deve ser considerada a causa e interrompida. Após a resolução dos sintomas, uma dose baixa de uma estatina alternativa deve ser iniciada e titulada até a dose máxima tolerada.20,41 A aceitação e compreensão desse processo pelo paciente são importantes porque o efeito nocebo pode, de outra forma, levar a outras reações percebidas.
Existem várias outras estratégias para gerenciar e prevenir esses sintomas. Em primeiro lugar, devido à maior probabilidade de sintomas, o clínico pode escolher evitar a maioria das estatinas lipofílicas (lovastatina e sinvastatina) em favor de estatinas mais hidrofílicas (fluvastatina, pravastatina e rosuvastatina) .44 A sinvastatina 80 mg nunca deve ser iniciada como nova. terapia em qualquer paciente devido a uma frequência excepcionalmente alta de sintomas musculares associados às estatinas.7,45 Terapias alternativas, como a coenzima Q10, não demonstraram benefício consistente, mas podem ser consideradas em pacientes que apresentam sintomas induzidos psicologicamente.41,44,46 Finalmente, a dosagem de intervalo estendido, que envolve a dosagem de estatinas várias vezes por semana, em vez de uma vez ao dia, pode ser considerada. Esta abordagem melhora a aderência e os perfis lipídicos em pacientes com intolerância à estatina anterior.47-49
Diabetes de início recente: Um EA importante associado ao uso de estatinas é o diabetes de início recente. Foi demonstrado que as estatinas aumentam o risco de desenvolvimento de diabetes, embora existam várias advertências importantes.50 Em primeiro lugar, embora isso possa ser considerado uma espécie de efeito de classe, o verdadeiro risco de cada estatina específica ainda é desconhecido.51,52 Na maior meta -análise até o momento, a pravastatina teve o menor risco, a sinvastatina e a atorvastatina tiveram um risco moderado e a rosuvastatina teve o maior risco de causar diabetes de início recente.53 Nenhum desses achados foi estatisticamente significativo, no entanto.53 Além disso, a descoberta de que diabetes o risco aumenta à medida que a dose de estatinas aumenta. 54
O diabetes induzido por estatinas é mais prevalente em pessoas já com alto risco de desenvolver diabetes.50,54 Isso inclui pacientes mais velhos e aqueles com pré-diabetes ou doenças metabólicas síndrome.50,55 Um achado consistente foi que, para cada novo caso de diabetes incidente causado por estatinas, vários CVEs podem ser evitados em pacientes de alto risco.50 Portanto, os farmacêuticos devem aconselhar um Muitos usuários de estatina apresentam risco moderado ou alto de complicações cardiovasculares, de modo que o risco de desenvolver diabetes é mais do que compensado pelos benefícios de redução do risco cardiovascular. No entanto, a relação risco-benefício não é clara em pacientes com risco muito baixo de CVEs.50
CONCLUSÃO
Embora a terapia com estatinas não seja isenta de riscos, seus benefícios na redução dos resultados CV têm tornou a pedra angular da prevenção CVE. As diretrizes disponíveis variam amplamente, mas a única constante é que as estatinas devem ser a terapia de primeira linha para prevenção primária e secundária em quase todos os pacientes. A ampla disponibilidade de genéricos de estatinas tornou esses agentes cada vez mais acessíveis. Ao compreender que nem todas as estatinas são iguais, o farmacêutico pode ajudar a garantir o melhor resultado possível para cada paciente.
1. IMS Institute for Healthcare Informatics. Uso e gastos de medicamentos nos EUA: uma revisão de 2015 e perspectivas para 2020. https://morningconsult.com/wp-content/uploads/2016/04/IMS-Institute-US-Drug-Spending-2015.pdf. Acessado em 18 de março de 2018.
2. Bula de Lipitor (atorvastatina). New York, NY: Pfizer, Inc; Junho de 2017.
3. Folheto informativo de Lescol / Lescol XL (fluvastatina). East Hanover, NJ: Novartis Pharmaceuticals Corp; Agosto de 2017.
4. Folheto informativo de Mevacor (lovastatina). Estação Whitehouse, NJ: Merck & Co, Inc; Fevereiro de 2014.
5. Bula de Pravachol (pravastatina). Princeton, NJ: Bristol-Myers Squibb Company; Julho de 2016.
6. Folheto informativo de Crestor (rosuvastatina). Wilmington, DE: AstraZeneca Pharmaceuticals LP; Agosto de 2017.
7. Folheto informativo de Zocor (sinvastatina). Estação Whitehouse, NJ: Merck & Co, Inc; Fevereiro de 2015.
8. Folheto informativo de Altoprev (lovastatina). Zug, Suíça: Covis Pharma; Abril de 2017.
9. Folheto informativo do FloLipid (sinvastatina). Brooksville, FL: Salerno Pharmaceuticals LP; Julho de 2017.
10. Folheto informativo de livalo (pitavastatina). Montgomery, AL: Kowa Pharmaceuticals America, Inc; Novembro de 2016.
11. Bula Caduet (amlodipina / atorvastatina). New York, NY: Pfizer Inc; Outubro de 2017.
12. Folheto informativo de Vytorin (ezetimiba / sinvastatina). Estação Whitehouse, NJ: Merck & Co, Inc; Fevereiro de 2018.
13. AbbVie Inc .; retirada da aprovação de novos pedidos de medicamentos para Advicor e Simcor. www.federalregister.gov/documents/2016/04/18/2016-08894/abbvie-inc-withdrawal-of-approval-of-new-drug-applications-for-advicor-and-simcor. Acessado em 18 de março de 2018.
14. Jellinger PS, Handelsman Y, Rosenblit PD, et al. Diretrizes da American Association of Clinical Endocrinologists e do American College of Endocrinology para o tratamento da dislipidemia e prevenção de doenças cardiovasculares. Endocr Pract. 2017; 23 (suppl 2): 1-87.
15. LaRosa JC, Grundy SM, Waters DD, et al. Redução intensiva de lipídios com atorvastatina em pacientes com doença coronariana estável. N Engl J Med. 2005; 352: 1425-1435.
16. Ridker PM, Danielson E, Fonseca FA, et al. Rosuvastatina para prevenir eventos vasculares em homens e mulheres com proteína C reativa elevada. N Engl J Med. 2008; 359: 2195-2207.
17. Mihaylova B, Emberson J, Blackwell L, et al. Os efeitos da redução do colesterol LDL com terapia com estatinas em pessoas com baixo risco de doença vascular: meta-análise de dados individuais de 27 estudos randomizados. Lanceta. 2012; 380: 581-590.
18. Baigent C, Landray MJ, Reith C, et al. Os efeitos da redução do colesterol LDL com sinvastatina mais ezetimiba em pacientes com doença renal crônica (Estudo do Coração e Proteção Renal): um estudo randomizado controlado com placebo. Lanceta. 2011; 377: 2181-2192.
19. Cannon CP, Braunwald E, McCabe CH, et al.Redução lipídica intensiva versus moderada com estatinas após síndromes coronárias agudas. N Engl J Med. 2004; 350: 1495-1504.
20. Stone NJ, Robinson JG, Lichtenstein AH, et al. Diretriz da ACC / AHA de 2013 sobre o tratamento do colesterol no sangue para reduzir o risco cardiovascular aterosclerótico em adultos: um relatório do American College of Cardiology / American Heart Association Task Force on Practice Guidelines. Circulação. 2014; 129 (25 supl. 2): S1-S45.
21. American College of Cardiology. Estimador de risco ASCVD Plus. http://tools.acc.org/ASCVD-Risk-Estimator. Acessado em 18 de março de 2018.
22. Wenger NK, Lewis SJ, Herrington DM, et al. Resultados do uso de atorvastatina em dose alta ou baixa em pacientes de 65 anos de idade ou mais com doença coronariana estável. Ann Intern Med. 2007; 147: 1-9.
23. Shepherd J, Blauw GJ, Murphy MB, et al. Pravastatina em idosos com risco de doença vascular (PROSPER): um ensaio clínico randomizado. Lanceta. 2002; 360: 1623-1630.
24. Teng M, Lin L, Zhao YJ, et al. Estatinas para prevenção primária de doenças cardiovasculares em pacientes idosos: revisão sistemática e meta-análise. Envelhecimento de drogas. 2015; 32: 649-661.
25. Kjekshus J, Apetrei E, Barrios V, et al. Rosuvastatina em pacientes idosos com insuficiência cardíaca sistólica. N Engl J Med. 2007; 357: 2248-2261.
26. Ginsberg HN, Elam MB, Lovato LC, et al. Efeitos da terapia combinada de lipídios no diabetes mellitus tipo 2. N Engl J Med. 2010; 362: 1563-1574.
27. Kastelein JJ, Akdim F, Stroes ES, et al. Sinvastatina com ou sem ezetimiba na hipercolesterolemia familiar. N Engl J Med. 2008; 358: 1431-1443.
28. Cannon CP, Blazing MA, Giugliano RP, et al. Ezetimiba adicionada à terapia com estatinas após síndromes coronárias agudas. N Engl J Med. 2015; 372: 2387-2397.
29. Sabatine MS, Giugliano RP, Keech AC, et al. Evolocumabe e resultados clínicos em pacientes com doença cardiovascular. N Engl J Med. 2017; 376: 1713-1722.
30. Lloyd-Jones DM, Morris PB, Ballantyne CM, et al. Atualização focada em 2017 do Caminho de Decisão do Consenso de Especialistas do ACC 2016 sobre o papel das terapias sem estatinas para redução do colesterol LDL no gerenciamento do risco de doença cardiovascular aterosclerótica: um relatório da Força-Tarefa do American College of Cardiology sobre caminhos de decisão do consenso de especialistas J Am Coll Cardiol. 2017; 70: 1785-1822.
31. Resultados da ODISSEIA: os resultados sugerem que o uso do inibidor PCSK9 reduz os eventos CV, LDL-C em pacientes com SCA. American College of Cardiology. www.acc.org/latest-in-cardiology/articles/2018/03/05/15/53/sat-9am-odyssey-outcomes-cv-outcomes-with-alirocumab-after-acs-acc-2018. Acessado em 20 de junho de 2018.
32. Wallace A, Chinn D, Rubin G. Tomando sinvastatina pela manhã em comparação com à noite: ensaio clínico randomizado. BMJ. 2003; 327: 788.
33. Wiggins BS, Saseen JJ, Page RL, et al. Recomendações para o gerenciamento de interações medicamentosas clinicamente significativas com estatinas e agentes selecionados usados em pacientes com doença cardiovascular: uma declaração científica da American Heart Association. Circulação. 2016; 134: e468-e495.
34. Bula da pacerona (amiodarona). Maple Grove, MN: Upsher-Smith Laboratories LLC; Julho de 2017.
35. Folheto informativo de Norvasc (amlodipina). New York, NY: Pfizer Inc; Outubro de 2017.
36. Folheto informativo Cardizem (diltiazem). Bridgewater, NJ: Valeant Pharmaceuticals; Novembro de 2016.
37. Folheto informativo de Calan (verapamil). New York, NY: Pfizer Inc; Setembro de 2017.
38. Riaz H, Khan AR, Khan MS, et al. Meta-análise de ensaios clínicos randomizados controlados com placebo sobre a prevalência de intolerância às estatinas. Am J Cardiol. 2017; 120: 774-781.
39. Zhang H, Plutzky J, Shubina M, Turchin A. Prescrições de estatinas continuadas após reações adversas e resultados do paciente: um estudo de coorte. Ann Intern Med. 2017; 167: 221-227.
40. Tomaszewski M, Stepien KM, Tomaszewska J, Czuczwar SJ. Miopatias induzidas por estatinas. Pharmacol Rep. 2011; 63: 859-866.
41. Stroes ES, Thompson PD, Corsini A, et al. Sintomas musculares associados às estatinas: impacto na terapia com estatinas – Declaração do Painel de Consenso da Sociedade Europeia de Aterosclerose sobre avaliação, etiologia e tratamento. Eur Heart J. 2015; 36: 1012-1022.
42. Gupta A, Thompson D, Whitehouse A, et al. Eventos adversos associados à terapia não cega, mas não cega, com estatina no Anglo-Scandinavian Cardiac Outcomes Trial – Lipid-Lowering Arm (ASCOT-LLA): um estudo randomizado duplo-cego controlado por placebo e sua extensão não-cega não randomizada fase. Lanceta. 2017; 389: 2473-2481.
43. Pedro-Botet J, Rubiés-Prat J. Sintomas musculares associados a estatinas: cuidado com o efeito nocebo. Lanceta. 2017; 389: 2445-2446.
44. Laufs U, Filipiak KJ, Gouni-Berthold I, et al. Aspectos práticos na gestão dos sintomas musculares associados às estatinas (SAMS). Atheroscler Suppl. 2017; 26: 45-55.
45. FDA Drug Safety Communication: novas restrições, contra-indicações e limitações de dose para Zocor (sinvastatina) para reduzir o risco de lesão muscular. www.fda.gov/Drugs/DrugSafety/ucm256581.htm. Acessado em 18 de março de 2018.
46.Banach M, Serban C, Sahebkar A, et al. Efeitos da coenzima Q10 na miopatia induzida por estatinas: uma meta-análise de ensaios clínicos randomizados. Mayo Clin Proc. 2015; 90: 24-34.
47. Goldberg AS, DeGorter MK, Ban MR, et al. Eficácia e concentrações plasmáticas do fármaco com dosagem não diária de rosuvastatina. Can J Cardiol. 2013; 29: 915-919.
48. Matalka MS, Ravnan MC, Deedwania PC. A dose diária alternativa de atorvastatina é eficaz no tratamento de pacientes com hiperlipidemia? Estudo de Dia Alternativo versus Dosagem Diária de Atorvastatina (ADDAS). Am Heart J. 2002; 144: 674-677.
49. Copher HR, Stewart RD. Dosagem diária versus dosagem em dias alternados de sinvastatina em pacientes com hipercolesterolemia. Farmacoterapia. 2002; 22: 1110-1116.
50. Rochlani Y, Kattoor AJ, Pothineni NV, et al. Equilibrando a prevenção primária e a prevenção do diabetes mellitus induzida por estatinas. Am J Cardiol. 2017; 120: 1122-1128.
51. Corrao G, Ibrahim B, Nicotra F, et al. Estatinas e o risco de diabetes: evidências de um grande estudo de coorte de base populacional. Diabetes Care. 2014; 37: 2225-2232.
52. Lim S, Oh PC, Sakuma I, Koh KK. Como equilibrar os benefícios cardiorenometabólicos e os riscos das estatinas. Aterosclerose. 2014; 235: 644-648.
53. Navarese EP, Buffon A, Andreotti F, et al. Meta-análise do impacto de diferentes tipos e doses de estatinas no diabetes mellitus de início recente. Am J Cardiol. 2013; 111: 1123-1130.
54. Crandall JP, Mather K., Rajpathak SN, et al. Uso de estatinas e risco de desenvolver diabetes: resultados do Programa de Prevenção de Diabetes. BMJ Open Diabetes Res Care. 2017; 5: e000438.
55. Ganda OP. Diabetes induzido por estatinas: incidência, mecanismos e implicações. F1000Res. 2016; 5.