Quando você vê a tabela periódica, o que vem à mente? As peças em um tabuleiro de scrabble? Talvez você pense sobre sua aula de química do ensino médio. Talvez você pense na mesa colorida colada na parede de uma sala de aula na faculdade. Talvez você se lembre de seu professor favorito colocando fogo em algo na frente da sala de aula. Eu sou um professor assistente de química na Universidade de Richmond e quando ouço a frase “a tabela periódica”, penso sobre a vida.
Eu penso sobre como as moléculas e substâncias químicas que nos cercam e ditam nosso dia a dia as atividades são compostas dos elementos dessa mesa – eles sustentam nossa vida, trazem beleza ao mundo e são vitais na medicina.
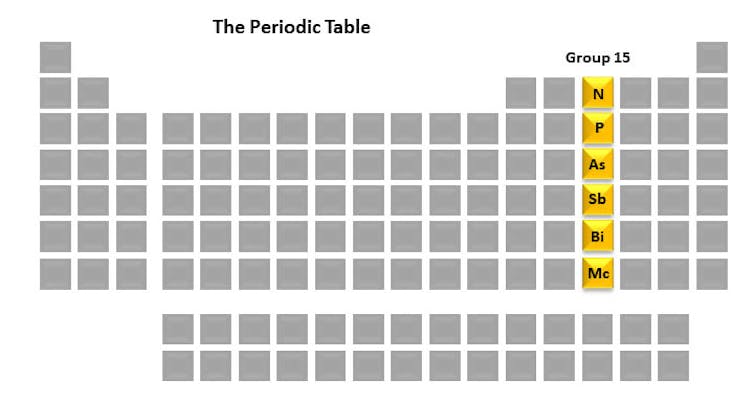
Cada coluna da tabela periódica é chamada de grupo. Cada membro do grupo tem um arranjo semelhante de elétrons que pode resultar em propriedades químicas semelhantes. O grupo 15 elementos – nitrogênio, fósforo, arsênio, antimônio, bismuto e moscópio – são interessantes para mim por causa de seu papel fundamental na vida, bem como no meu laboratório de pesquisa. Um elemento que estudamos é o fósforo por causa de seu papel integral no destino das células.
Mas antes de entrarmos nesses detalhes, vamos dar uma breve olhada em cada um dos 15 elementos do grupo. Eles são um conjunto único em sua história, usos e propriedades.
Grupo 15 – dando vida e causando morte
O nitrogênio (N) em sua forma atmosférica (N₂) compõe aproximadamente 78% do ar que respiramos. Quando as bactérias que vivem nas raízes das plantas o convertem em uma forma utilizável por meio de um processo chamado fixação de nitrogênio, essa forma elementar de nitrogênio é incorporada a muitos compostos necessários à vida – proteínas e DNA, por exemplo. Na parte inferior da coluna está Moscovium (Mc), o que é interessante porque ele realmente não existe na natureza. É um elemento radioativo que só pode ser gerado em um laboratório e sobrevive por menos de um segundo.
O arsênico (As) pode ser familiar para você por causa de sua associação com envenenamentos. Em 1494, Pico della Mirandola, um filósofo humanista italiano durante a Renascença, foi envenenado por arsênico, embora os detalhes de sua morte prematura ainda sejam debatidos. Por muito tempo, acreditou-se que Napoleão Bonaparte morreu de exposição ao arsênico em 1821, mas após extensas comparações de amostras de cabelo preservadas de diferentes estágios de sua vida, os pesquisadores concluíram que os níveis aumentados de arsênico eram provavelmente devido às técnicas de preservação da época. Mais recentemente, a Organização Mundial da Saúde estimou que a água potável contaminada com arsênico em Bangladesh resultou em mais de 9.000 mortes em 2001. Como o arsênico envenena e mata não é completamente compreendido, mas não há dúvida de que o elemento causa a destruição de órgãos vitais no ser humano corpo.

Quando o elemento antimônio (Sb) é combinado com três átomos de oxigênio para formar trióxido de antimônio, ele é amplamente utilizado como retardante de chamas em móveis e tapetes , cortinas, borracha, plásticos e adesivos. Quantidades dessa molécula nesses produtos domésticos tendem a ser muito pequenas e esses níveis de antimônio são considerados seguros.
O bismuto (Bi) é um metal encontrado na mesma linha da tabela periódica que vários metais tóxicos; no entanto, os compostos que contêm bismuto são inofensivos. Os compostos de bismuto podem ser encontrados em cosméticos devido ao seu brilho prateado distinto e desejável. Mesmo que você não tenha usado produtos de higiene pessoal contendo bismuto, provavelmente já o encontrou no conhecido antiácido Peptobismol®, que é usado para tratar dores de estômago, ou no quarto de julho, quando você está assistindo a fogos de artifício. É um composto de bismuto que causa os sons crepitantes dos fogos de artifício do ovo do dragão.
Por último, mas não menos importante, do grupo de 15 elementos é o fósforo (P). Foi descoberto em 1669 pelo alquimista Hennig Brandt e batizado com o nome da palavra grega “fósforo”, que significa portador de luz. Isso ocorre porque, quando a forma elemental interage com o oxigênio atmosférico, ela produz uma luz brilhante. Os químicos descobriram como aproveitar o poder de esta reação para o desenvolvimento de fósforos. A ponta vermelha de um fósforo ainda contém uma forma de fósforo hoje.
Fosfatos – regulando o destino das células cancerosas
Além das faíscas geradas pelo elemento , o fósforo é encontrado em um composto conhecido como fosfato: fósforo ligado a quatro átomos de oxigênio.Nas células, quando uma molécula de fosfato é ligada a uma proteína, ela pode ligar ou ativar a proteína para que possa desempenhar sua função na célula – como estimular o crescimento.
Quando o fosfato não está mais ligado à proteína, as células param de crescer. Você pode pensar nisso quase como os fósforos descritos acima – quando o fosfato está lá, o fósforo pode acender e os negócios podem prosseguir. Quando o fosfato é removido, o fósforo é apenas um palito e nenhuma luz é fornecida; não pode acontecer tanto trabalho no escuro.
Em células cancerosas, o status do fosfato está fora de controle. Imagine muitos fósforos acesos e uma sala muito iluminada que pode resultar em uma enxurrada de atividades. Essa atividade pode ter consequências graves para as células. Por exemplo, o crescimento e a migração desregulados podem levar ao câncer.
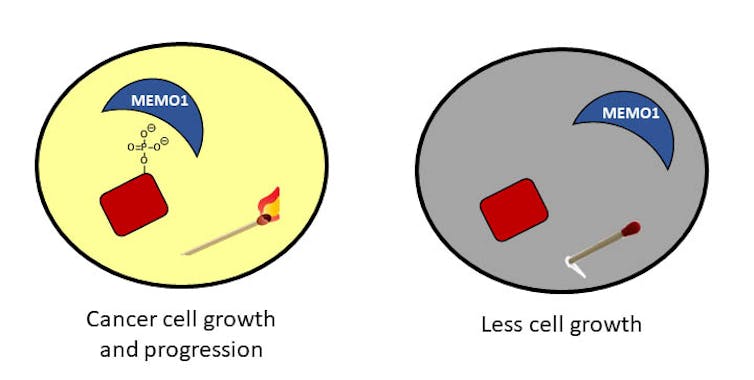
Em meu laboratório na Universidade de Richmond, estamos interessados em entender esses fosfatos e uma proteína em particular que interage com eles. Essa proteína, chamada MEMO1, é encontrada em grandes quantidades em pacientes com câncer de mama e ajuda os fosfatos a permanecerem sempre ligados às proteínas. Estamos tentando entender como o MEMO1 interage com esses fosfatos e desenvolvendo estratégias para interromper essas interações.
Esperamos que nosso trabalho revele uma maneira de ajudar a remover os fosfatos para interromper o crescimento desordenado das células – em outras palavras, explodir os fósforos.
Então, da próxima vez que você ouvir as palavras “tabela periódica”, por favor, pense na vida. Pense nas moléculas que você encontra a cada momento de todos os dias, pense no remédio que o mantém saudável e pense em nós que estamos trabalhando para entender como mantê-lo assim .