Redução da pressão do vapor
Conforme descrito no capítulo sobre líquidos e sólidos, a pressão de vapor de equilíbrio de um líquido é a pressão exercida por seu gás fase em que a vaporização e a condensação estão ocorrendo em taxas iguais:
\ text {liquid} \ rightleftharpoons \ text {gas}
Dissolvendo uma substância não volátil em um líquido volátil resulta na redução da pressão de vapor do líquido. Este fenômeno pode ser racionalizado considerando o efeito das moléculas de soluto adicionadas nos processos de vaporização e condensação do líquido. Para vaporizar, as moléculas de solvente devem estar presentes na superfície da solução. A presença de soluto diminui a área de superfície disponível para moléculas de solvente e, portanto, reduz a taxa de vaporização do solvente. Uma vez que a taxa de condensação não é afetada pela presença de soluto, o resultado líquido é que o equilíbrio de vaporização-condensação é alcançado com menos moléculas de solvente na fase de vapor (isto é, a uma pressão de vapor mais baixa) (Figura 1). Embora essa interpretação cinética seja útil, ela não leva em consideração vários aspectos importantes da natureza coligativa da redução da pressão de vapor. Uma explicação mais rigorosa envolve a propriedade da entropia, um tópico de discussão em um capítulo posterior do texto sobre termodinâmica. Para fins de compreensão da redução da pressão de vapor de um líquido, é adequado observar que a maior entropia de uma solução em comparação com seu solvente e soluto separados serve para estabilizar efetivamente as moléculas de solvente e impedir sua vaporização. O resultado é uma pressão de vapor mais baixa e um ponto de ebulição correspondentemente mais alto, conforme descrito na próxima seção deste módulo.
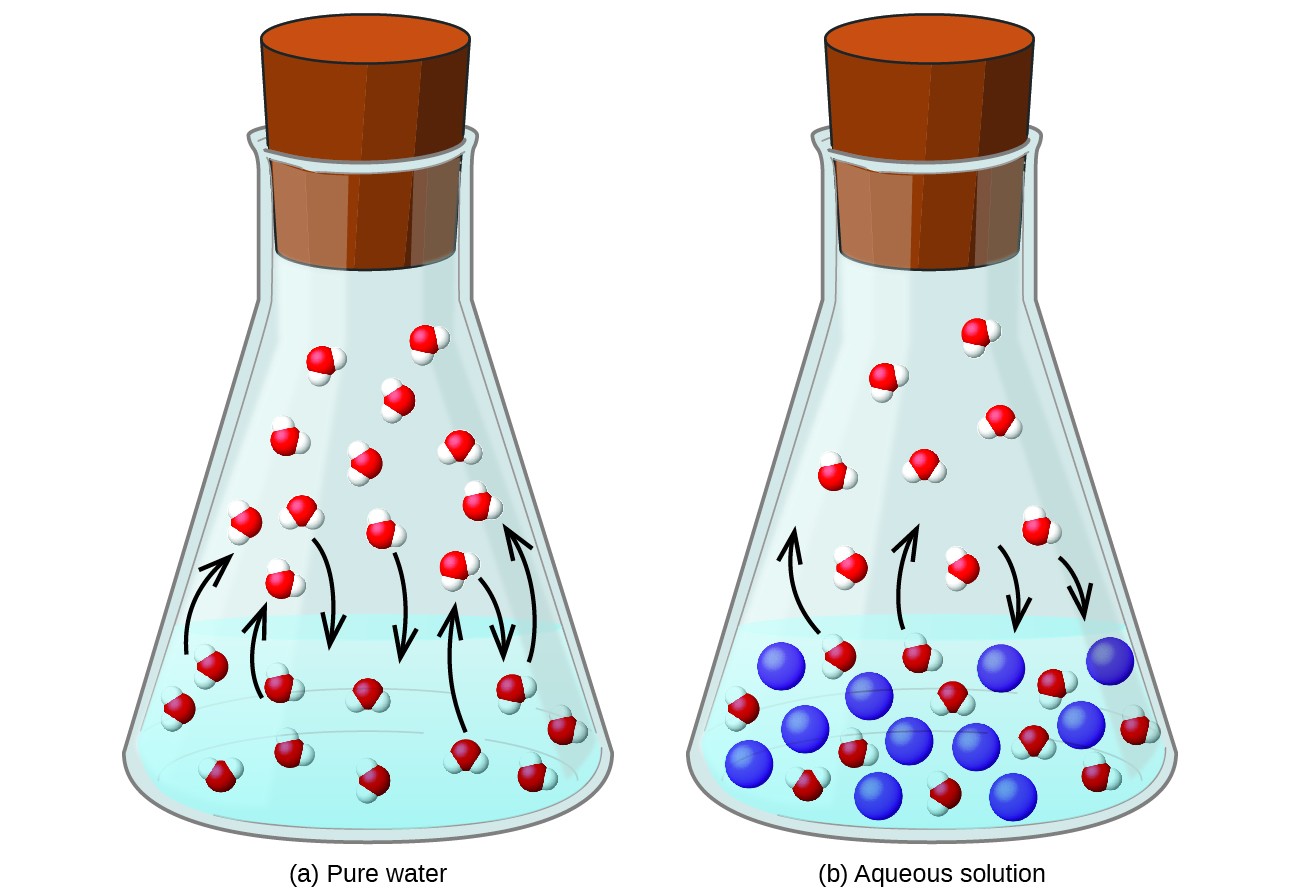
Figura 1. A presença de solutos não voláteis diminui a pressão de vapor de uma solução, impedindo a evaporação das moléculas do solvente.
A relação entre as pressões de vapor dos componentes da solução e as concentrações de esses componentes são descritos pela lei de Raoult: A pressão parcial exercida por qualquer componente de uma solução ideal é igual à pressão de vapor do componente puro multiplicada por sua fração molar na solução.
{P} _ {\ text {A}} = {X} _ {\ text {A}} {P} _ {\ text {A}} ^ {\ star}
Lembrando que a pressão total de uma mistura gasosa é igual à soma das pressões parciais de todos os seus componentes (lei das pressões parciais de Dalton), a pressão de vapor total exercida por uma solução contendo i componentes é
{ P} _ {\ text {solução}} = \ sum _ {i} {P} _ {i} = \ sum _ {i} {X} _ {i} {P} _ {i} ^ {\ estrela}
Uma substância não volátil é aquela cuja pressão de vapor é desprezível (P ^ {\ star} ≈ 0) e, portanto, a pressão de vapor acima de uma solução contendo apenas solutos não voláteis é devida apenas ao solvente:
{P} _ {\ text {solução}} = {X} _ {\ text {solvente}} {P} _ {\ text {solvente}} ^ {\ star}
Destilação de Soluções
A destilação é uma técnica de separação de componentes de misturas amplamente aplicada tanto em laboratório quanto em ambientes industriais. É usado para refinar o petróleo, isolar os produtos da fermentação e purificar a água. Esta técnica de separação envolve o aquecimento controlado de uma mistura de amostra para vaporizar, condensar e coletar seletivamente um ou mais componentes de interesse. Um aparelho típico para destilações em escala de laboratório é mostrado na Figura 2.

Figura 2. Um típico unidade de destilação de laboratório é mostrada em (a) uma fotografia e (b) um diagrama esquemático dos componentes. (crédito a: modificação do trabalho por “Rifleman82” / Wikimedia commons; crédito b: modificação do trabalho por “Slashme” / Wikipedia)
As refinarias de petróleo usam destilação fracionada em grande escala para separar o componentes do petróleo bruto. O óleo cru é aquecido a altas temperaturas na base de uma coluna alta de fracionamento, vaporizando muitos dos componentes que sobem dentro da coluna. À medida que os componentes vaporizados alcançam zonas frias de maneira adequada durante sua ascensão, eles se condensam e são coletados. Os líquidos coletados são misturas mais simples de hidrocarbonetos e outros compostos de petróleo que são de composição apropriada para várias aplicações (por exemplo, combustível diesel, querosene, gasolina), conforme ilustrado na Figura 3.

Figura 3. O petróleo bruto é uma mistura complexa que é separada por destilação fracionada em grande escala para isolar várias misturas mais simples.
Elevação do ponto de ebulição
Conforme descrito no capítulo sobre líquidos e sólidos, o ponto de ebulição de um líquido é a temperatura na qual sua pressão de vapor é igual à pressão atmosférica ambiente.Uma vez que a pressão de vapor de uma solução é reduzida devido à presença de solutos não voláteis, é lógico que o ponto de ebulição da solução será posteriormente aumentado. Em comparação com o solvente puro, uma solução, portanto, exigirá uma temperatura mais alta para atingir qualquer pressão de vapor dada, incluindo uma equivalente à da atmosfera circundante. O aumento no ponto de ebulição observado quando o soluto não volátil é dissolvido em um solvente, ΔTb, é chamado de elevação do ponto de ebulição e é diretamente proporcional à concentração molal das espécies de soluto:
\ Delta {T} _ {\ text {b}} = {K} _ {\ text {b}} m
onde Kb é a constante de elevação do ponto de ebulição, ou a constante ebullioscópica em é a concentração molal (molalidade) de todas as espécies de soluto.
As constantes de elevação do ponto de ebulição são propriedades características que dependem da identidade do solvente. Os valores de Kb para vários solventes estão listados na Tabela 1.
A extensão em que a pressão de vapor de um solvente é reduzida e o ponto de ebulição é elevado depende do número total de partículas de soluto presentes em uma determinada quantidade de solvente, não na massa ou tamanho ou identidades químicas das partículas. Uma solução aquosa de sacarose de 1 m (342 g / mol) e uma solução aquosa de etilenoglicol de 1 m (62 g / mol) exibirão o mesmo ponto de ebulição porque cada solução tem um mole de partículas de soluto (moléculas) por quilograma de solvente .
Exemplo 6: O ponto de ebulição de uma solução de iodo
Encontre o ponto de ebulição de uma solução de 92,1 g de iodo, I2, em 800,0 g de clorofórmio, CHCl3 , assumindo que o iodo é não volátil e que a solução é ideal.
Verifique seu aprendizado
Qual é o ponto de ebulição de uma solução de 1,0 g de glicerina, C3H5 (OH) 3, em 47,8 g de água? Considere uma solução ideal.
Depressão de ponto de congelamento

Figura 4. Sal-gema ( NaCl), cloreto de cálcio (CaCl2) ou uma mistura dos dois são usados para derreter o gelo. (crédito: modificação do trabalho de Eddie Welker)
As soluções congelam em temperaturas mais baixas do que os líquidos puros. Esse fenômeno é explorado em esquemas de “degelo” que usam sal (Figura 4), cloreto de cálcio ou ureia para derreter gelo em estradas e calçadas, e no uso de etilenoglicol como “anticongelante” em radiadores de automóveis. A água do mar congela a uma temperatura mais baixa do que a água doce e, portanto, os oceanos Ártico e Antártico permanecem descongelados mesmo em temperaturas abaixo de 0 ° C (assim como os fluidos corporais de peixes e outros animais marinhos de sangue frio que vivem nesses oceanos).
A diminuição do ponto de congelamento de uma solução diluída em comparação com o do solvente puro, ΔTf, é chamada de depressão do ponto de congelamento e é diretamente proporcional à concentração molal do soluto
\ Delta {T} _ {\ text {f}} = {K} _ {\ text {f}} m
onde m é a concentração molal do soluto em o solvente e o Kf são chamados de constante de depressão do ponto de congelamento (ou constante crioscópica). Assim como para as constantes de elevação do ponto de ebulição, essas são propriedades características cujos valores dependem da identidade química do solvente. Os valores de Kf para vários solventes estão listados na Tabela 1.
Propriedades coligativas e descongelamento
O cloreto de sódio e seus análogos do grupo 2 de cálcio e cloreto de magnésio são freqüentemente usados para descongelamento de estradas e calçadas, devido ao fato de que uma solução de qualquer um desses sais terá um ponto de congelamento inferior a 0 ° C, o ponto de congelamento da água pura. Os sais de metal do grupo 2 são frequentemente misturados com o cloreto de sódio mais barato e mais disponível (“sal-gema”) para uso em estradas, uma vez que tendem a ser um pouco menos corrosivos do que o NaCl, e fornecem uma depressão maior do ponto de congelamento , uma vez que eles se dissociam para produzir três partículas por unidade de fórmula, em vez de duas partículas como o cloreto de sódio.
Como esses compostos iônicos tendem a acelerar a corrosão do metal, eles não seriam uma escolha sábia para uso em anticongelante para o radiador do carro ou para descongelar um avião antes da decolagem.Para essas aplicações, compostos covalentes, como etileno ou propilenoglicol, são freqüentemente usados. Os glicóis usados no fluido do radiador não apenas reduzem o ponto de congelamento do líquido, mas também elevam o ponto de ebulição, tornando o fluido útil tanto no inverno quanto no verão. Glicóis aquecidos são frequentemente pulverizados na superfície dos aviões antes da decolagem em clima inclemente no inverno para remover o gelo que já se formou e evitar a formação de mais gelo, o que seria particularmente perigoso se formado nas superfícies de controle da aeronave (Figura 5).

Figura 5. A depressão do ponto de congelamento é explorada para remover o gelo das (a) estradas e (b) as superfícies de controle da aeronave.
Diagrama de fase para uma solução
Os efeitos coligativos na pressão de vapor, ponto de ebulição e ponto de congelamento descritos na seção anterior são convenientemente resumidos comparando os diagramas de fase para um líquido puro e uma solução derivada desse líquido. Os diagramas de fase para água e uma solução aquosa são mostrados na Figura 6.
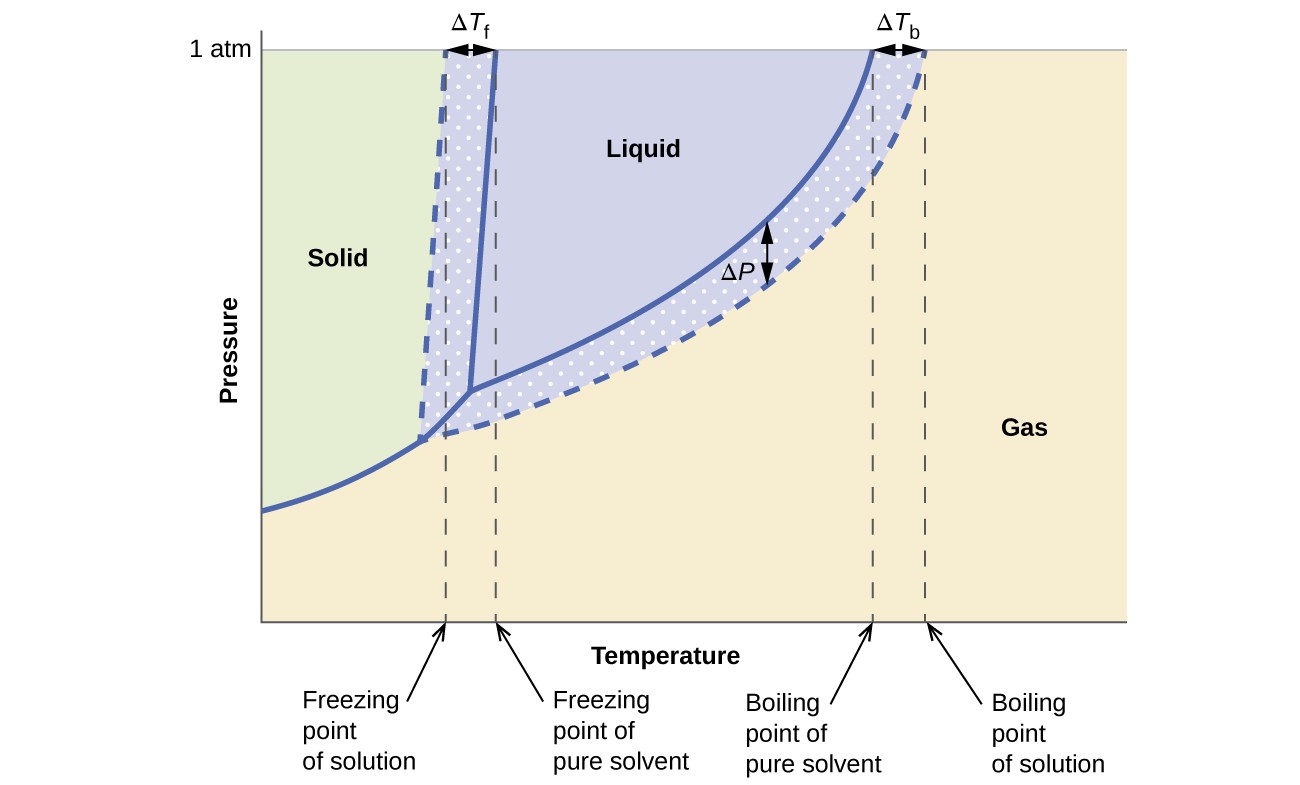
Figura 6. Estas fases os diagramas mostram água (curvas sólidas) e uma solução aquosa de não eletrólito (curvas tracejadas).
A curva líquido-vapor para a solução está localizada abaixo da curva correspondente para o solvente, representando o vapor redução da pressão, ΔP, que resulta da dissolução do soluto não volátil. Consequentemente, a qualquer pressão dada, o ponto de ebulição da solução é observado a uma temperatura mais elevada do que para o solvente puro, refletindo a elevação do ponto de ebulição, ΔTb, associada à presença de soluto não volátil. A curva sólido-líquido para a solução é deslocada para a esquerda daquela do solvente puro, representando a depressão do ponto de congelamento, ΔTb, que acompanha a formação da solução. Finalmente, observe que as curvas sólido-gás para o solvente e sua solução são idênticas. Esse é o caso de muitas soluções que compreendem solventes líquidos e solutos não voláteis. Assim como na vaporização, quando uma solução desse tipo é congelada, na verdade são apenas as moléculas do solvente que passam pela transição líquido-sólido, formando um solvente sólido puro que exclui as espécies de soluto. As fases sólida e gasosa, portanto, são compostas apenas de solvente e, portanto, as transições entre essas fases não estão sujeitas a efeitos coligativos.
Osmose e pressão osmótica de soluções
Vários naturais e os materiais sintéticos exibem permeação seletiva, o que significa que apenas moléculas ou íons de um determinado tamanho, forma, polaridade, carga e assim por diante são capazes de passar (permear) o material. As membranas celulares biológicas fornecem exemplos elegantes de permeação seletiva na natureza, enquanto o tubo de diálise usado para remover resíduos metabólicos do sangue é um exemplo tecnológico mais simplista. Independentemente de como eles podem ser fabricados, esses materiais são geralmente referidos como membranas semipermeáveis.
Considere o aparelho ilustrado na Figura 7, no qual amostras de solvente puro e uma solução são separadas por uma membrana que contém apenas o solvente as moléculas podem permear. As moléculas de solvente irão se difundir através da membrana em ambas as direções. Como a concentração de solvente é maior no solvente puro do que na solução, essas moléculas se difundirão do lado do solvente da membrana para o lado da solução a uma taxa mais rápida do que na direção reversa. O resultado é uma transferência líquida de moléculas de solvente do solvente puro para a solução. A transferência por difusão de moléculas de solvente através de uma membrana semipermeável é um processo conhecido como osmose.
Figura 7. (a) Uma solução e solvente puro são inicialmente separados por uma membrana osmótica. (b) A transferência líquida de moléculas de solvente para a solução ocorre até que sua pressão osmótica produza taxas iguais de transferência em ambas as direções.
Quando a osmose é realizada em um aparelho como o mostrado na Figura 7 , o volume da solução aumenta à medida que se dilui pelo acúmulo de solvente. Isso faz com que o nível da solução aumente, aumentando sua pressão hidrostática (devido ao peso da coluna de solução no tubo) e resultando em uma transferência mais rápida das moléculas de solvente de volta para o lado do solvente puro. Quando a pressão atinge um valor que produz uma taxa de transferência reversa de solvente igual à taxa de osmose, a transferência em massa de solvente cessa. Essa pressão é chamada de pressão osmótica (Π) da solução. A pressão osmótica de uma solução diluída está relacionada à sua molaridade do soluto, M, e à temperatura absoluta, T, de acordo com a equação
\ Pi = MRT
onde R é a constante universal do gás.
Se uma solução for colocada em um aparelho como o mostrado na Figura 8, a aplicação de pressão maior do que a pressão osmótica da solução inverte a osmose e empurra as moléculas de solvente da solução para o solvente puro. Esta técnica de osmose reversa é usada para dessalinização em grande escala da água do mar e em escalas menores para produzir água de torneira de alta pureza para beber.
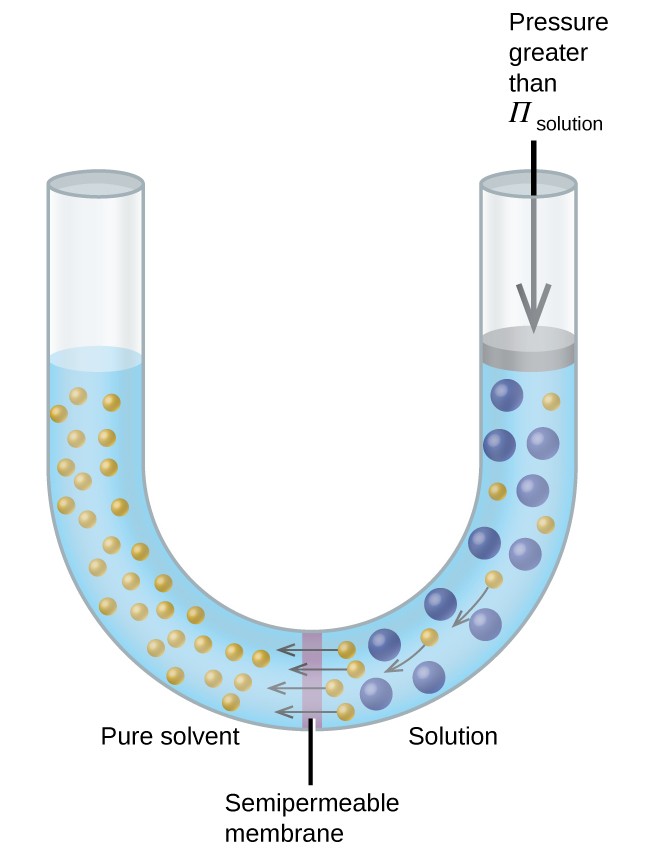
Figura 8. Aplicar uma pressão maior que a pressão osmótica de uma solução reverterá a osmose. As moléculas de solvente da solução são empurradas para o solvente puro.
Purificação de água por osmose reversa
No processo de osmose, a difusão serve para mover a água através de um membrana semipermeável de uma solução menos concentrada para uma solução mais concentrada. A pressão osmótica é a quantidade de pressão que deve ser aplicada à solução mais concentrada para causar a interrupção da osmose. Se maior pressão for aplicada, a água irá da solução mais concentrada para uma solução menos concentrada (mais pura). Isso é chamado de osmose reversa. A osmose reversa (RO) é usada para purificar a água em muitas aplicações, desde usinas de dessalinização em cidades costeiras a máquinas de purificação de água em supermercados (Figura 9) e unidades domésticas menores de osmose reversa. Com uma bomba operada manualmente, pequenas unidades de RO podem ser usadas em países do terceiro mundo, áreas de desastre e em botes salva-vidas. Nossas forças militares têm uma variedade de unidades RO operadas por gerador que podem ser transportadas em veículos para locais remotos.

Figura 9. Os sistemas de osmose reversa para purificar a água potável são mostrados aqui em (a) escalas pequenas e (b) grandes. (crédito a: modificação do trabalho de Jerry Kirkhart; crédito b: modificação do trabalho de Willard J. Lathrop)
Exemplos de osmose são evidentes em muitos sistemas biológicos porque as células são rodeado por membranas semipermeáveis. Cenouras e aipo que ficaram moles porque perderam água podem ficar crocantes novamente, colocando-os na água. A água passa para as células da cenoura ou do aipo por osmose. Um pepino colocado em uma solução concentrada de sal perde água por osmose e absorve um pouco de sal para se tornar um picles. A osmose também pode afetar células animais. As concentrações de solutos são particularmente importantes quando as soluções são injetadas no corpo. Os solutos nos fluidos das células corporais e no soro sanguíneo fornecem a essas soluções uma pressão osmótica de aproximadamente 7,7 atm. As soluções injetadas no corpo devem ter a mesma pressão osmótica do soro sanguíneo; ou seja, eles devem ser isotônicos com o soro sanguíneo. Se uma solução menos concentrada, uma solução hipotônica, é injetada em quantidade suficiente para diluir o soro sanguíneo, a água do soro diluído passa para as células sanguíneas por osmose, fazendo com que as células se expandam e se rompam. Este processo é denominado hemólise. Quando uma solução mais concentrada, uma solução hipertônica, é injetada, as células perdem água para a solução mais concentrada, murcham e possivelmente morrem em um processo chamado crenação. Esses efeitos são ilustrados na Figura 10.
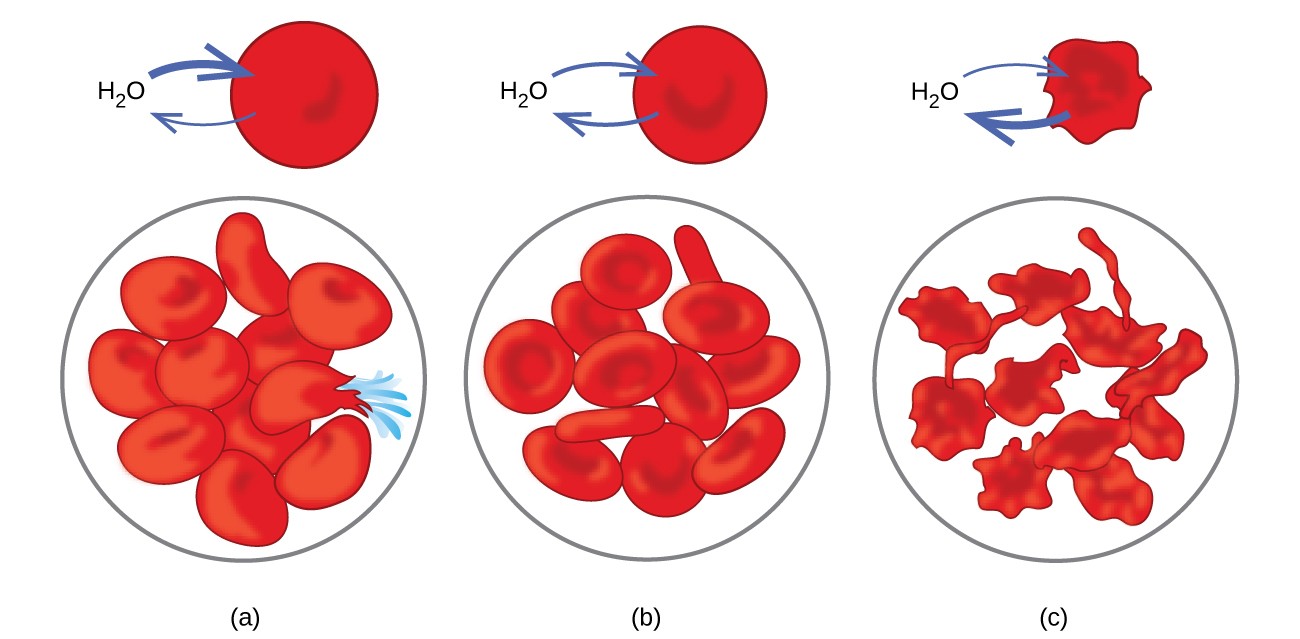
Figura 10. As membranas dos glóbulos vermelhos são permeáveis à água e irá (a) inchar e possivelmente romper em uma solução hipotônica; (b) manter o volume e a forma normais em uma solução isotônica; e (c) murchar e possivelmente morrer em uma solução hipertônica. (crédito a / b / c: modificações no trabalho de “LadyofHats” / Wikimedia commons)
Determinação das massas molares
Pressão osmótica e mudanças no ponto de congelamento, ebulição ponto, e a pressão de vapor são diretamente proporcionais à concentração de soluto presente. Consequentemente, podemos usar a medição de uma dessas propriedades para determinar a massa molar do soluto a partir das medições.
Propriedades coligativas dos eletrólitos
Conforme observado anteriormente neste módulo, as propriedades coligativas de uma solução dependem apenas do número, não da identidade, de espécies de soluto dissolvidas. Os termos de concentração nas equações para várias propriedades coligativas (depressão do ponto de congelamento , elevação do ponto de ebulição, pressão osmótica) referem-se a todas as espécies de soluto presentes na solução. Para as soluções consideradas até agora neste capítulo, os solutos têm sido não eletrólitos que se dissolvem fisicamente sem dissociação ou qualquer outro processo associado. Cada molécula o que se dissolve produz uma molécula de soluto dissolvida. A dissolução de um eletrólito, no entanto, não é tão simples, como ilustrado pelos dois exemplos comuns abaixo:
Considerando o primeiro desses exemplos, e assumindo a dissociação completa, uma solução aquosa de NaCl 1,0 m contém 2,0 moles de íons (1,0 mol Na + e 1.0 mol Cl−) por cada quilograma de água, e espera-se que a depressão do seu ponto de congelamento seja
Quando esta solução é realmente preparada e seu ponto de congelamento é medido, entretanto, um valor de 3,4 ° C é obtido. Discrepâncias semelhantes são observadas para outros compostos iônicos, e as diferenças entre os valores de propriedade coligativa medidos e esperados normalmente se tornam mais significativas à medida que as concentrações de soluto aumentam. Estas observações sugerem que os íons de cloreto de sódio (e outros eletrólitos fortes) não estão completamente dissociados em solução.
Para explicar isso e evitar os erros que acompanham a suposição de dissociação total, um parâmetro medido experimentalmente denominado em homenagem ao químico alemão vencedor do Prêmio Nobel Jacobus Henricus van’t Hoff. O fator de van’t Hoff (i) é definido como a razão entre as partículas de soluto em solução e o número de unidades da fórmula dissolvidas:
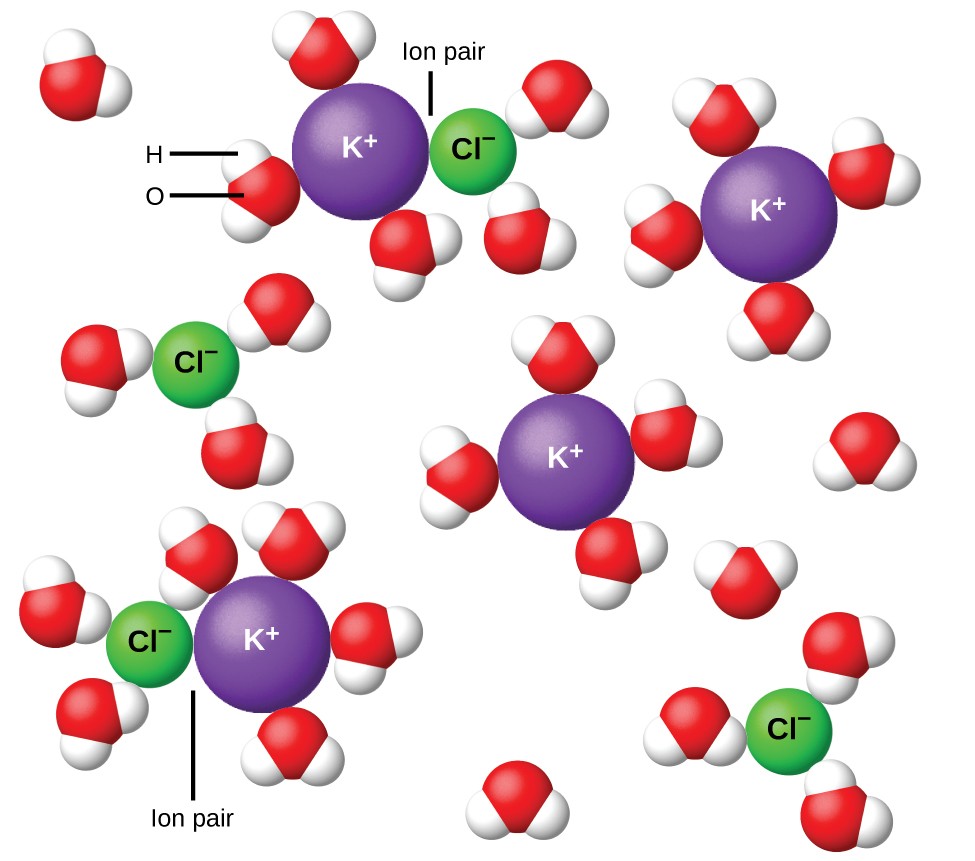
Figura 11. Os íons tornam-se cada vez mais separados quanto mais diluída a solução, e as atrações interiônicas residuais diminuem.
Em 1923, os químicos Peter Debye e Erich Hückel propuseram uma teoria para explicar a aparente ionização incompleta de eletrólitos fortes. Eles sugeriram que embora a atração interiônica em uma solução aquosa seja grandemente reduzida pela solvatação dos íons e pela ação isolante do solvente polar, ela não é completamente anulada. As atrações residuais impedem que os íons se comportem como partículas totalmente independentes (Figura 11). Em alguns casos, um íon positivo e um íon negativo podem realmente se tocar, dando uma unidade solvatada chamada de par iônico. Assim, a atividade, ou a concentração efetiva, de qualquer tipo particular de íon é menor do que a indicada pela concentração real. Os íons tornam-se cada vez mais separados quanto mais diluída a solução, e as atrações interiônicas residuais tornam-se cada vez menores. Assim, em soluções extremamente diluídas, as concentrações efetivas dos íons (suas atividades) são essencialmente iguais às concentrações reais. Observe que os fatores de van’t Hoff para os eletrólitos na Tabela 2 são para soluções de 0,05 m, em cuja concentração o valor de i para NaCl é 1,9, em oposição a um valor ideal de 2.
Exemplo 11: O ponto de congelamento de uma solução de um eletrólito
A concentração de íons na água do mar é aproximadamente a mesma que em uma solução contendo 4,2 g de NaCl dissolvido em 125 g de água. Suponha que cada um dos íons na solução de NaCl tenha o mesmo efeito no ponto de congelamento da água que uma molécula não eletrolítica e determine a temperatura de congelamento da solução (que é aproximadamente igual à temperatura de congelamento da água do mar).
Verifique seu aprendizado
Suponha que cada um dos íons no cloreto de cálcio, CaCl2, tem o mesmo efeito no ponto de congelamento da água que uma molécula não eletrolítica. Calcule o ponto de congelamento de uma solução de 0,724 g de CaCl2 em 175 g de água.
Experimente
- A carne pode ser classificada como fresca (não congelada), embora seja armazenada a -1 ° C. Por que a carne não congelaria nessa temperatura?
- Um composto orgânico tem uma composição de 93,46% C e 6,54% H em massa. Uma solução de 0,090 g deste composto em 1,10 g de cânfora funde a 158,4 ° C. O ponto de fusão da cânfora pura é de 178,4 ° C. Kf para cânfora é 37,7 ° C / m. Qual é a fórmula molecular do soluto? Mostre seus cálculos.
- Um sal é conhecido por ser um fluoreto de metal alcalino. Uma rápida determinação aproximada do ponto de congelamento indica que 4 g do sal dissolvido em 100 g de água produz uma solução que congela a cerca de -1,4 ° C. Qual é a fórmula do sal? Mostre seus cálculos.
Glossário
atividade: concentração efetiva de íons na solução; é menor do que a concentração real, devido às interações iônicas.
elevação do ponto de ebulição: elevação do ponto de ebulição de um líquido pela adição de um soluto
constante de elevação do ponto de ebulição: o constante de proporcionalidade na equação que relaciona a elevação do ponto de ebulição à molalidade do soluto; também conhecida como constante ebulioscópica
propriedade coligativa: propriedade de uma solução que depende apenas da concentração de uma espécie de soluto
crenação: processo pelo qual as células biológicas encolhem devido à perda de água por osmose
depressão do ponto de congelamento: redução do ponto de congelamento de um líquido pela adição de um soluto
constante de depressão do ponto de congelamento: (também, constante crioscópica) constante de proporcionalidade na equação relacionada depressão do ponto de congelamento à molalidade do soluto
hemólise: ruptura das hemácias devido ao acúmulo de excesso de água por osmose
hipertônica: de maior pressão osmótica
hipotônica : de menor pressão osmótica
par iônico: par ânion / cátion solvatado mantido junto por atração eletrostática moderada
isotônico: de pressão osmótica igual
molalidade (m) : uma unidade de concentração definida como a razão entre o número de moles de soluto e a massa do solvente em quilogramas
fração molar (X): a relação entre a quantidade molar de um componente da solução e o número total de moles de todos os componentes da solução
osmose: difusão das moléculas do solvente através de uma membrana semipermeável
pressão osmótica (Π ): pressão oposta necessária para evitar a transferência em massa de moléculas de solvente através de uma membrana semipermeável
Lei de Raoult: a pressão parcial exercida por um componente da solução é igual ao produto da fração molar do componente na solução e seu equilíbrio pressão de vapor no estado puro
membrana semipermeável: uma membrana que permite seletivamente a passagem de certos íons ou moléculas
fator de van’t Hoff (i): a razão do número de moles de partículas em uma solução para o número de moles de unidades da fórmula dissolvidas na solução
- Um não eletrólito mostrado para comparação. ↵

