Inflamação intravascular maligna
A sepse tem sido referida como um processo de inflamação intravascular maligna . Normalmente, uma cascata imunológica potente e complexa garante uma resposta protetora imediata à invasão de microorganismos em humanos. Uma defesa imunológica deficiente pode permitir que a infecção se estabeleça; no entanto, uma resposta excessiva ou mal regulada pode prejudicar o hospedeiro por meio da liberação inadequada de compostos inflamatórios gerados localmente (veja a imagem abaixo).
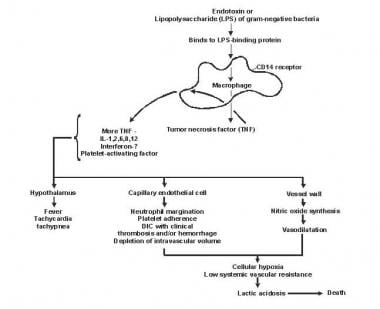 Patogênese da sepse e falência de múltiplos órgãos.
Patogênese da sepse e falência de múltiplos órgãos. O lipídio A e outros produtos bacterianos liberam citocinas e outros moduladores imunológicos que medeiam as manifestações clínicas da sepse. Interleucinas, fator de necrose tumoral (TNF) -α, interferon gama (IFN-γ) e outros fatores estimuladores de colônias são produzidos rapidamente em minutos ou horas após interações de monócitos e macrófagos com lipídeo A.
A liberação do mediador inflamatório torna-se um processo autoestimulante e a liberação de outros mediadores, incluindo interleucina (IL) -1, fator de ativação plaquetária, IL-2, IL-6, IL-8, IL-10 e óxido nítrico (NO), aumenta ainda mais os níveis de citocinas. Isso leva à ativação contínua de leucócitos polimorfonucleares (PMNs), macrófagos e linfócitos; mediadores pró-inflamatórios recrutam mais dessas células. Todos esses processos criam um estado de dissonância imunológica destrutiva.
A sepse é descrita como um processo autodestrutivo que permite a extensão da resposta fisiopatológica normal à infecção para envolver tecidos e resultados normais de outra forma em MODS. Disfunção orgânica ou falência orgânica pode ser o primeiro sinal clínico de sepse, e nenhum sistema orgânico está imune às consequências dos excessos inflamatórios da sepse. A mortalidade aumenta à medida que aumenta a falência de órgãos.
Embora não controlado, uma vez que o MODS desenvolve evidências sistêmicas de regulação positiva pró-inflamatória e antiinflamatória, geralmente estão presentes, sugerindo que a falha na homeostase da defesa do hospedeiro é o caminho final da sepse para MODS, em vez de simples lesão de órgão-alvo induzida por hipotensão, como pode ocorrer com choque hemorrágico. A sobrevivência da sepse grave com MODS está geralmente associada a uma redução generalizada na resposta pró-inflamatória e antiinflamatória.
Recentemente, surgiu uma nova hipótese de que a sobrevivência na sepse grave requer um regulação descendente generalizada da resposta imunológica do corpo, funções energéticas e desempenho de órgãos associados. Assim, MODS pode pela resposta adaptativa do hospedeiro à inflamação esmagadora, permitindo que a inflamação seja eliminada sem causar dano permanente ao órgão-alvo. Conforme discutido abaixo, todos os órgãos revelam uma hiporresponsividade generalizada que é claramente anormal para a saúde, mas pode marcar uma estratégia de sobrevivência na sepse grave.
Disfunção dos sistemas orgânicos
Distúrbio circulatório
Distúrbio significativo na autorregulação da circulação é típico da sepse. Os mediadores vasoativos causam vasodilatação e aumentam a permeabilidade microvascular no local da infecção. O NO desempenha um papel central na vasodilatação do choque séptico. Além disso, pode ocorrer diminuição da secreção de vasopressina, o que pode permitir a persistência da vasodilatação.
Alterações no desempenho ventricular sistólico e diastólico ocorrem na sepse. Com o uso do mecanismo de Frank-Starling, o débito cardíaco geralmente é aumentado para manter a pressão arterial na presença de vasodilatação sistêmica. Pacientes com doença cardíaca preexistente são incapazes de aumentar seu débito cardíaco de forma adequada.
Regionalmente, a sepse interfere na distribuição normal do fluxo sanguíneo sistêmico para os sistemas orgânicos. Consequentemente, os órgãos centrais podem não receber o fornecimento de oxigênio adequado, e o resultado é o que é conhecido como hipoperfusão regional.
A microcirculação é o principal órgão-alvo para lesões na sepse, pois o endotélio vascular é afetado universalmente pelos mediadores inflamatórios circulantes. Embora não esteja claro se as anormalidades microcirculatórias são a causa ou um observador inocente da lesão no órgão-alvo, uma disfunção microvascular clara é observada. É observada uma diminuição no número de capilares perfundidos, embora com a aplicação de terapias vasodilatadoras ocorra o recrutamento microvascular completo. A disfunção mitocondrial também ocorre e está frequentemente associada a gradientes de potencial transmembrana mitocondrial reduzidos, que são necessários para conduzir a fosforilação oxidativa. O resultado final é uma aparente incapacidade dos órgãos finais de extrair o oxigênio ao máximo.
O debate continua se esta falha do metabolismo energético é um mecanismo citoprotetor adaptativo semelhante à hibernação ou reflete a patologia mitocondrial primária. Essas são áreas de pesquisa ativa, mas atualmente não se traduzem em diretrizes claras de prática clínica. O aumento da permeabilidade endotelial capilar leva a um edema de tecido rico em proteínas generalizado.
O choque séptico e a SIRS são caracterizados por depressão miocárdica reversível, que pode ser resistente à catecolamina e à administração de fluidos. A circulação do “fator depressor do miocárdio” – provavelmente representando os efeitos sinérgicos de TNF-α, IL-1β, outras citocinas e NO – está implicada na patogênese. As duas características dessa depressão miocárdica de estresse agudo são capacidade de resposta adrenérgica prejudicada e disfunção diastólica levando a resistência relativa às catecolaminas e corações pequenos, em vez de dilatados. A isquemia miocárdica macrovascular e a hipoperfusão são contribuintes improváveis.
Na sepse grave e choque séptico, disfunção microcirculatória e depressão mitocondrial causam angústia do tecido regional, e a disoxia regional, portanto, persiste. Esta condição é denominada síndrome do desconforto microcirculatório e mitocondrial (MMDS). A disfunção autorregulatória inflamatória induzida pela sepse persiste e a necessidade de oxigênio não é correspondida pelo suprimento, levando a MODS.
Redistribuição do volume de fluido intravascular resultante da redução do tônus vascular arterial, diminuição do retorno venoso da di lação e liberação de substâncias depressoras do miocárdio causa hipotensão.
Disfunção pulmonar
Lesão endotelial na vasculatura pulmonar leva a distúrbios fluxo sanguíneo capilar e permeabilidade microvascular aumentada, resultando em edema intersticial e alveolar. O aprisionamento de neutrófilos na microcirculação pulmonar inicia e amplifica o dano às membranas capilares alveolares. A lesão pulmonar aguda e a síndrome do desconforto respiratório agudo (SDRA) são manifestações frequentes desses efeitos. Na verdade, sepse e pneumonia são as causas mais comuns de SDRA.
Disfunção gastrointestinal
O trato gastrointestinal (GI) pode ajudam a propagar as lesões da sepse. O crescimento excessivo de bactérias no trato gastrointestinal superior pode ser aspirado para os pulmões, produzindo pneumonia nosocomial ou por aspiração. A função de barreira normal do intestino pode ser afetada, permitindo a translocação de bactérias, endotoxinas e proteases digestivas normais para a circulação sistêmica e estendendo a resposta séptica.
O choque séptico pode causar íleo paralítico que pode levar a um atraso na instituição da alimentação enteral. O excesso de produção de NO é considerado o agente causador do íleo induzido por sepse. O nível ideal de ingestão nutricional sofre interferência em face das altas necessidades de proteínas e calorias. Narcóticos e relaxantes musculares podem piorar ainda mais a motilidade do trato gastrointestinal.
Disfunção hepática
Como consequência do papel que o fígado desempenha na defesa do hospedeiro, as funções sintéticas anormais causadas pela disfunção hepática podem contribuir tanto para o início quanto para a progressão da sepse. O sistema reticuloendotelial do fígado atua como uma primeira linha de defesa na eliminação de bactérias e seus produtos; disfunção hepática leva a um transbordamento desses produtos para a circulação sistêmica.
A insuficiência hepática (“fígado em choque”) pode ser manifestada por elevações nas enzimas hepáticas e bilirrubina, defeitos de coagulação e falha em excretar toxinas como a amônia, que levam ao agravamento da encefalopatia.
Disfunção renal
Lesão renal aguda (IRA) frequentemente acompanha a sepse. Diferentes etiologias para IRA foram relatadas, e a causa é geralmente considerada multifatorial. O mecanismo de IRA é complexo, mas provavelmente envolve uma diminuição no volume intravascular efetivo resultante de hipotensão sistêmica, vasoconstrição renal direta, liberação de citocinas, e ativação de neutrófilos por endotoxinas e outros peptídeos, que contribuem para a lesão renal. Ainda assim, a maioria dos estudos em animais mostra que o fluxo sanguíneo renal é aumentado, e não diminuído, na sepse, embora associado a função tubular prejudicada e falta de evidência histológica significativa de tu lesão bular.
Disfunção do sistema nervoso central
O envolvimento do sistema nervoso central (SNC) na sepse produz encefalopatia e periferia neuropatia. A patogênese é mal definida, mas provavelmente está relacionada à hipotensão sistêmica, que pode levar à hipoperfusão cerebral.
Coagulopatia
Coagulopatia subclínica, sinalizada por uma elevação leve do tempo de trombina (TT) ou tempo de tromboplastina parcial ativada (aPTT) ou uma redução moderada em a contagem de plaquetas é extremamente comum; entretanto, a coagulação intravascular disseminada (DIC) também pode se desenvolver. Receptores ativados por protease (PARs), especialmente PAR 1, formam a ligação molecular entre a coagulação e a inflamação; PAR1 exerce efeitos citoprotetores quando estimulado por proteína C ativada ou trombina em baixa dose, mas exerce efeitos disruptivos na função de barreira das células endoteliais quando ativado por trombina em alta dose.
Mecanismos de disfunção e lesão de órgãos
Os mecanismos precisos de lesão de células e disfunção de órgão resultante na sepse não são totalmente compreendidos. MODS está associado a lesão generalizada de células endoteliais e parenquimatosas, algumas das quais podem ser explicadas pelos seguintes 4 mecanismos propostos.
Hipóxia hipóxica
A lesão circulatória séptica interrompe a oxigenação dos tecidos, altera a regulação metabólica da distribuição de oxigênio aos tecidos e contribui para a disfunção orgânica. As anormalidades microvasculares e endoteliais contribuem para o defeito microcirculatório séptico na sepse. As espécies reativas de oxigênio, enzimas líticas e substâncias vasoativas (por exemplo, NO e fatores de crescimento endotelial) levam à lesão microcirculatória, que é agravada pela incapacidade dos eritrócitos de navegar pela microcirculação séptica.
Citotoxicidade direta
Endotoxina, TNF-α e NO podem causar danos ao transporte de elétrons mitocondrial, levando a um metabolismo energético desordenado. Isso é chamado de anoxia citopática ou histotóxica, uma incapacidade de utilizar oxigênio mesmo quando ele está presente.
Apoptose
Apoptose ( morte celular programada) é o principal mecanismo pelo qual as células disfuncionais são normalmente eliminadas. As citocinas pró-inflamatórias podem atrasar a apoptose em macrófagos e neutrófilos ativados, mas outros tecidos (por exemplo, epitélio intestinal) podem sofrer apoptose acelerada. Portanto, o distúrbio da apoptose desempenha um papel crítico na lesão tecidual da sepse.
Imunossupressão
A interação entre pró-inflamatório e mediadores antiinflamatórios podem levar a um desequilíbrio entre eles. Uma reação inflamatória ou imunodeficiência pode predominar, ou ambas podem estar presentes.
Resposta do hospedeiro e outros fatores que influenciam o resultado
Características clínicas relacionadas à gravidade de sepse incluem a resposta do hospedeiro à infecção, o local e tipo de infecção, o momento e o tipo de terapia antimicrobiana, o organismo agressor, o desenvolvimento de choque, a doença subjacente, a condição de saúde de longo prazo do paciente e o número de órgãos. Fatores que levam à sepse e choque séptico podem não ser essenciais para determinar o resultado final.
A resposta do hospedeiro à sepse é caracterizada por respostas pró-inflamatórias e imunossupressoras anti-inflamatórias. A direção, extensão e duração dessas reações são determinadas por fatores do hospedeiro (por exemplo, características genéticas, idade, doenças coexistentes, medicamentos) e fatores patogênicos (por exemplo, carga microbiana, virulência).
As respostas inflamatórias são iniciadas pela interação entre padrões moleculares associados a patógenos expressos por patógenos e receptores de reconhecimento de padrões expressos por células hospedeiras na superfície celular (receptores toll-like e tipo C receptores de lectina), no endossomo (TLRs) ou no citoplasma (receptores semelhantes ao gene 1 indutíveis pelo ácido retinóico e receptores semelhantes ao domínio de oligomerização de ligação a nucleotídeos).
A consequência da inflamação exagerada é o dano ao tecido colateral e a morte celular necrótica, que resulta na liberação de padrões moleculares associados ao dano, as chamadas moléculas de perigo que perpetuam a inflamação pelo menos em parte, agindo nos mesmos receptores de reconhecimento de padrões acionados por patógenos.