Obiective de învățare
- Enunțați ecuația undei de Broglie.
- Utilizați această ecuație pentru a calcula lungimea de undă a unui obiect în mișcare.
Dincolo de modelul lui Bohr
Modelul lui Bohr al atomului a fost valoros în demonstrarea modului în care electronii au fost capabili să absoarbă și să elibereze energie și cum au fost create spectrele de emisie atomică. Cu toate acestea, modelul nu a explicat cu adevărat de ce electronii ar trebui să existe doar pe orbite circulare fixe, mai degrabă decât să poată exista într-un număr nelimitat de orbite, toate cu energii diferite. Pentru a explica de ce stările energiei atomice sunt cuantificate, oamenii de știință au trebuit să regândească modul în care au privit natura electronului și mișcarea acestuia.
Investigația lui Planck asupra spectrelor de emisie ale obiectelor fierbinți iar studiile ulterioare asupra efectului fotoelectric au dovedit că lumina era capabilă să se comporte atât ca undă, cât și ca particulă. Părea rezonabil să ne întrebăm dacă electronii ar putea avea, de asemenea, o natură dual-undă-particulă. În 1924, omul de știință francez Louis de Broglie (1892–1987) a derivat o ecuație care descria natura undelor oricărei particule. În special, lungimea de undă (λ) a oricărui obiect în mișcare este dată de:
\ displaystyle \ lambda = \ frac {h} {mv}
În această ecuație, h este constanta lui Planck , m este masa particulei în kg, iar v este viteza particulei în m / s. Problema de mai jos arată cum să calculăm lungimea de undă a electronului.
Dacă ar fi să calculăm lungimea de undă a unui baseball de 0,125 kg aruncat la o viteză de 40 m / s, am avea o extremă scurtă lungimea de undă de ordinul 10−34 m. Această lungime de undă este imposibil de detectat chiar și cu echipamente științifice avansate. Într-adevăr, în timp ce toate obiectele se mișcă cu mișcare asemănătoare undelor, nu o observăm niciodată, deoarece lungimile de undă sunt mult prea scurte. Pe de altă parte, particulele cu lungimi de undă măsurabile sunt toate foarte mici. Cu toate acestea, natura undelor electronului s-a dovedit a fi o dezvoltare cheie într-o nouă înțelegere a naturii electronului. Un electron care este limitat la un anumit spațiu din jurul nucleului unui atom se poate deplasa numai în jurul acelui atom în așa fel încât unda sa de electroni „să se potrivească” corect cu dimensiunea atomului. Aceasta înseamnă că frecvențele undelor de electroni sunt cuantificate. Pe baza ecuației E = hv, frecvențele cuantificate înseamnă că electronii pot exista doar într-un atom la anumite energii, așa cum Bohr teoretizase anterior.
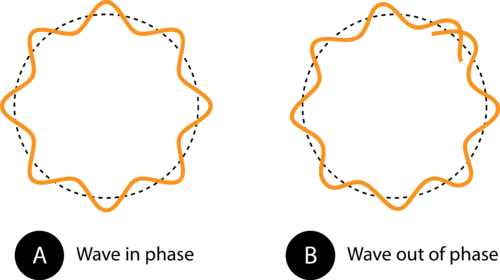
Figura 1. Circumferința orbitei din (A) permite undei electronice să se potrivească perfect pe orbită. Aceasta este o orbită permisă. În (B), unda electronică nu se potrivește corect pe orbită, deci această orbită nu este permisă.
Rezumat
- Ecuațiile de undă deBroglie permit calcularea lungimii de undă a oricărei mișcări obiect.
- Pe măsură ce viteza electronului scade, lungimea lui de undă crește.
Practică
Utilizați linkul de mai jos pentru a practica calculele folosind ecuația undei deBroglie:
http://science.widener.edu/svb/tutorial/debrogliecsn7.html
Recenzie
- Ce nu a explicat modelul Bohr?
- Afirmați ecuația undei deBroglie.
- Ce se întâmplă pe măsură ce viteza electronului scade?