Comment interpréter les spectres infrarouges en 1 minute ou moins: les 2 choses les plus importantes à rechercher
Dernier article, nous avons brièvement présenté le concept de vibrations de liaison, et nous avons vu que nous pouvons penser aux liaisons covalentes comme un peu comme des billes et des ressorts: les ressorts vibrent, et chacun « chante » à une fréquence caractéristique , qui dépend de la force de la liaison et de la masse des atomes. Ces vibrations ont des fréquences situées dans la région infrarouge moyen (IR) du spectre électromagnétique.
Nous pouvons observer et mesurer cela « chanter » des liaisons en appliquant un rayonnement IR à un échantillon et en mesurant les fréquences auxquelles le rayonnement est absorbé. Le résultat est une technique connue sous le nom de spectroscopie infrarouge, qui est un outil utile et rapide pour identifier les liaisons présentes dans une molécule donnée.
Nous avons vu que le spectre IR de l’eau était assez simple – mais passons à une molécule relativement complexe comme le glucose (ci-dessous) nous avons été soudainement confrontés à une forêt de pics!
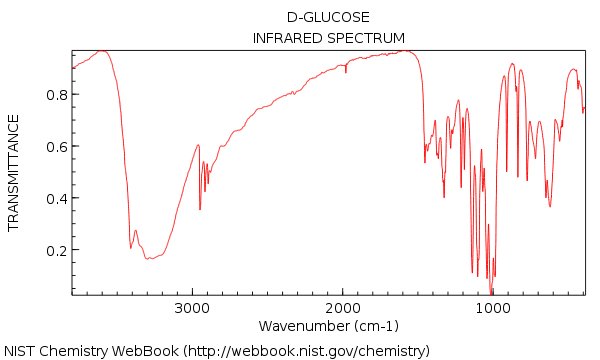
Votre première impression de regarder à cet IR pourrait être: agh! comment suis-je censé donner un sens à cela ??
Ce à quoi je veux dire: pas de panique!
Table des matières
- Corrigeons quelques idées fausses courantes sur l’IR
- Commencer par « Hunt And Peck » n’est pas la voie à suivre
- Spectroscopie IR: vue d’ensemble
- Les deux principaux éléments à rechercher dans un spectre infrarouge: «Tongues» et «Swords».
- Alcools et acides carboxyliques: Plus Détails
- Exemples spécifiques de spectres infrarouges de groupes fonctionnels carbonyle
- Moins cruciaux, mais toujours utiles: deux autres domaines très diagnostiques.
- Glucose, revisité: le 1 Analyse des minutes
Corrigeons quelques idées fausses courantes sur l’IR
Dans cet article, je veux montrer qu’une analyse typique d’un spectre IR est beaucoup plus simple que vous ne le pensez . En fait, une fois que vous avez appris ce qu’il faut rechercher, cela peut souvent être fait en une minute ou moins. Pourquoi?
- IR n’est généralement pas utilisé pour déterminer la structure entière d’une molécule inconnue. Par exemple, il n’y a pas une personne vivante qui pourrait regarder le spectre IR ci-dessus et en déduire la structure de glu cose de lui. IR est un outil avec une utilisation très spécifique.
- Nous n’avons pas besoin d’analyser chaque pic! (comme nous le verrons plus tard, c’est à cela que sert la RMN: -)). Au lieu de cela, IR est idéal pour identifier certains groupes fonctionnels spécifiques, comme les alcools et les carbonyles. De cette façon, il est complémentaire à d’autres techniques (comme la RMN) qui ne fournissent pas ces informations aussi rapidement.
Dans cet esprit, nous pouvons simplifier l’analyse d’un spectre IR en supprimant tout sauf le fruit le plus bas.
Vous voyez cette forêt de pics de 500 à 1400 cm-1? Nous allons essentiellement les ignorer tous!
80% des informations les plus utiles pour nos besoins peuvent être obtenues en examinant deux zones spécifiques du spectre: 3200-3400 cm-1 et 1650-1800 cm-1. Nous verrons également qu’il y a au moins deux autres régions d’un spectre IR qui méritent d’être examinées, et conclurons ainsi une analyse « de premier ordre » du spectre IR d’une inconnue.
En résumé: Le L’objectif de cet article est de vous montrer comment hiérarchiser votre temps dans une analyse d’un spectre infrarouge.
2. Commencer par « Hunt And Peck » n’est pas la voie à suivre
Confronté à un spectre infrarouge d’une inconnue (et à un sentiment de panique croissante), que fait un nouvel élève typique?
Ils recherchent souvent le premier outil qui leur est donné, qui est un tableau de plages communes pour les pics IR qui leur sont donnés par leur instructeur.
La prochaine étape de leur analyse consiste à parcourir le spectre d’un côté à l’autre, en essayant de faire correspondre chaque pic à l’un des nombres du tableau . Je le sais parce que c’est exactement ce que j’ai fait lorsque j’ai appris l’IR pour la première fois. J’appelle cela « chasser et picorer ».
Les seules personnes qui « chassent et picorent » sont les personnes qui n’ont pas de plan (c’est-à-dire les «débutants»).
Ainsi, en lisant les quelques paragraphes suivants, vous pouvez vous épargner beaucoup de temps et de confusion.
Vue d’ensemble
En spectroscopie infrarouge, nous mesurons l’endroit où les molécules absorbent les photons du rayonnement infrarouge. Les pics représentent les zones du spectre où se produisent des vibrations de liaison spécifiques.
Voici un aperçu de la fenêtre infrarouge de 4000 cm -1 à 500 cm -1 avec différentes régions d’intérêt mises en évidence.
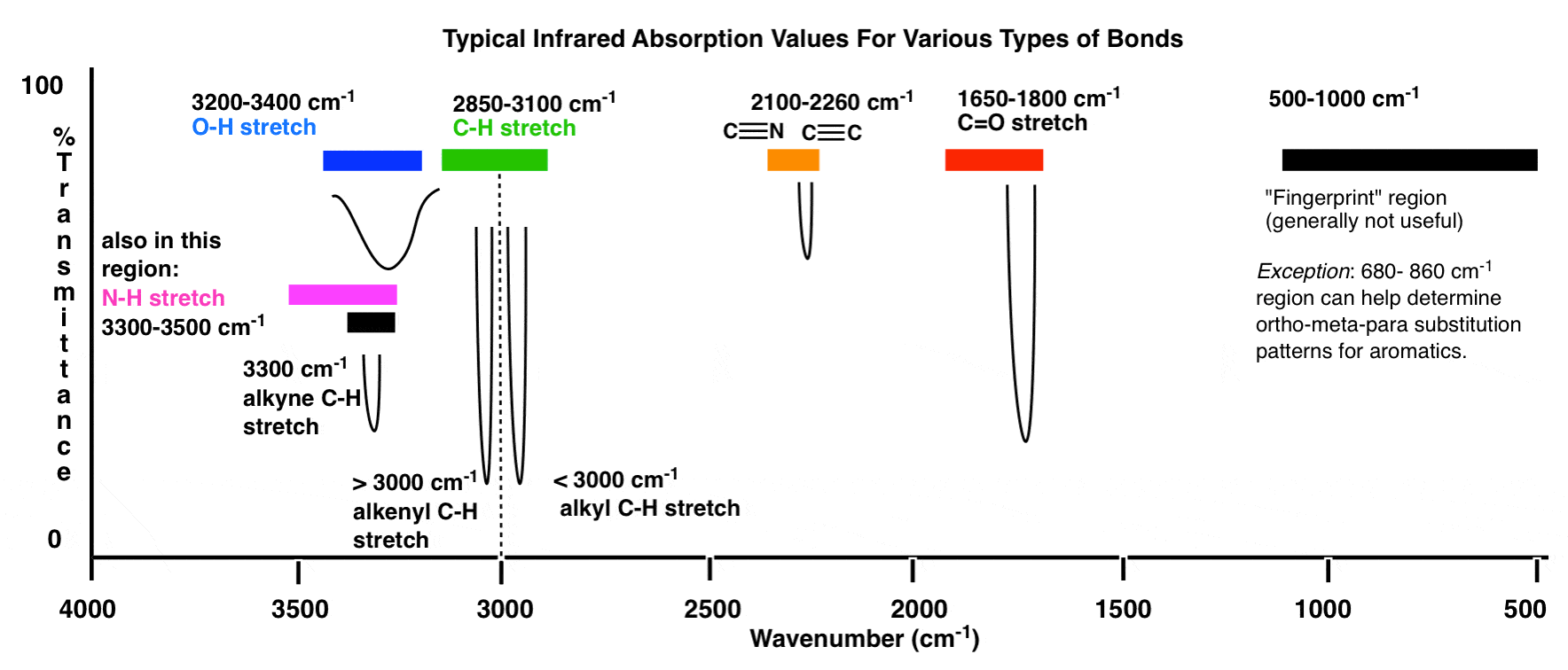
Un aperçu encore plus compressé ressemble à ceci: (source)
Dans ces plages, il y a deux domaines hautement prioritaires sur lesquels se concentrer, et deux domaines moins prioritaires que nous discutez plus en détail ci-dessous.
4. Les deux principaux éléments à rechercher dans un spectre infrarouge: « Tongues » et « Swords ».
Face à un nouveau spectre infrarouge, donnez la priorité à votre temps en posant deux questions importantes:
- Y a-t-il un pic large et arrondi dans la région autour de 3400-3200 cm- 1 ? C’est là que les groupes hydroxyle (OH) apparaissent.
- Y a-t-il un pic net et fort dans la région vers 1850-1630 cm-1? C’est là que les groupes carbonyle (C = O) apparaissent.
Tout d’abord, examinons quelques exemples de pics de groupes hydroxyle dans la région de 3400 cm-1 à 3200 cm-1, que Jon décrit comme des « langues ». Les pics en dessous appartiennent tous à des alcools. La liaison hydrogène entre les groupes hydroxyle entraîne certaines variations de la force de liaison OH, ce qui se traduit par une gamme d’énergies vibratoires. La variation se traduit par les larges pics observés.
Les groupes hydroxyle qui font partie des acides carboxyliques ont une apparence encore plus large que nous décrirons dans un instant.
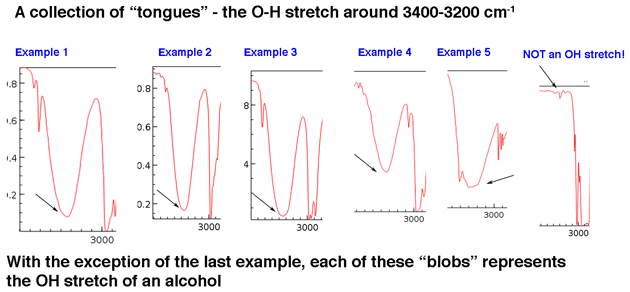
Le point principal est qu’un groupe hydroxyle n’est généralement pas quelque chose que vous devez rechercher dans le bruit de base.
Bien que les groupes hydroxyle soient le type le plus courant de pic large dans cette région, les pics NH peuvent également apparaître dans cette zone (pour en savoir plus dans la note de bas de page ci-dessous). Ils ont tendance à avoir une apparence plus nette et peuvent apparaître comme un ou deux pics en fonction du nombre de liaisons NH.
Ensuite, le Voici quelques exemples de pics C = O, dans la région autour de 1630-1800 cm-1 .. Ces pics sont presque toujours les pics les plus forts de tout le spectre et sont relativement étroits, leur donnant une apparence quelque peu «épée» .
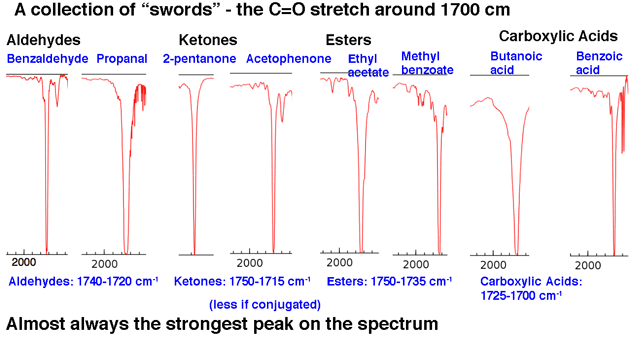
Cela résume notre analyse 80/20: cherchez des langues et des épées.
Si vous n’apprenez rien d’autre de cet article, apprenez à reconnaître ces deux types de pics!
Deux autres régions du spectre IR peuvent rapidement fournir des informations utiles si vous vous entraînez à les rechercher.
3. La ligne à 3000 cm-1 est une «frontière» utile entre l’alcène C – H (au-dessus de 3000 cm-1) et l’alcane C – H (au-dessous de 3000 cm-1). Cela peut rapidement vous aider à déterminer si des doubles liaisons sont présentes.
4. Un pic dans la région autour de 2200 cm-1 – 2050 cm-1 est un indicateur subtil de la présence d’une triple liaison. Rien d’autre n’apparaît dans cette région.
Un rappel de bon sens
Tout d’abord, un conseil évident:
- si on vous donne la formule moléculaire, cela déterminera quels groupes fonctionnels vous devriez rechercher. sens de rechercher des groupes OH si vous n’avez pas d’oxygène dans votre formule moléculaire, ou de même la présence d’une amine si la formule manque d’azote.
- Moins évidemment, calculez les degrés d’insaturation si on vous donne le formule, car elle fournira des indices importants. Ne cherchez pas C = O dans une structure comme C4H10O qui n’a aucun degré d’insaturation.
5. Alcools et acides carboxyliques: Plus de détails
Alcools
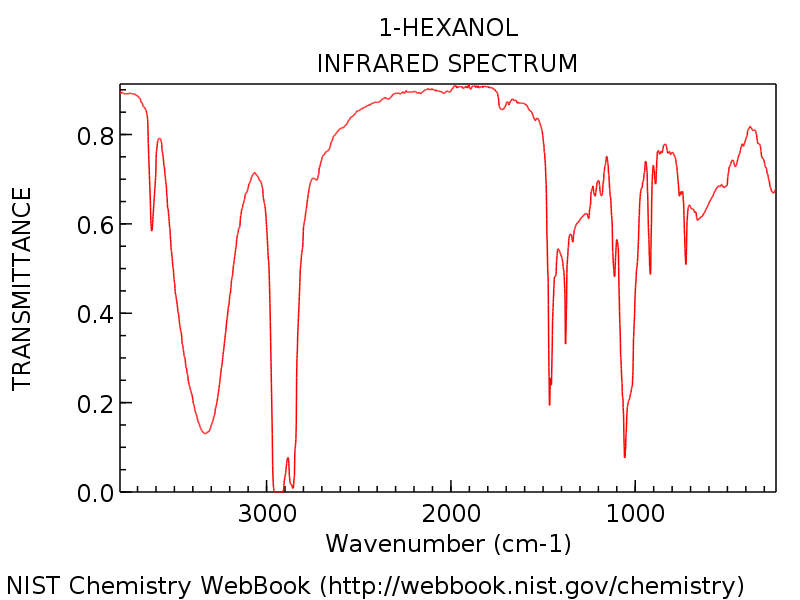
Le Regardez un exemple spécifique pour que nous puissions tout voir en perspective. Le spectre ci-dessous est celui du 1-hexanol.
Notez le pic du groupe hydroxyle autour de 3300 cm-1, typique d’un alcool (Ce pic pointu autour de 3600 cm-1 est un compagnon commun des pics d’hydroxyle: il représente OH non lié à l’hydrogène).
Comme vous vous en doutez pour le 1-hexanol, il n’y a pas de pic carbonyle révélateur autour de 1700 cm-1. Les débutants pourraient être tentés d’étiqueter ce pic puissant en forme de poignard à environ 1450 cm-1 comme un possible étirement C = O. Ce n’est pas. (c’est probablement un virage C-H). Les variations ne se produisent que dans une plage très étroite, et il est extrêmement peu probable que vous voyiez un étirement C = O bien en dessous de 1650 cm-1. Plus vous voyez de spectres, mieux vous vous familiariserez avec ces jugements.
Pour vous familiariser avec les variations, voici quelques exemples supplémentaires des spectres IR entiers de divers alcools.
- Phénol
- Cyclohexanol
- 1-butanol
Acides carboxyliques
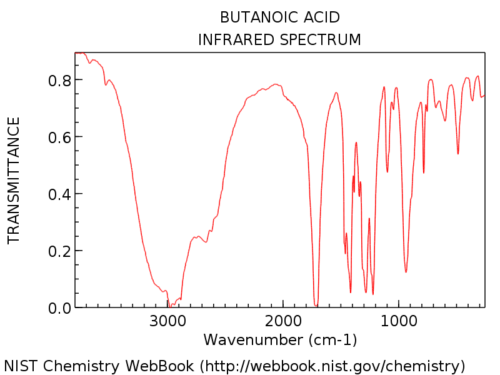
Les groupes hydroxyle dans les acides carboxyliques sont considérablement plus larges que dans les alcools. Jon l’appelle une « barbe poilue », ce qui est une description parfaite. Leur apparence est également très variable. L’absorption de OH dans les acides carboxyliques peut être si large qu’elle s’étend en dessous de 3000 cm-1, « prenant le dessus » de la main gauche partie du spectre.
Voici un exemple: acide butanoïque.
Voici quelques autres exemples de spectre complet afin que vous puissiez voir la variation.
- Acide benzoïque,
- Acide pentanoïque,
- Acide acétique
La différence d’aspect entre l’OH d’un alcool et celle d’un acide carboxylique est généralement diagnostique. Dans le cas rare où vous ne savez pas si le pic large est dû à l’OH d’un alcool ou d’un acide carboxylique, une suggestion est de vérifier la région autour de 1700 cm pour l’étirement C = O. S’il est absent, vous regardez probablement un alcool.
Exemples spécifiques de spectres IR de groupes fonctionnels carbonyle
La deuxième région de pic importante est la zone d’étirement carbonyle C = O à environ 1630-1830 cm. Les étirements carbonylés sont nets et forts.
Une fois que vous en voyez quelques-uns, il est impossible de les manquer. Rien d’autre n’apparaît dans cette région.
Pour mettre les choses en perspective, voici le spectre infrarouge de l’hexanal. Ce pic un peu après 1700 cm-1 est l’étirement C = O. Lorsqu’il est présent, l’étirement C = O est presque toujours le pic le plus fort du spectre infrarouge et impossible à manquer.
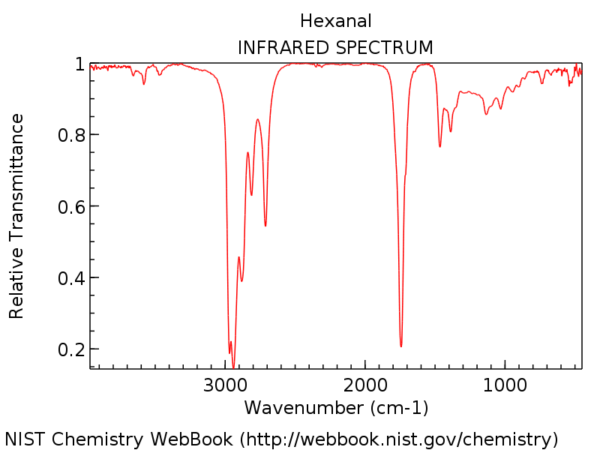
La position de l’étirement C = O varie légèrement selon le groupe fonctionnel carbonyle. Certaines plages (en cm-1) sont indiquées ci-dessous:
La conjugaison affectera quelque peu la position de l’étirement C = O, en le déplaçant vers un nombre d’onde inférieur.
Une règle empirique décente est que vous ne verrez jamais, jamais un étirement C = O en dessous de 1630. Si vous voyez un pic fort à 1500, par exemple, ce n’est pas C = O. C’est autre chose.
Moins crucial, mais toujours utile: deux autres domaines très diagnostiques.
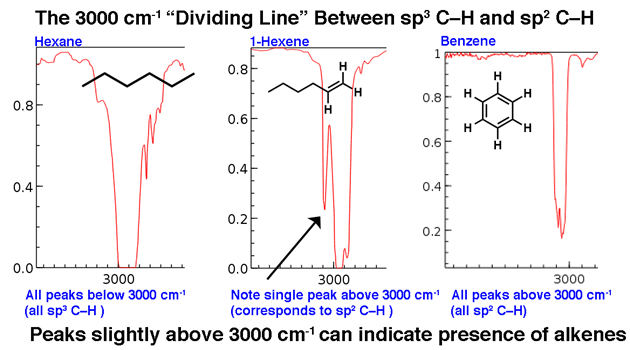
- La limite d’étirement CH à 3000 cm-1
3000 cm-1 sert de ligne de démarcation utile. Au-dessus de cette ligne, on observe des étirements C-H de fréquence plus élevée que nous attribuons aux liaisons C-H hybrides sp2. Deux exemples ci-dessous: 1-hexène (notez le pic qui est un peu plus haut) et le benzène.
Pour une molécule avec uniquement des liaisons CH hybrizées par sp3, les lignes apparaîtront en dessous de 3000 cm-1 comme dans l’hexane ci-dessous.
2. La région de triple liaison distinctive autour de 2200 cm-1
Les molécules à triple liaison apparaissent relativement rarement dans le grand schéma des choses, mais quand elles le font, elles ont une trace distinctive dans l’IR.
La région comprise entre 2000 cm-1 et 2400 cm-1 est un peu une « ville fantôme » dans les spectres infrarouges; très peu de choses apparaissent dans cette région. Si vous voyez des pics dans cette région, un candidat probable est un carbone triple lié tel qu’un alcyne ou un nitrile.
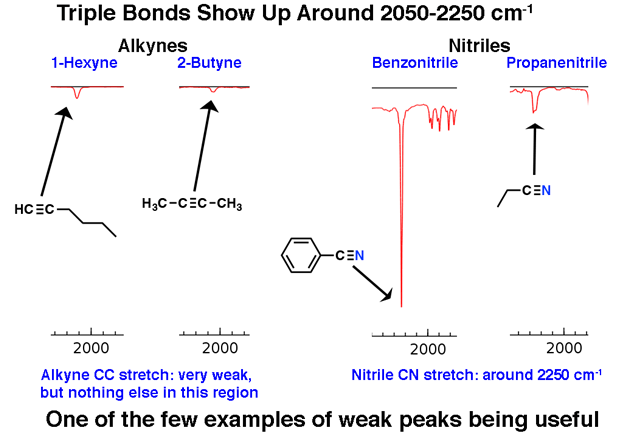
Notez la faiblesse des pics d’alcyne. C’est une exception à la règle selon laquelle il faut ignorer les pics faibles. Néanmoins, la prudence est de mise: si on vous donne la formule moléculaire, confirmez qu’un alcyne est possible en calculant les degrés d’insaturation et en vous assurant qu’il est d’au moins 2 ou plus.
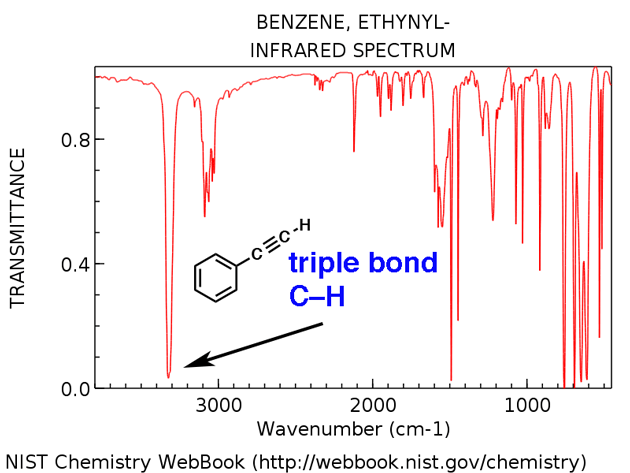
Les alcynes terminaux (tels que la 1-hexyne) ont également un fort étirement CH d’environ 3400 cm-1 qui est plus fortement diagnostique.
Glucose, revisité: l’analyse en 1 minute
OK. Nous sommes allés au-delà r 4 régions utiles pour une analyse rapide d’un spectre IR.
Revenons maintenant en arrière et regardons l’IR du glucose. Que voyons-nous?
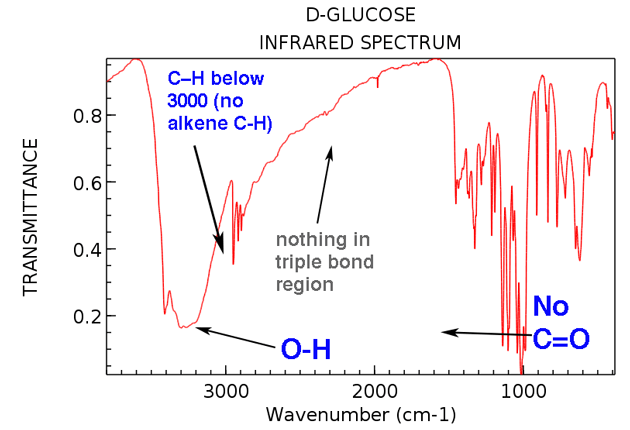
Voici les deux grandes choses à noter:
Aussi, si nous prenons un peu de temps supplémentaire, nous pouvons voir:
- Pas d’alcène CH (pas de pics au-dessus de 3000 cm-1)
- Rien dans la région à triple liaison (rare, mais quand même une chose facile à apprendre à vérifier)
Maintenant: Si on vous donnait ce spectre comme « inconnu » avec sa formule moléculaire, C6H12O6, quelles conclusions pourriez-vous tirer sur sa structure?
- La molécule a au moins un groupe OH (et éventuellement plus)
- La molécule n’a pas de groupe C = O
- La molécule * probablement * n’a pas d’alcènes. Si des alcènes sont présents, ils ne portent aucune liaison CH, car nous verrions leur CH s’étirer au-dessus de 3000 cm-1.
A molécule avec un degré de carence en hydrogène (C6H12O6) mais pas de C = O, et probablement pas de C = C?
Une bonne supposition serait que la molécule contient un anneau (nous savons que c’est le cas, bien sûr, mais c’est agréable de voir l’IR confirmer wha t nous le savons déjà).
C’est ce qu’une analyse d’une minute de l’IR du glucose peut nous dire. Pas toute la structure, remarquez, mais certainement quelques éléments importants.
Cela suffit pour aujourd’hui. Dans le prochain article, nous ferons quelques analyses supplémentaires d’une minute et donnerons des exemples plus concrets sur la façon d’utiliser les informations dans un spectre IR pour tirer des conclusions sur la structure moléculaire.
Plus d’informations sur la région 3200: Amines , Amides et Terminal Alkyne CH
Alors que nous sommes dans la région 3200…. Amines et amides
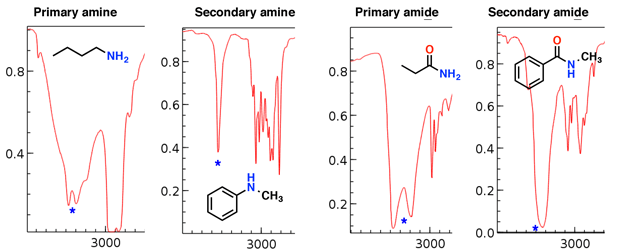
Les amines et les amides ont aussi des étirements N-H qui apparaissent dans cette région.
Remarquez comment l’amine primaire et l’amide primaire ont deux « crocs », tandis que l’amine secondaire et l’amide secondaire ont un seul pic.
Les étirements d’amine ont tendance à être plus nets que l’amide s’étire; aussi les amides peuvent être distingués par un fort étirement C = O (voir ci-dessous).
Amines primaires (cliquez pour les spectres)
- Aniline
- Benzylamine
- Cyclohexylamine
Amines secondaires:
- N-méthylbenzylamine
- N, N-dibenzylamine
- N-méthylaniline
Amides primaires
- Propionamide
- Benzamide
- Butanamide
Amides secondaires
- N-méthylbenzamide
Alcyne terminal CH
Alcynes terminaux ont un étirement CH caractéristique d’environ 3300 cm-1. Ici, c’est pour l’éthynylbenzène, ci-dessous.
- Ethynylbenzène