Cómo interpretar los espectros de infrarrojos en 1 minuto o menos: las 2 cosas más importantes a tener en cuenta
En la última publicación, presentamos brevemente el concepto de vibraciones de enlace y vimos que podemos pensar en los enlaces covalentes como algo así como bolas y resortes: los resortes vibran y cada uno «canta» a una frecuencia característica. , que depende de la fuerza del enlace y de las masas de los átomos. Estas vibraciones tienen frecuencias que se encuentran en la región del infrarrojo medio (IR) del espectro electromagnético.
Podemos observar y medir esto «canto» de enlaces aplicando radiación IR a una muestra y midiendo las frecuencias a las que se absorbe la radiación. El resultado es una técnica conocida como espectroscopia infrarroja, que es una herramienta útil y rápida para identificar los enlaces presentes en una molécula determinada.
Vimos que el espectro IR del agua era bastante simple, pero pasamos a una molécula relativamente compleja como la glucosa (abajo) ¡nos enfrentamos repentinamente a un bosque de picos!
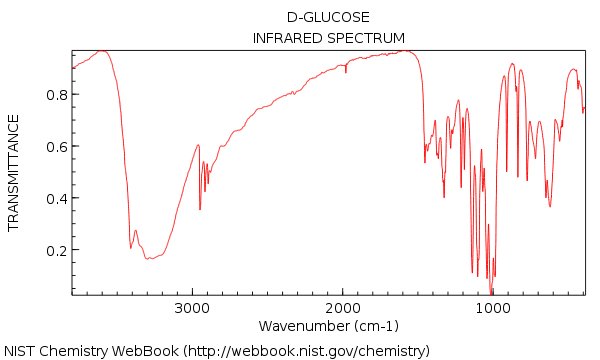
Tu primera impresión de mirar en ese IR podría ser: ¡agh! ¿Cómo se supone que voy a darle sentido a eso?
A lo que quiero decir: ¡que no cunda el pánico!
Tabla de contenido
- Corrijemos algunos conceptos erróneos comunes acerca de las IR
- Comenzar con «Cazar y picotear» no es el camino a seguir
- Espectroscopia de infrarrojos: el panorama general
- Las dos cosas principales que se deben buscar en un espectro de infrarrojos: «lenguas» y «espadas».
- Alcoholes y ácidos carboxílicos: más Detalle
- Ejemplos específicos de espectros de IR de grupos funcionales de carbonilo
- Menos cruciales, pero aún útiles: dos áreas más muy diagnósticas.
- Glucosa, revisada: la 1 Análisis minucioso
Corrijemos algunos conceptos erróneos comunes sobre IR
En esta publicación, quiero mostrar que un análisis típico de un espectro IR es mucho más simple de lo que piensas De hecho, una vez que aprende qué buscar, a menudo se puede hacer en un minuto o menos. ¿Por qué?
- La IR no se usa generalmente para determinar la estructura completa de una molécula desconocida. Por ejemplo, no hay una persona viva que pueda mirar el espectro IR arriba y deducir la estructura de glu cose de él. IR es una herramienta con un uso muy específico.
- ¡No necesitamos analizar cada pico! (como veremos más adelante, para eso es la RMN: -)). En cambio, IR es excelente para identificar ciertos grupos funcionales específicos, como alcoholes y carbonilos. De esta manera, es complementario a otras técnicas (como la RMN) que no proporcionan esta información tan rápidamente.
Teniendo esto en cuenta, podemos simplificar el análisis de un espectro de infrarrojos cortando todo excepto la fruta más baja.
¿Ves ese bosque de picos de 500-1400 cm-1? ¡Básicamente, los vamos a ignorar todos!
El 80% de la información más útil para nuestros propósitos se puede obtener observando dos áreas específicas del espectro: 3200-3400 cm-1 y 1650-1800. cm-1. También veremos que hay al menos dos regiones más de un espectro de infrarrojos que vale la pena echar un vistazo, y así concluir un análisis de «primer orden» del espectro de infrarrojos de un desconocido.
Conclusión: El El propósito de esta publicación es mostrarle cómo priorizar su tiempo en un análisis de un espectro IR.
2. Comenzar con «Hunt And Peck» no es el camino a seguir
Enfrentados con un espectro IR de un desconocido (y una sensación de pánico creciente), ¿qué hace un estudiante nuevo típico?
A menudo buscan la primera herramienta que se les da, que es una tabla de rangos comunes para los picos de infrarrojos proporcionados por su instructor.
El siguiente paso en su análisis es recorrer el espectro de un lado al siguiente, tratando de hacer coincidir cada pico con uno de los números de la tabla . Lo sé porque esto es exactamente lo que hice cuando aprendí IR por primera vez. Yo lo llamo «cazar y picotear».
Las únicas personas que «cazan y picotean» como primer paso son las personas que no tienen un plan (es decir, «novatos»).
Por lo tanto, al leer los siguientes párrafos puede ahorrarse mucho tiempo y confusión.
El panorama general
En espectroscopía IR medimos dónde las moléculas absorben fotones de radiación IR. Los picos representan áreas del espectro donde ocurren vibraciones de enlace específicas. Al igual que los resortes de diferentes pesos vibran a frecuencias características dependiendo de la masa y tensión, también lo hacen los enlaces.
Aquí hay una descripción general de la ventana de infrarrojos de 4000 cm -1 a 500 cm -1 con varias regiones de interés resaltadas.
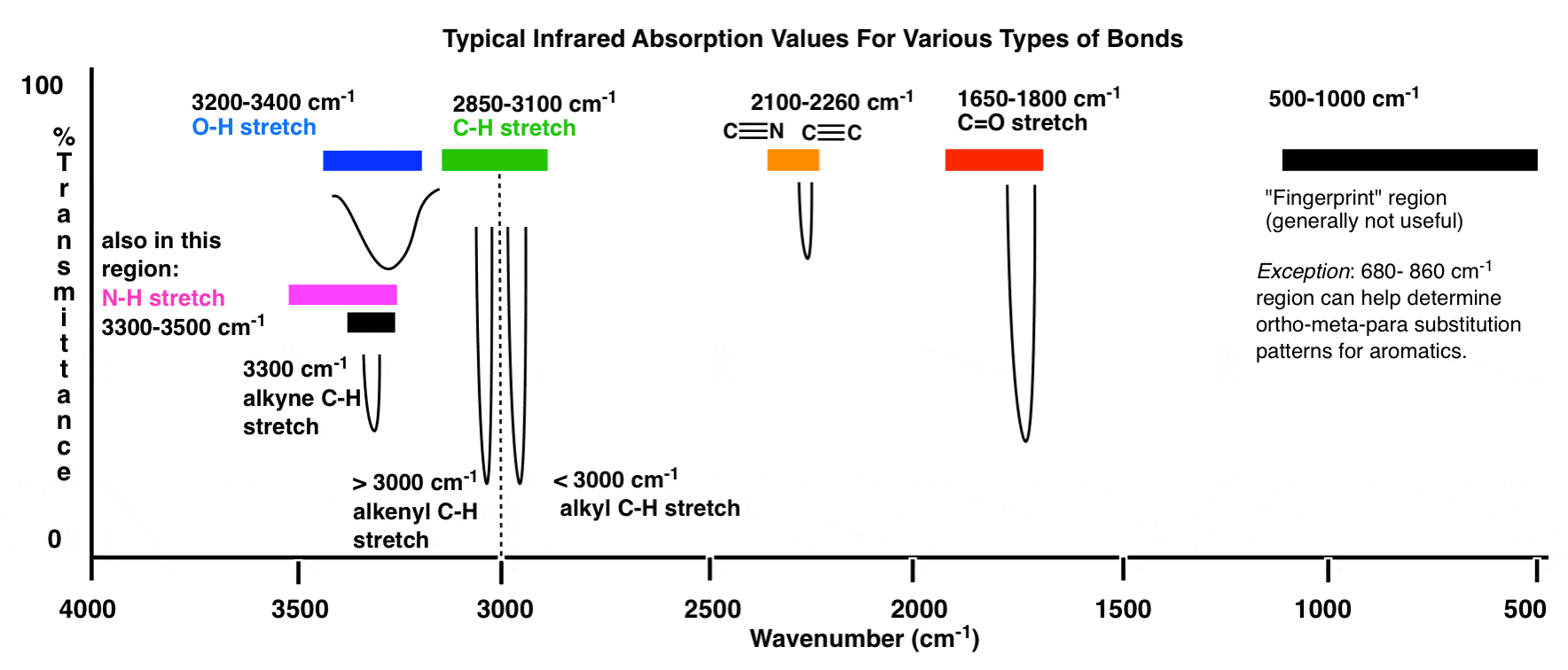
Una descripción general aún más comprimida se ve así: (fuente)
Dentro de estos rangos, hay dos áreas de alta prioridad en las que centrarse, y dos áreas de menor prioridad que discuta más abajo.
4. Las dos cosas principales a buscar en un espectro IR: «Lenguas» y «Espadas».
Cuando se enfrente a un nuevo espectro de infrarrojos, priorice su tiempo haciendo dos preguntas importantes:
- ¿Existe un pico ancho y redondeado en la región alrededor de 3400-3200 cm? 1? Ahí es donde aparecen los grupos hidroxilo (OH).
- ¿Hay un pico fuerte y agudo en la región alrededor de 1850-1630 cm-1? Ahí es donde aparecen los grupos carbonilo (C = O).
Primero, veamos algunos ejemplos de picos de grupos hidroxilo en la región de 3400 cm-1 a 3200 cm-1, que Jon describe vívidamente como «lenguas». Los picos de abajo pertenecen todos a alcoholes. Los enlaces de hidrógeno entre los grupos hidroxilo producen algunas variaciones en la fuerza del enlace OH, lo que da como resultado un rango de energías vibratorias. La variación da como resultado los picos amplios observados.
Los grupos hidroxilo que forman parte de los ácidos carboxílicos tienen una apariencia aún más amplia que describiremos en un momento.
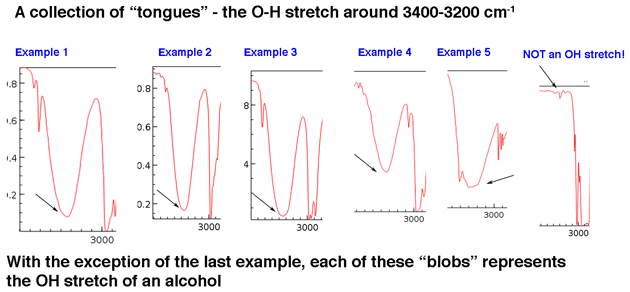
El punto principal es que un grupo hidroxilo generalmente no es algo que deba buscar en el ruido de referencia.
Aunque los grupos hidroxilo son el tipo más común de pico ancho en esta región, los picos NH también pueden aparecer en esta área (más sobre ellos en la nota a pie de página a continuación). Tienden a tener una apariencia más nítida y pueden aparecer como uno o dos picos según la cantidad de enlaces NH.
A continuación, le Echemos un vistazo a algunos ejemplos de picos C = O, en la región alrededor de 1630-1800 cm-1. Estos picos son casi siempre los picos más fuertes en todo el espectro y son relativamente estrechos, lo que les da una apariencia algo «como una espada» .
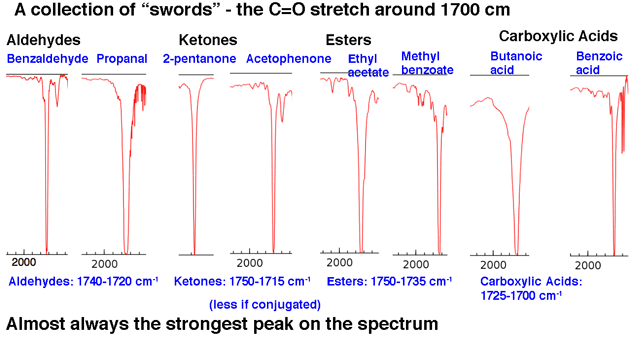
Eso resume nuestro análisis 80/20: busca lenguas y espadas.
Si No aprende nada más de esta publicación, ¡aprenda a reconocer estos dos tipos de picos!
Otras dos regiones del espectro de infrarrojos pueden proporcionar rápidamente información útil si se entrena para buscarlas.
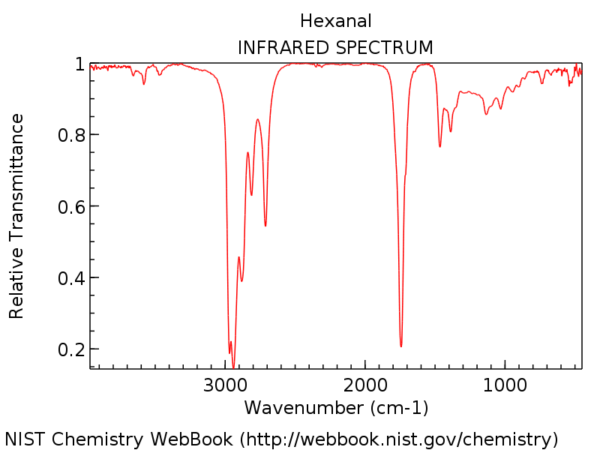
3. La línea a 3000 cm-1 es un «borde» útil entre el alqueno C – H (por encima de 3000 cm-1) y el alcano C – H (por debajo de 3000 cm-1). Esto puede ayudarlo a determinar rápidamente si hay dobles enlaces presentes.
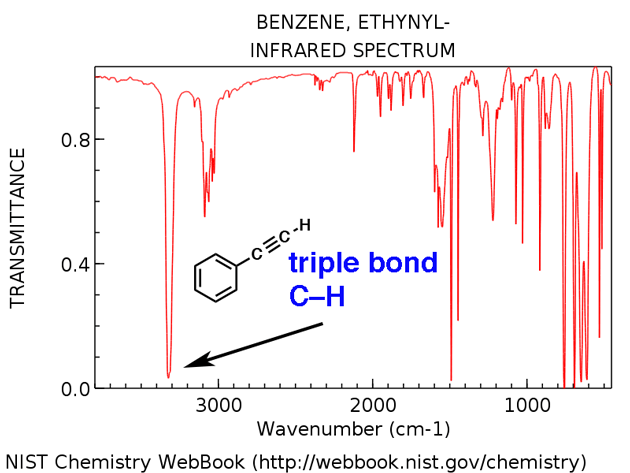
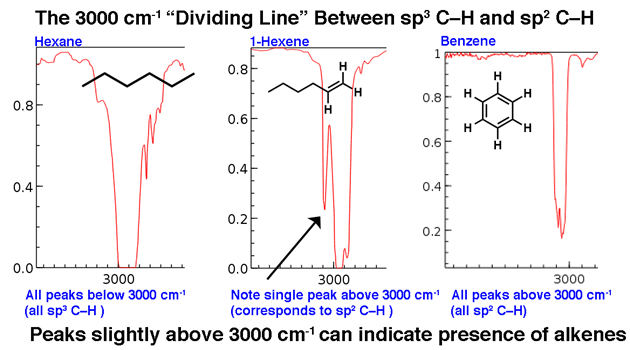
4. Un pico en la región alrededor de 2200 cm-1 – 2050 cm-1 es un indicador sutil de la presencia de un triple enlace. Nada más aparece en esta región.
Un recordatorio de sentido común
Primero, algunos consejos obvios:
- si le dan la fórmula molecular, eso determinará qué grupos funcionales debe buscar. tiene sentido buscar grupos OH si no tiene oxígenos en su fórmula molecular, o también la presencia de una amina si la fórmula carece de nitrógeno.
- De manera menos obvia, calcule los grados de insaturación si se le da la fórmula, porque proporcionará pistas importantes. No busque C = O en una estructura como C4H10O que no tiene ningún grado de insaturación.
5. Alcoholes y ácidos carboxílicos: Más detalles
Alcoholes
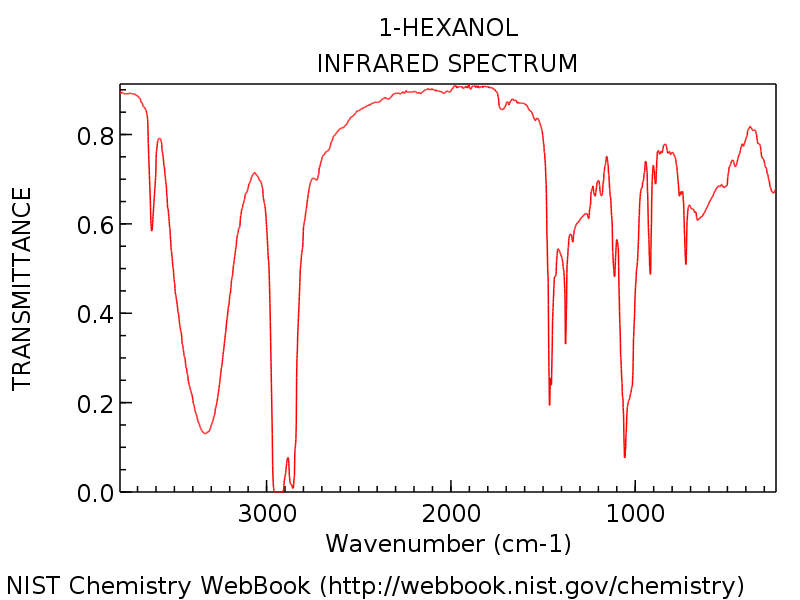
Le Veamos un ejemplo específico para que podamos ver todo en perspectiva. El espectro a continuación es de 1-hexanol.
Note el pico del grupo hidroxilo alrededor de 3300 cm-1, típico de un alcohol (ese pico agudo alrededor de 3600 cm-1 es un compañero común de los picos de hidroxilo: representa OH sin enlaces de hidrógeno).
Como cabría esperar del 1-hexanol, no hay ningún pico de carbonilo revelador alrededor de 1700 cm-1. Los principiantes pueden tener la tentación de etiquetar ese pico fuerte en forma de daga de aproximadamente 1450 cm-1 como un posible estiramiento C = O. No lo es. (es probable que sea una curva C-H). Las variaciones solo ocurren dentro de un rango muy estrecho, y es extremadamente improbable que vea un estiramiento C = O muy por debajo de 1650 cm-1. Cuantos más espectros vea, mejor podrá hacer estos juicios.
Para familiarizarse con la variación, aquí hay algunos ejemplos más. de los espectros IR completos de varios alcoholes.
- Fenol
- Ciclohexanol
- 1-butanol
Ácidos carboxílicos
Los grupos hidroxilo en los ácidos carboxílicos son considerablemente más amplios que en los alcoholes. Jon lo llama «barba peluda», que es una descripción perfecta. Su apariencia también es muy variable. La absorción de OH en los ácidos carboxílicos puede ser tan amplia que se extiende por debajo de los 3000 cm-1, prácticamente «apoderándose» de la mano izquierda. parte del espectro.
Aquí hay un ejemplo: ácido butanoico.
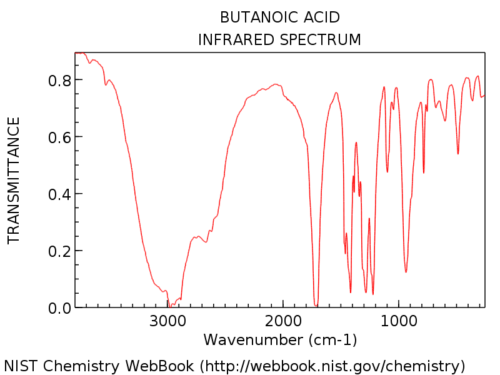
Aquí hay algunos ejemplos más de espectros completos para que pueda ver la variación.
- Ácido benzoico,
- Ácido pentanoico,
- Ácido acético
La diferencia de apariencia entre el OH de un alcohol y el de un ácido carboxílico suele ser diagnóstica. En el raro caso en el que no esté seguro de si el pico ancho se debe al OH de un alcohol o un ácido carboxílico, una sugerencia es verificar la región alrededor de 1700 cm para el estiramiento C = O. Si está ausente, es probable que esté mirando un alcohol.
Ejemplos específicos de espectros de IR de grupos funcionales de carbonilo
La segunda región de pico importante es el área de estiramiento de C = O del carbonilo en aproximadamente 1630-1830 cm. Los estiramientos de carbonilo son nítidos y fuertes.
Una vez que vea algunos de ellos, es imposible no verlos. No aparece nada más en esta región.
Para ponerlo en perspectiva, aquí está el espectro IR del hexanal. Ese pico un poco después de 1700 cm-1 es el estiramiento C = O. Cuando está presente, el tramo C = O es casi siempre el pico más fuerte en el espectro IR y es imposible pasarlo por alto.
La posición del tramo C = O varía ligeramente según el grupo funcional carbonilo. Algunos rangos (en cm-1) se muestran a continuación:
La conjugación afectará un poco la posición del estiramiento C = O, moviéndolo a un número de onda más bajo.
Una regla de oro decente es que nunca verá un tramo de C = O por debajo de 1630. Si ve un pico fuerte en 1500, por ejemplo, no es C = O. Es otra cosa.
Menos crucial, pero aún útil: dos áreas más muy diagnósticas.
- El límite de estiramiento de CH a 3000 cm-1
3000 cm-1 sirve como una útil línea divisoria. Por encima de esta línea se observan tramos C-H de mayor frecuencia que atribuimos a los enlaces C-H hibridados sp2. Dos ejemplos a continuación: 1-hexeno (observe el pico que está un poco más alto) y benceno.
Para una molécula con solo enlaces CH híbridos sp3, las líneas aparecerán por debajo de 3000 cm-1 como en el hexano , a continuación.
2. La región distintiva del triple enlace alrededor de 2200 cm-1
Las moléculas con triples enlaces aparecen con relativa poca frecuencia en el gran esquema de las cosas, pero cuando lo hacen, tienen un rastro distintivo en el IR.
La región entre 2000 cm-1 y 2400 cm-1 es una especie de «ciudad fantasma» en los espectros de infrarrojos; es muy poco lo que aparece en esta región. Si ves picos en esta región, un candidato probable es un carbono de triple enlace, como un alquino o un nitrilo.
Tenga en cuenta lo débiles que son los picos de alquino. Esta es una excepción a la regla de que uno debe ignorar los picos débiles. Aún así, se requiere precaución: si se le da la fórmula molecular, confirme que un alquino es posible calculando los grados de insaturación y asegurándose de que sea al menos 2 o más.
Los alquinos terminales (como el 1-hexino) también tienen un fuerte tramo de CH alrededor de 3400 cm-1 que es más fuertemente diagnóstico.
Glucosa, revisada: el análisis de 1 minuto
OK. Nos hemos ido r 4 regiones que son útiles para un análisis rápido de un espectro de IR.
Ahora regresemos y observemos el IR de la glucosa. ¿Qué vemos?
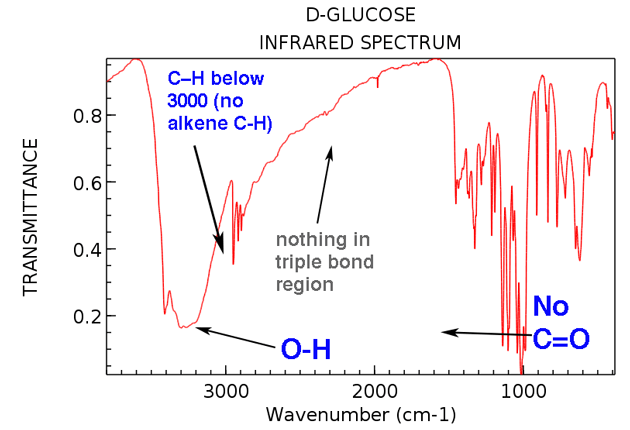
Estas son las dos cosas importantes a tener en cuenta:
Además, si nos tomamos un poco de tiempo extra, podemos ver:
- Sin alqueno CH (sin picos por encima de 3000 cm-1)
- Nada en la región de triple enlace (raro, pero aún una cosa fácil de aprender a verificar)
Ahora: si le dieran este espectro como un «desconocido» junto con su fórmula molecular, C6H12O6, ¿qué conclusiones podría sacar acerca de su estructura?
- La molécula tiene al menos un grupo OH (y posiblemente más)
- La molécula no tiene ningún grupo C = O
- La molécula * probablemente * no tiene alquenos. Si hay alquenos presentes, no tienen enlaces CH, porque veríamos que su CH se extiende por encima de 3000 cm-1.
A molécula con un grado de deficiencia de hidrógeno (C6H12O6) pero sin C = O, y probablemente sin C = C?
Una buena suposición sería que la molécula contiene un anillo (sabemos que este es el caso, por supuesto, pero es bueno ver que el IR confirma lo que t ya lo sabemos).
Esto es lo que nos puede decir un análisis de 1 minuto de la RI de la glucosa. No toda la estructura, claro está, pero ciertamente algunas partes importantes.
Eso es suficiente por hoy. En la próxima publicación haremos algunos análisis más de 1 minuto y daremos ejemplos más concretos de cómo usar la información en un espectro IR para sacar conclusiones sobre la estructura molecular.
Más sobre la región 3200: Aminas , Amidas y Terminal Alkyne CH
Mientras estamos en la región 3200…. Aminas y amidas
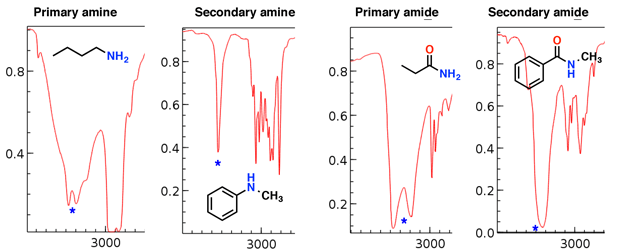
Las aminas y amidas también tienen tramos N-H que aparecen en esta región.
Observe cómo la amina primaria y la amida primaria tienen dos «colmillos», mientras que la amina secundaria y la amida secundaria tienen un solo pico.
Los estiramientos de amina tienden a ser más agudos que la amida estiramientos; también las amidas se pueden distinguir por un fuerte estiramiento C = O (ver más abajo).
Aminas primarias (haga clic para ver los espectros)
- Anilina
- Bencilamina
- Ciclohexilamina
Aminas secundarias:
- N-metilbencilamina
- N, N-dibencilamina
- N-metilanilina
Amidas primarias
- Propionamida
- Benzamida
- Butanamida
Amidas secundarias
- N-metil benzamida
Alquino terminal CH
Alquinos terminales tienen un estiramiento de CH característico alrededor de 3300 cm-1. Aquí está para el etinilbenceno, a continuación.
- Etinilbenceno