Como interpretar espectros de infravermelho em 1 minuto ou menos: as duas coisas mais importantes a serem observadas
No último post, apresentamos brevemente o conceito de vibrações de ligação e vimos que podemos pensar nas ligações covalentes como um pouco como bolas e molas: as molas vibram e cada uma “canta” em uma frequência característica , que depende da força da ligação e das massas dos átomos. Essas vibrações têm frequências que estão na região do infravermelho médio (IV) do espectro eletromagnético.
Podemos observar e medir isso “cantar” de ligações aplicando radiação IV a uma amostra e medindo as frequências nas quais a radiação é absorvida. O resultado é uma técnica conhecida como Espectroscopia de infravermelho, que é uma ferramenta útil e rápida para identificar as ligações presentes em uma determinada molécula.
Vimos que o espectro de infravermelho da água era muito simples – mas avançando para uma molécula relativamente complexa como a glicose (abaixo), de repente fomos confrontados com uma floresta de picos!
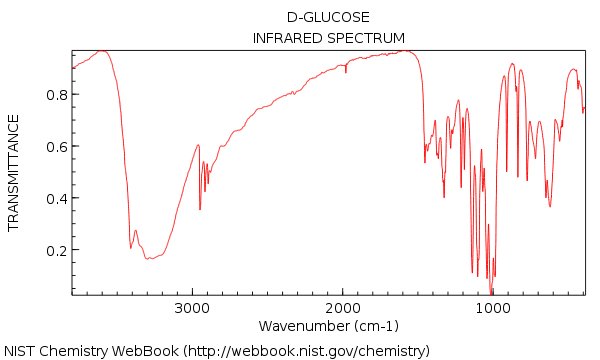
Sua primeira impressão de olhar nesse IR pode ser: agh! como vou entender isso ??
Ao que quero dizer: não entre em pânico!
Índice
- Vamos corrigir alguns equívocos comuns sobre RI
- Começar com “Hunt And Peck” não é o caminho a seguir
- Espectroscopia de infravermelho: o quadro geral
- As duas coisas principais a serem observadas em um espectro de infravermelho: “línguas” e “espadas”.
- Álcoois e ácidos carboxílicos: mais Detalhe
- Exemplos específicos de espectros de infravermelho de grupos funcionais de carbonil
- Menos crucial, mas ainda útil: mais duas áreas de diagnóstico.
- Glicose revisitada: a 1 Análise de minutos
Vamos corrigir alguns equívocos comuns sobre IR
Neste post, quero mostrar que uma análise típica de um espectro de IR é muito mais simples do que você pode imaginar . Na verdade, depois que você aprende o que procurar, geralmente isso pode ser feito em um minuto ou menos. Por quê?
- IR geralmente não é usado para determinar toda a estrutura de uma molécula desconhecida. Por exemplo, não há uma pessoa viva que pudesse olhar para o espectro de IV acima e deduzir a estrutura de glu cose dele. O IR é uma ferramenta com um uso muito específico.
- Não precisamos analisar cada pico! (como veremos mais tarde, é para isso que serve NMR: -)). Em vez disso, o IR é ótimo para identificar certos grupos funcionais específicos, como álcoois e carbonilas. Desta forma, é complementar a outras técnicas (como NMR) que não fornecem essas informações tão rapidamente.
Com isso em mente, podemos simplificar a análise de um espectro de IV cortando tudo, exceto as frutas mais baixas.
Vê aquela floresta de picos de 500-1400 cm-1? Basicamente, iremos ignorar todos eles!
80% das informações mais úteis para nossos propósitos podem ser obtidas olhando para duas áreas específicas do espectro: 3200-3400 cm-1 e 1650-1800 cm-1. Também veremos que há pelo menos mais duas regiões de um espectro de IV que vale a pena dar uma olhada e, assim, concluir uma análise de “primeira ordem” do espectro de IV de um desconhecido.
Conclusão: O objetivo desta postagem é mostrar como priorizar seu tempo na análise de um espectro de infravermelho.
2. Começar com “Hunt And Peck” não é o caminho a seguir
Confrontado com um espectro de infravermelho de um desconhecido (e uma sensação de pânico crescente), o que um novo aluno típico faz?
Eles geralmente buscam a primeira ferramenta que recebem, que é uma tabela de intervalos comuns para picos de IR fornecidos a eles por seu instrutor.
A próxima etapa em sua análise é percorrer o espectro de um lado para o outro, tentando combinar cada pico com um dos números da tabela . Sei disso porque foi exatamente o que fiz quando aprendi RI. Eu chamo isso de “caçar e bicar”.
As únicas pessoas que “caçam e bicam” como primeiro passo são as pessoas que não têm nenhum plano (ou seja, “novatos”).
Portanto, lendo os próximos parágrafos, você pode economizar muito tempo e confusão.
The Big Picture
Na espectroscopia IV, medimos onde as moléculas absorvem fótons da radiação IV. Os picos representam áreas do espectro onde ocorrem vibrações de ligações específicas. Assim como molas de pesos variados vibram em frequências características dependendo da massa e da tensão, o mesmo acontece com as ligações.
Esta é uma visão geral da janela IV de 4000 cm -1 a 500 cm -1 com várias regiões de interesse destacadas.
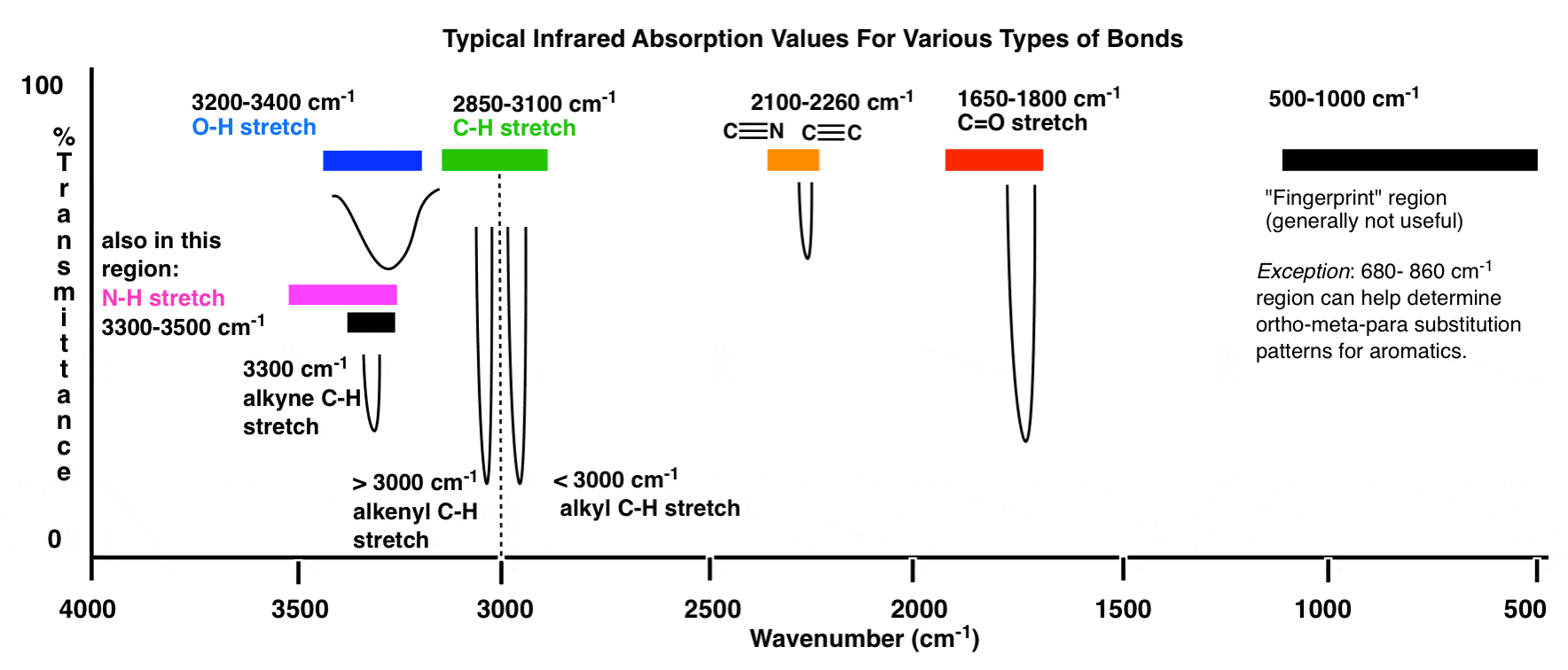
Uma visão geral ainda mais compactada tem a seguinte aparência: (fonte)
Dentro desses intervalos, há duas áreas de alta prioridade nas quais se concentrar e duas áreas de menos prioridade que iremos discuta mais abaixo.
4. As duas coisas principais a serem observadas em um espectro de infravermelho: “Línguas” e “Espadas”.
Quando confrontado com um novo espectro de infravermelho, priorize seu tempo fazendo duas perguntas importantes:
- Há um pico largo e arredondado na região em torno de 3400-3200 cm- 1? É aí que os grupos hidroxila (OH) aparecem.
- Existe um pico forte e agudo na região em torno de 1850-1630 cm-1? É aí que os grupos carbonila (C = O) aparecem.
Primeiro, vamos olhar alguns exemplos de picos de grupos hidroxila na região de 3400 cm-1 a 3200 cm-1, que Jon descreve vividamente como “línguas”. Todos os picos abaixo pertencem a álcoois. A ligação do hidrogênio entre os grupos hidroxila leva a algumas variações na força da ligação OH, o que resulta em uma gama de energias vibracionais. A variação resulta nos amplos picos observados.
Os grupos hidroxila que fazem parte dos ácidos carboxílicos têm uma aparência ainda mais ampla que descreveremos em breve.
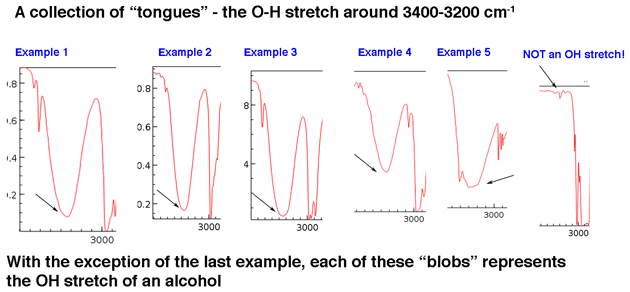
O ponto principal é que um grupo hidroxila geralmente não é algo que você precisa procurar no ruído da linha de base.
Embora os grupos hidroxila sejam o tipo mais comum de pico amplo nesta região, os picos de NH podem aparecer nesta área também (mais sobre eles na nota de rodapé abaixo). Eles tendem a ter uma aparência mais nítida e podem aparecer como um ou dois picos, dependendo do número de ligações NH.
Em seguida, le Vejamos alguns exemplos de picos C = O, na região em torno de 1630-1800 cm-1 .. Esses picos são quase sempre os picos mais fortes em todo o espectro e são relativamente estreitos, dando-lhes uma aparência um tanto “como uma espada” .
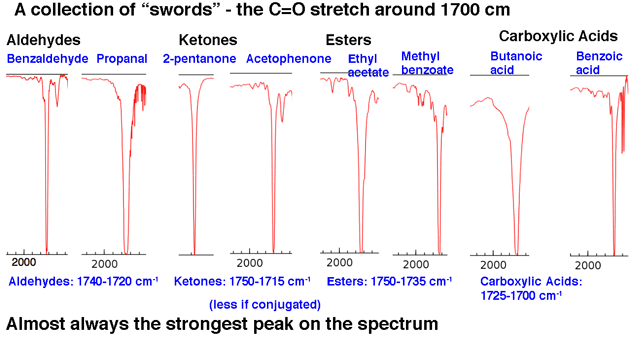
Isso resume nossa análise 80/20: procure por línguas e espadas.
Se você não aprende mais nada com esta postagem, aprenda a reconhecer esses dois tipos de picos!
Duas outras regiões do espectro de IV podem produzir rapidamente informações úteis se você treinar para procurá-las.
3. A linha em 3000 cm-1 é uma “fronteira” útil entre o alceno C – H (acima de 3000 cm-1) e o alcano C – H (abaixo de 3000 cm-1). Isso pode ajudá-lo rapidamente a determinar se as ligações duplas estão presentes.
4. Um pico na região em torno de 2200 cm-1 – 2050 cm-1 é um indicador sutil da presença de uma ligação tripla. Nada mais aparece nesta região.
Um lembrete de senso comum
Primeiro, alguns conselhos óbvios:
- se você receber a fórmula molecular, isso determinará quais grupos funcionais você deve procurar. sentido procurar grupos OH se você não tiver oxigênio em sua fórmula molecular, ou da mesma forma a presença de uma amina se a fórmula não tiver nitrogênio.
- Menos obviamente, calcule os graus de insaturação se você receber o valor molecular fórmula, porque fornecerá pistas importantes. Não procure C = O em uma estrutura como C4H10O que não tem nenhum grau de insaturação.
5. Álcoois e ácidos carboxílicos: Mais detalhes
Álcoois
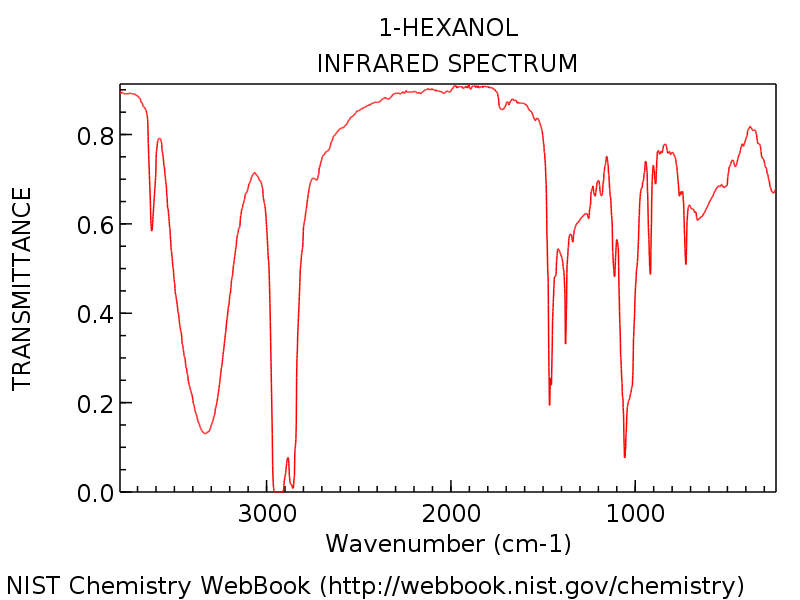
Le vejamos um exemplo específico para que possamos ver tudo em perspectiva. O espectro abaixo é de 1-hexanol.
Observe o pico do grupo hidroxila em torno de 3300 cm-1, típico de um álcool (aquele pico agudo em torno de 3600 cm-1 é um companheiro comum para picos de hidroxila: ele representa OH não ligado por hidrogênio).
Como você esperaria para 1-hexanol, não há nenhum pico de carbonil revelador em torno de 1700 cm-1. Os iniciantes podem ser tentados a rotular esse pico forte em forma de adaga em cerca de 1450 cm-1 como um possível trecho C = O. Não é. (é provavelmente uma curva C-H). As variações ocorrem apenas dentro de uma faixa muito estreita, e é extremamente improvável que você veja um alongamento C = O muito abaixo de 1650 cm-1. Quanto mais espectros você vê, melhor você faz esses julgamentos.
Para se familiarizar com a variação, aqui estão mais alguns exemplos de espectros IV inteiros de vários álcoois.
- Fenol
- Ciclohexanol
- 1-butanol
Ácidos carboxílicos
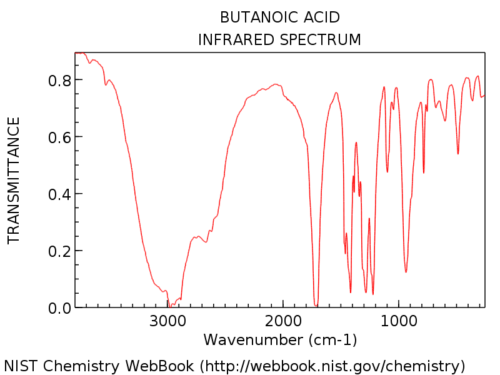
Os grupos hidroxila em ácidos carboxílicos são consideravelmente mais amplos do que em álcoois. Jon a chama de “barba cabeluda”, que é uma descrição perfeita. Sua aparência também é muito variável. A absorção de OH em ácidos carboxílicos pode ser tão ampla que se estende abaixo de 3000 cm-1, praticamente “tomando conta” da mão esquerda parte do espectro.
Aqui está um exemplo: ácido butanóico.
Aqui estão mais alguns exemplos de espectro total para que você possa ver a variação.
- ácido benzóico,
- ácido pentanóico,
- ácido acético
A diferença na aparência entre o OH de um álcool e o de um ácido carboxílico geralmente é diagnóstica. No caso raro em que você não tem certeza se o pico largo é devido ao OH de um álcool ou ácido carboxílico, uma sugestão é verificar a região em torno de 1700 cm para o trecho C = O. Se estiver ausente, você provavelmente está olhando para um álcool.
Exemplos específicos de espectros de IV de grupos funcionais de carbonil
A segunda região importante do pico é a área de estiramento C = O de carbonil em cerca de 1630-1830 cm. Os alongamentos de Carbonyl são nítidos e fortes.
Depois de ver alguns deles, é impossível perder. Nada mais aparece nesta região.
Para colocar em perspectiva, aqui está o espectro de infravermelho do hexanal. Esse pico um pouco depois de 1700 cm-1 é o trecho C = O. Quando está presente, o trecho C = O é quase sempre o pico mais forte no espectro de IV e impossível de perder.
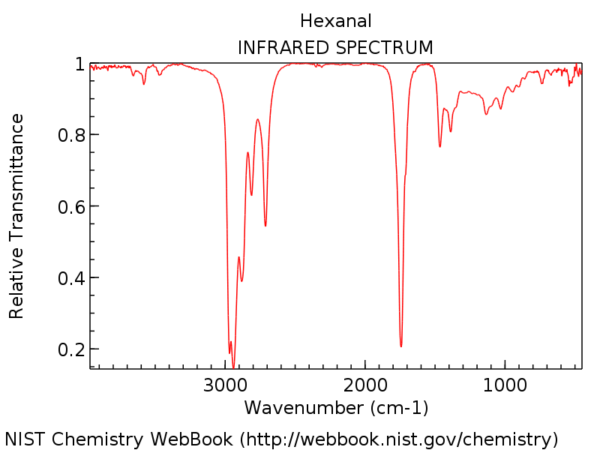
A posição do trecho C = O varia ligeiramente de acordo com o grupo funcional carbonil. Alguns intervalos (em cm-1) são mostrados abaixo:
A conjugação afetará um pouco a posição do trecho C = O, movendo-o para um número de onda mais baixo.
Uma regra prática decente é que você nunca, jamais verá um trecho C = O abaixo de 1630. Se você vir um pico forte em 1500, por exemplo, não é C = O. É outra coisa.
Menos crucial, mas ainda útil: mais duas áreas de diagnóstico.
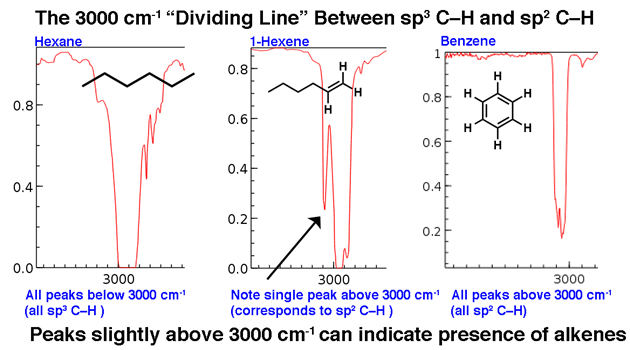
- O limite de extensão de CH em 3000 cm-1
3000 cm-1 serve como uma linha divisória útil. Acima desta linha são observados trechos C-H de maior frequência que atribuímos às ligações C-H hibridizadas com sp2. Dois exemplos abaixo: 1-hexeno (observe o pico que fica um pouco mais alto) e benzeno.
Para uma molécula com apenas ligações CH hibridizadas com sp3, as linhas aparecerão abaixo de 3000 cm-1 como no hexano , abaixo.
2. A região de ligação tripla distinta em torno de 2200 cm-1
Moléculas com ligações triplas aparecem com pouca frequência no grande esquema das coisas, mas quando o fazem, têm um traço distinto no IR.
A região entre 2.000 cm-1 e 2.400 cm-1 é um pouco como uma “cidade fantasma” no espectro de IV; há muito pouco que aparece nesta região. Se você vir picos nesta região, um provável candidato é um carbono de ligação tripla, como um alcino ou nitrila.
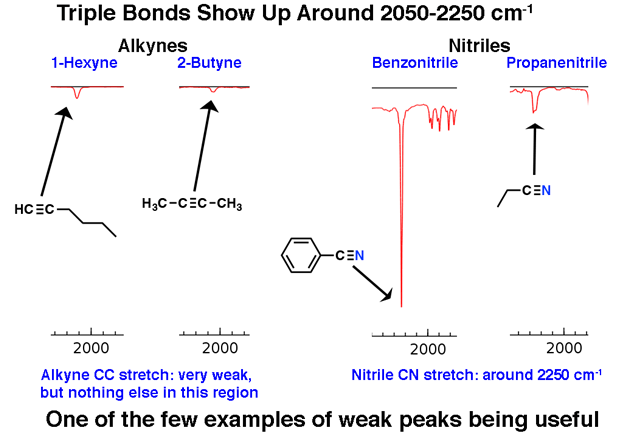
Observe como os picos do alcino são fracos. Esta é uma exceção para a regra de que se deve ignorar picos fracos. Ainda assim, é necessário cuidado: se você receber a fórmula molecular, confirme se um alcino é possível calculando os graus de insaturação e garantindo que seja pelo menos 2 ou mais.
Alcinos terminais (como 1-hexino) também têm uma forte extensão de CH em torno de 3400 cm-1 que é mais fortemente diagnóstica.
Glicose revisitada: a análise de 1 minuto
OK. Nós ultrapassamos r 4 regiões que são úteis para uma análise rápida de um espectro de IR.
Agora vamos voltar e olhar para o IR da glicose O que vemos?
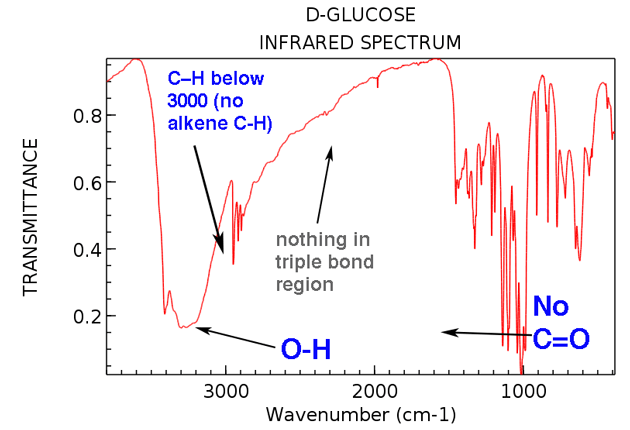
Aqui estão as duas coisas importantes a serem observadas:
Além disso, se tomamos um pouco de tempo extra, podemos ver:
- Nenhum alceno CH (sem picos acima de 3000 cm-1)
- Nada na região de ligação tripla (raro, mas ainda assim algo fácil de aprender a verificar)
Agora: se você recebesse esse espectro como um “desconhecido” junto com sua fórmula molecular, C6H12O6, que conclusões você poderia tirar sobre sua estrutura?
- A molécula tem pelo menos um grupo OH (e possivelmente mais)
- A molécula não tem nenhum grupo C = O
- A molécula * provavelmente * não tem nenhum alceno. Se algum alceno estiver presente, ele não carrega nenhuma ligação CH, porque veríamos seu CH se estender acima de 3000 cm-1.
A molécula com um grau de deficiência de hidrogênio (C6H12O6), mas sem C = O e provavelmente sem C = C?
Um bom palpite seria que a molécula contém um anel. (Sabemos que é o caso, claro, mas é bom ver o IR confirmando o que já sabemos).
Isso é o que uma análise de 1 minuto da RI da glicose pode nos dizer. Não toda a estrutura, veja bem, mas certamente algumas partes e peças importantes.
Isso é o suficiente por hoje. No próximo post, faremos mais algumas análises de 1 minuto e daremos exemplos mais concretos de como usar as informações em um espectro de IV para tirar conclusões sobre a estrutura molecular.
Mais sobre a região de 3200: Aminas , Amides e Terminal Alkyne CH
Enquanto estamos na região de 3200…. Aminas e amidas
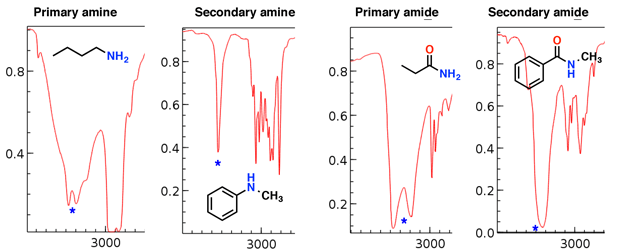
Aminas e amidas também têm trechos N-H que aparecem nesta região.
Observe como a amina primária e a amida primária têm duas “presas”, enquanto a amina secundária e a amida secundária têm um único pico.
Os trechos da amina tendem a ser mais nítidos do que a amida trechos; também as amidas podem ser distinguidas por um forte trecho C = O (veja abaixo).
Aminas primárias (clique para ver os espectros)
- Anilina
- Benzilamina
- Ciclohexilamina
Aminas secundárias:
- N-metilbenzilamina
- N, N-dibenzilamina
- N-metilanilina
Amidas primárias
- propionamida
- benzamida
- butanamida
Amidas secundárias
- N-metil benzamida
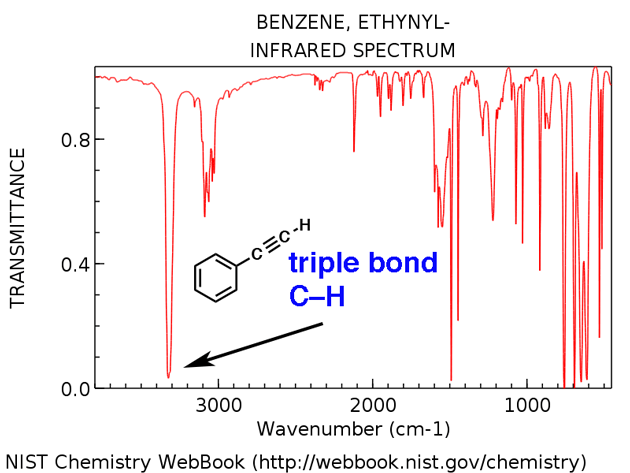
Alcino terminal CH
Alcinos terminais têm um trecho CH característico em torno de 3300 cm-1. Aqui é para etinilbenzeno, abaixo.
- Etinilbenzeno